Thông tư 11/2018/TT-BYT quy định về chất lượng thuốc, nguyên liệu làm thuốc do Bộ Y tế ban hành
Thông tư 11/2018/TT-BYT quy định về chất lượng thuốc, nguyên liệu làm thuốc do Bộ Y tế ban hành
| Số hiệu: | 11/2018/TT-BYT | Loại văn bản: | Thông tư |
| Nơi ban hành: | Bộ Y tế | Người ký: | Trương Quốc Cường |
| Ngày ban hành: | 04/05/2018 | Ngày hiệu lực: | Đã biết |
| Ngày công báo: | 03/06/2018 | Số công báo: | 669-670 |
| Tình trạng: | Đã biết |
| Số hiệu: | 11/2018/TT-BYT |
| Loại văn bản: | Thông tư |
| Nơi ban hành: | Bộ Y tế |
| Người ký: | Trương Quốc Cường |
| Ngày ban hành: | 04/05/2018 |
| Ngày hiệu lực: | Đã biết |
| Ngày công báo: | 03/06/2018 |
| Số công báo: | 669-670 |
| Tình trạng: | Đã biết |

|
BỘ Y TẾ |
CỘNG HÒA XÃ
HỘI CHỦ NGHĨA VIỆT NAM |
|
Số: 11/2018/TT-BYT |
Hà Nội, ngày 04 tháng 5 năm 2018 |
QUY ĐỊNH VỀ CHẤT LƯỢNG THUỐC, NGUYÊN LIỆU LÀM THUỐC
Căn cứ Luật số 105/2016/QH13 ngày 06 tháng 4 năm 2016 về dược;
Căn cứ Nghị định số 54/2017/NĐ-CP ngày 08 tháng 5 năm 2017 của Chính phủ quy định chi tiết một số điều và biện pháp thi hành Luật dược;
Căn cứ Nghị định số 75/2017/NĐ-CP ngày 20 tháng 6 năm 2017 của Chính phủ quy định chức năng, nhiệm vụ, quyền hạn và cơ cấu tổ chức của Bộ Y tế;
Theo đề nghị của Cục trưởng Cục Quản lý Dược,
Bộ Y tế ban hành Thông tư quy định về chất lượng thuốc, nguyên liệu làm thuốc.
Thông tư này quy định việc áp dụng tiêu chuẩn chất lượng thuốc (thuốc hóa dược, thuốc dược liệu, vắc xin, sinh phẩm), nguyên liệu làm thuốc (trừ dược liệu); việc kiểm nghiệm thuốc, nguyên liệu làm thuốc và thủ tục thu hồi, xử lý thuốc vi phạm.
Trong Thông tư này, một số từ ngữ dưới đây được hiểu như sau:
1. Tiêu chuẩn chất lượng thuốc, nguyên liệu làm thuốc là văn bản quy định về đặc tính kỹ thuật, bao gồm chỉ tiêu chất lượng, mức chất lượng, phương pháp kiểm nghiệm và yêu cầu quản lý khác có liên quan đến chất lượng thuốc, nguyên liệu làm thuốc.
2. GLP là chữ viết tắt của cụm từ tiếng Anh “Good Laboratory Practices”, được dịch sang tiếng Việt là “Thực hành tốt phòng thí nghiệm thuốc”.
3. WHO là chữ viết tắt của cụm từ tiếng Anh “World Health Organization”, được dịch sang tiếng Việt là Tổ chức Y tế thế giới.
4. ICH là chữ viết tắt của cụm từ tiếng Anh “International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use”, được dịch sang tiếng Việt là Hội nghị quốc tế về hài hòa các thủ tục đăng ký dược phẩm sử dụng cho con người.
ÁP DỤNG TIÊU CHUẨN CHẤT LƯỢNG THUỐC, NGUYÊN LIỆU LÀM THUỐC
1. Cơ sở kinh doanh dược, cơ sở pha chế thuốc áp dụng tiêu chuẩn chất lượng của thuốc, nguyên liệu làm thuốc theo dược điển hoặc theo tiêu chuẩn cơ sở đối với thuốc, nguyên liệu làm thuốc do cơ sở sản xuất, pha chế.
2. Cơ sở kinh doanh dược, cơ sở pha chế thuốc phải tiến hành thẩm định, đánh giá phương pháp kiểm nghiệm ghi trong tiêu chuẩn chất lượng thuốc, nguyên liệu làm thuốc do cơ sở sản xuất công bố áp dụng. Việc thẩm định phương pháp kiểm nghiệm thực hiện theo hướng dẫn về thẩm định quy trình phân tích của Hiệp hội các nước Đông Nam Á hoặc ICH được quy định tại Thông tư quy định việc đăng ký thuốc, nguyên liệu làm thuốc do Bộ trưởng Bộ Y tế ban hành.
3. Bộ Y tế tổ chức thẩm định hồ sơ và phê duyệt tiêu chuẩn chất lượng thuốc, nguyên liệu làm thuốc theo quy định về đăng ký thuốc, nguyên liệu làm thuốc, quy định về cấp phép nhập khẩu thuốc, nguyên liệu thuốc chưa có giấy đăng ký lưu hành.
1. Áp dụng Dược điển Việt Nam, dược điển tham chiếu:
a) Cơ sở kinh doanh dược, cơ sở pha chế thuốc được áp dụng Dược điển Việt Nam hoặc một trong các dược điển tham chiếu sau đây: Dược điển Châu Âu, Anh, Hoa Kỳ, Quốc tế, Nhật Bản;
b) Việc áp dụng tiêu chuẩn trong các dược điển quy định tại Điểm a Khoản này phải bao gồm toàn bộ các quy định về chỉ tiêu chất lượng, mức chất lượng và phương pháp kiểm nghiệm quy định tại chuyên luận thuốc, nguyên liệu làm thuốc tương ứng của dược điển áp dụng; bao gồm cả quy định về chỉ tiêu chất lượng, mức chất lượng và phương pháp kiểm nghiệm chung được quy định tại Phụ lục của dược điển;
d) Đối với thuốc dược liệu, cơ sở kinh doanh dược, cơ sở pha chế thuốc được áp dụng dược điển quy định tại Điểm a Khoản này hoặc dược điển nước xuất xứ của thuốc.
2. Áp dụng dược điển nước ngoài khác với các trường hợp quy định tại Điểm a Khoản 1 Điều này:
Trường hợp cơ sở kinh doanh dược, cơ sở pha chế thuốc áp dụng dược điển nước ngoài khác dược điển tham chiếu quy định tại Điểm a Khoản 1 Điều này, tiêu chuẩn chất lượng áp dụng tối thiểu phải đáp ứng các yêu cầu sau:
a) Đáp ứng yêu cầu về chỉ tiêu chất lượng và mức chất lượng được quy định tại chuyên luận tiêu chuẩn chất lượng tương ứng của Dược điển Việt Nam hoặc một trong các dược điển tham chiếu;
b) Phương pháp kiểm nghiệm chung được áp dụng phải phù hợp với phương pháp kiểm nghiệm chung tương ứng được ghi tại Dược điển Việt Nam hoặc một trong các dược điển tham chiếu quy định tại Điểm a Khoản 1 Điều này.
Điều 5. Áp dụng tiêu chuẩn cơ sở
1. Tiêu chuẩn cơ sở về thuốc, nguyên liệu làm thuốc phải đáp ứng quy định tại Điểm b Khoản 2 Điều 102 của Luật dược, cụ thể như sau:
a) Đáp ứng yêu cầu về chỉ tiêu chất lượng, mức chất lượng được quy định tại chuyên luận tương ứng của Dược điển Việt Nam và chỉ tiêu chất lượng, mức chất lượng, phương pháp kiểm nghiệm chung được quy định tại các Phụ lục của Dược điển Việt Nam;
b) Trường hợp Dược điển Việt Nam, dược điển tham chiếu quy định tại Điểm a Khoản 1 Điều 4 Thông tư này chưa có chuyên luận thuốc, nguyên liệu làm thuốc tương ứng, cơ sở xây dựng tiêu chuẩn trên cơ sở kết quả nghiên cứu khoa học (bao gồm cả kết quả nghiên cứu phát triển sản phẩm) hoặc theo quy định của dược điển nước ngoài khác.
2. Tiêu chuẩn cơ sở của thuốc pha chế, bào chế tại cơ sở khám bệnh, chữa bệnh do cơ sở xây dựng, đánh giá sự phù hợp và được người đứng đầu cơ sở ban hành.
Điều 6. Cập nhật tiêu chuẩn chất lượng và áp dụng dược điển cập nhật
a) Dược điển phiên bản hiện hành;
b) Các dược điển phiên bản trước phiên bản hiện hành, nhưng không quá 02 năm tính đến thời điểm dược điển phiên bản hiện hành có hiệu lực.
3. Trong quá trình lưu hành thuốc, nguyên liệu làm thuốc, cơ sở sản xuất, cơ sở đăng ký phát hiện yếu tố có ảnh hưởng nghiêm trọng đến chất lượng, an toàn, hiệu quả của thuốc hoặc theo yêu cầu của Bộ Y tế (Cục Quản lý Dược), cơ sở sản xuất phải tiến hành cập nhật chỉ tiêu vào tiêu chuẩn chất lượng thuốc, nguyên liệu làm thuốc để kiểm soát được yếu tố ảnh hưởng trên.
KIỂM NGHIỆM THUỐC, NGUYÊN LIỆU LÀM THUỐC
Điều 7. Kiểm nghiệm thuốc, nguyên liệu làm thuốc
Trường hợp tiêu chuẩn chất lượng thuốc, nguyên liệu làm thuốc không được cập nhật, cơ sở kiểm nghiệm áp dụng dược điển tương ứng quy định tại Khoản 1 và Khoản 2 Điều 6 Thông tư này, tính theo ngày sản xuất lô thuốc, nguyên liệu làm thuốc được kiểm nghiệm.
Trường hợp thuốc pha chế, bào chế tại cơ sở khám bệnh, chữa bệnh, việc kiểm nghiệm được thực hiện theo tiêu chuẩn chất lượng thuốc do cơ sở xây dựng, ban hành.
2. Việc lấy mẫu thuốc, nguyên liệu làm thuốc để kiểm nghiệm thực hiện theo quy định tại Phụ lục I, biên bản lấy mẫu theo quy định tại Mẫu số 01 Phụ lục III ban hành kèm theo Thông tư này.
3. Trả lời kết quả phân tích, kiểm nghiệm thuốc, nguyên liệu làm thuốc:
a) Kết quả phân tích, kiểm nghiệm mẫu thuốc, nguyên liệu làm thuốc được thể hiện trên phiếu kiểm nghiệm hoặc phiếu phân tích quy định tại Mẫu số 02 và Mẫu số 03 quy định tại Phụ lục III ban hành kèm theo Thông tư này;
b) Trong thời hạn tối đa 15 ngày, kể từ ngày nhận được mẫu thuốc, cơ sở kiểm nghiệm phải trả lời kết quả kiểm nghiệm, phân tích mẫu thuốc được lấy bởi cơ quan kiểm tra chất lượng trong các trường hợp sau:
- Thuốc có thông tin về phản ứng có hại nghiêm trọng;
- Thuốc của cơ sở có vi phạm nghiêm trọng về đáp ứng Thực hành tốt;
- Thuốc được lấy mẫu bổ sung trong các trường hợp quy định tại Điểm b Khoản 1 và Điểm b Khoản 2 Điều 14 Thông tư này.
- Thuốc phải kiểm nghiệm trước khi lưu hành theo quy định tại Khoản 1 Điều 8 Thông tư này;
- Thuốc không thuộc trường hợp quy định tại Điểm b, Điểm d Khoản này.
d) Trong thời hạn tối đa 30 ngày, kể từ ngày nhận được mẫu thuốc, nguyên liệu làm thuốc, cơ sở kiểm nghiệm phải trả lời kết quả kiểm nghiệm, phân tích mẫu trong các trường hợp sau:
- Thuốc, nguyên liệu làm thuốc có các phép thử có yêu cầu về thời gian thử nghiệm kéo dài;
- Thuốc, nguyên liệu làm thuốc có tiêu chuẩn chất lượng cần thẩm định lại hoặc đánh giá lại kết quả kiểm nghiệm;
- Thuốc, nguyên liệu làm thuốc có nghi ngờ về thành phần, chất lượng, phải áp dụng phương pháp kiểm nghiệm khác với phương pháp ghi trong tiêu chuẩn chất lượng đã đăng ký;
- Thuốc, nguyên liệu làm thuốc có phép thử mà cơ sở kiểm nghiệm không có đủ điều kiện thử nghiệm (ví dụ: thiếu thiết bị máy móc, hóa chất, thuốc thử, chất chuẩn).
đ) Trường hợp không đáp ứng được thời hạn trả lời kết quả phân tích, kiểm nghiệm theo quy định tại các Điểm b, c và d Khoản này, cơ sở kiểm nghiệm phải giải trình lý do tại văn bản kèm theo phiếu kiểm nghiệm, phiếu phân tích;
e) Trong thời hạn 24 giờ, kể từ thời điểm ban hành phiếu kiểm nghiệm hoặc phiếu phân tích, cơ sở kiểm nghiệm phải gửi phiếu kiểm nghiệm hoặc phiếu phân tích tới cơ quan kiểm tra chất lượng, cơ sở sản xuất, cơ sở nhập khẩu có thuốc, nguyên liệu làm thuốc được lấy mẫu và cơ sở được lấy mẫu.
Trường hợp mẫu thuốc, nguyên liệu làm thuốc không đạt tiêu chuẩn chất lượng, trong thời hạn 24 giờ, kể từ thời điểm ban hành phiếu phân tích hoặc phiếu kiểm nghiệm, cơ sở kiểm nghiệm phải gửi công văn thông báo về mẫu thuốc, nguyên liệu làm thuốc không đạt tiêu chuẩn chất lượng kèm theo phiếu kiểm nghiệm hoặc phiếu phân tích tới Bộ Y tế (Cục Quản lý Dược) theo hình thức văn bản hành chính và văn bản điện tử (bản scan) đến địa chỉ email: quanlychatluongthuoc.qld@moh.gov.vn hoặc tin nhắn đến số điện thoại của Cục Quản lý Dược từ địa chỉ, số điện thoại giao dịch chính thức của cơ sở kiểm nghiệm và Sở Y tế nơi có thuốc, nguyên liệu làm thuốc được lấy mẫu.
g) Đối với mẫu thuốc, nguyên liệu làm thuốc do cơ sở kinh doanh dược, cơ sở sử dụng, tổ chức, cá nhân gửi tới để phân tích, kiểm nghiệm hoặc thẩm định tiêu chuẩn chất lượng thuốc, nguyên liệu làm thuốc, thời gian trả lời kết quả phân tích, kiểm nghiệm theo thỏa thuận của các bên.
4. Khiếu nại và giải quyết khiếu nại kết quả kiểm nghiệm:
a) Trường hợp không nhất trí với kết quả kiểm nghiệm mẫu, trong thời hạn 05 ngày kể từ ngày nhận được thông báo kết quả kiểm nghiệm mẫu thuốc, nguyên liệu làm thuốc, cơ sở kinh doanh dược có quyền đề nghị cơ quan kiểm tra chất lượng nhà nước chỉ định cơ sở kiểm nghiệm khác tiến hành phân tích, kiểm nghiệm xác định kết quả kiểm nghiệm chất lượng thuốc, nguyên liệu làm thuốc;
b) Việc kiểm nghiệm lại chỉ tiêu chất lượng bị khiếu nại kết quả được thực hiện tại cơ sở kiểm nghiệm do Bộ Y tế chỉ định theo quy định tại Khoản 2 Điều 105 của Luật dược.
5. Lưu mẫu:
a) Thuốc, nguyên liệu làm thuốc sau khi được kiểm nghiệm và kết luận xác định chất lượng phải được lưu mẫu. Mẫu thuốc, nguyên liệu làm thuốc lưu phải được niêm phong và bảo quản theo điều kiện ghi trên nhãn.
b) Thời gian lưu mẫu:
- Đối với các cơ sở sản xuất, cơ sở nhập khẩu thuốc, nguyên liệu làm thuốc: mẫu thuốc thành phẩm phải được lưu ít nhất 12 tháng sau khi hết hạn dùng của thuốc; mẫu nguyên liệu là hoạt chất dùng cho sản xuất thuốc phải được lưu ít nhất 12 tháng sau khi hết hạn dùng của thành phẩm sản xuất từ nguyên liệu đó;
- Đối với cơ sở kiểm nghiệm thuốc: thời gian lưu mẫu ít nhất 12 tháng sau khi hết hạn dùng của thuốc; hoặc 24 tháng kể từ ngày lấy mẫu đối với mẫu thuốc được lấy để kiểm tra chất lượng, hoặc kể từ ngày tiếp nhận đối với mẫu gửi trong các trường hợp lấy mẫu bổ sung quy định tại Điểm b Khoản 1 và Điểm b Khoản 2 Điều 14 Thông tư này.
a) Hồ sơ, tài liệu liên quan đến công tác kiểm tra chất lượng thuốc, nguyên liệu làm thuốc đều phải lưu giữ theo quy định tại Luật lưu trữ và các văn bản hướng dẫn liên quan;
b) Hồ sơ, tài liệu liên quan đến thuốc, nguyên liệu làm thuốc chứa gây nghiện, hướng tâm thần, tiền chất dùng làm thuốc và thuốc phóng xạ: thời gian lưu trữ ít nhất là 02 năm kể từ khi hết hạn dùng của thuốc;
c) Hồ sơ, tài liệu khi hết thời gian lưu trữ được xử lý theo quy định hiện hành.
Điều 8. Kiểm nghiệm trước khi lưu hành đối với thuốc được quy định tại Khoản 4 Điều 103 của Luật dược
1. Thuốc thuộc một trong các trường hợp sau đây phải được kiểm nghiệm bởi cơ sở kiểm nghiệm do Bộ Y tế (Cục Quản lý Dược) chỉ định trước khi lưu hành:
a) Thuốc quy định tại Điểm a và Điểm b Khoản 4 Điều 103 của Luật dược;
b) Sinh phẩm là dẫn xuất của máu và huyết tương người;
c) Thuốc nhập khẩu theo quy định tại Điều 70 Nghị định số 54/2017/NĐ-CP ngày 08 tháng 5 năm 2017 của Chính phủ quy định chi tiết một số điều và biện pháp thi hành Luật dược (sau đây viết tắt là Nghị định số 54/2017/NĐ-CP);
d) Thuốc được sản xuất bởi cơ sở sản xuất thuốc nước ngoài thuộc Danh sách cơ sở sản xuất có thuốc vi phạm chất lượng do Bộ Y tế (Cục Quản lý Dược) công bố.
2. Quy định việc kiểm nghiệm xác định chất lượng thuốc:
a) Lấy mẫu thuốc:
- Đối với thuốc quy định tại các Điểm a, b và c Khoản 1 Điều này, việc lấy mẫu do cơ sở sản xuất (đối với thuốc sản xuất trong nước) hoặc cơ sở nhập khẩu (đối với thuốc nhập khẩu) thực hiện;
- Đối với thuốc quy định tại Điểm d Khoản 1 Điều này, cơ sở nhập khẩu đề nghị cơ quan kiểm tra chất lượng hoặc cơ quan kiểm nghiệm nhà nước lấy mẫu.
b) Cơ sở nhập khẩu thực hiện việc gửi mẫu thuốc đã lấy kèm theo bản photocopy phiếu kiểm nghiệm gốc của nhà sản xuất tới cơ sở kiểm nghiệm thuốc theo quy định tại Khoản 3 Điều này để kiểm nghiệm xác định chất lượng thuốc theo tiêu chuẩn chất lượng thuốc đã được phê duyệt;
c) Cơ sở sản xuất, cơ sở nhập khẩu vắc xin, sinh phẩm là huyết thanh chứa kháng thể, dẫn xuất của máu và huyết tương người thuộc trường hợp quy định tại các Điểm a và Điểm b Khoản 1 Điều này tiến hành gửi mẫu theo quy định tại Điều 10 và Điều 11 Thông tư này;
d) Trong thời hạn quy định tại Điểm c Khoản 3 Điều 7 Thông tư này, cơ sở kiểm nghiệm phải trả lời kết quả kiểm nghiệm đối với mẫu thuốc nhận được.
3. Bộ Y tế (Cục Quản lý Dược) chỉ định cơ sở kiểm nghiệm đã được cấp Giấy chứng nhận đủ điều kiện kinh doanh dược có phạm vi kiểm nghiệm thuốc hoặc cơ sở kiểm nghiệm quy định tại Khoản 1 Điều 35 của Luật dược đáp ứng GLP thực hiện việc kiểm nghiệm thuốc quy định tại Khoản 1 Điều này.
Trường hợp cơ sở kiểm nghiệm không đủ điều kiện để thử một hoặc một số phép thử, cơ sở kiểm nghiệm phải thông báo và phối hợp với cơ sở sản xuất, cơ sở nhập khẩu gửi mẫu để thử nghiệm các phép thử này tại cơ sở kiểm nghiệm khác đáp ứng GLP hoặc Phòng thử nghiệm đáp ứng tiêu chuẩn ISO/IEC 17025 và có đủ điều kiện thực hiện phép thử.
4. Định kỳ hàng tháng, cơ sở kiểm nghiệm được chỉ định báo cáo việc kiểm nghiệm thuốc về Bộ Y tế (Cục Quản lý Dược) theo quy định tại Mẫu số 07 Phụ lục III ban hành kèm theo Thông tư này.
5. Bộ Y tế (Cục Quản lý Dược) công bố và cập nhật danh sách cơ sở kiểm nghiệm được chỉ định theo quy định tại Khoản 3 Điều này trên Trang thông tin điện tử của Cục Quản lý Dược.
6. Cơ sở sản xuất, cơ sở nhập khẩu thuốc chịu trách nhiệm:
a) Chi trả kinh phí kiểm nghiệm xác định chất lượng thuốc của cơ sở sản xuất, cơ sở nhập khẩu theo quy định;
b) Cung cấp chất chuẩn, chất đối chiếu, tạp chuẩn cho cơ sở kiểm nghiệm trong trường hợp Viện Kiểm nghiệm thuốc Trung ương, Viện Kiểm nghiệm thuốc thành phố Hồ Chí Minh, Viện Kiểm định Quốc gia vắc xin và sinh phẩm y tế hoặc cơ sở kiểm nghiệm khác chưa nghiên cứu thiết lập được;
c) Chỉ được đưa ra lưu thông, phân phối các lô thuốc đã có kết quả kiểm nghiệm đạt tiêu chuẩn chất lượng.
7. Việc kiểm nghiệm vắc xin, sinh phẩm là huyết thanh chứa kháng thể, dẫn xuất của máu và huyết tương người được thực hiện theo quy định tại Điều 10 và Điều 11 Thông tư này.
1. Thời hạn kiểm nghiệm tính từ thời điểm lô thuốc đầu tiên được nhập khẩu sau thời điểm Bộ Y tế (Cục Quản lý Dược) công bố Danh sách cơ sở sản xuất có thuốc vi phạm chất lượng như sau:
a) 06 tháng đối với cơ sở sản xuất có 01 lô thuốc vi phạm mức độ 3;
b) 12 tháng đối với cơ sở sản xuất có 01 lô thuốc vi phạm mức độ 2 hoặc có từ 02 lô thuốc vi phạm mức độ 3 trở lên;
c) 24 tháng đối với cơ sở sản xuất có 01 lô thuốc vi phạm mức độ 1 hoặc có từ 02 lô thuốc vi phạm mức độ 2 trở lên;
d) Trường hợp cơ sở sản xuất tiếp tục có thuốc vi phạm chất lượng, thời gian phải thực hiện kiểm nghiệm kéo dài theo phương pháp cộng dồn.
a) Cơ sở nhập khẩu thực hiện đầy đủ việc kiểm nghiệm thuốc trước khi đưa ra lưu hành theo thời hạn quy định tại Khoản 1 Điều này;
b) Cơ sở sản xuất hoặc cơ sở đăng ký thuốc có báo cáo theo quy định tại Mẫu số 07 Phụ lục III ban hành kèm theo Thông tư này, kèm theo bằng chứng thực hiện việc kiểm nghiệm toàn bộ các lô thuốc nhập khẩu vào Việt Nam trong thời hạn thực hiện quy định tại Khoản 1 Điều này;
c) Cơ sở sản xuất không có vi phạm chất lượng thuốc (kể cả thu hồi thuốc theo hình thức tự nguyện vì lý do chất lượng) trong thời hạn thực hiện quy định tại Khoản 1 Điều này.
3. Định kỳ hàng tháng, căn cứ báo cáo của cơ sở kiểm nghiệm tham gia vào hoạt động kiểm nghiệm, báo cáo của cơ sở sản xuất, cơ sở đăng ký thuốc, Bộ Y tế (Cục Quản lý Dược) công bố cập nhật Danh sách cơ sở sản xuất có thuốc vi phạm chất lượng, rút tên cơ sở sản xuất đáp ứng quy định tại Khoản 2 Điều này khỏi Danh sách cơ sở sản xuất có thuốc vi phạm chất lượng.
1. Cơ sở sản xuất, cơ sở nhập khẩu phải gửi mẫu và hồ sơ sản xuất vắc xin, sinh phẩm là huyết thanh chứa kháng thể, dẫn xuất của máu và huyết tương người đến Viện Kiểm định Quốc gia vắc xin và sinh phẩm y tế để kiểm nghiệm đánh giá trước khi đưa ra lưu hành. Hồ sơ gửi mẫu kiểm nghiệm được quy định tại Điều 11 Thông tư này.
Cơ sở sản xuất, cơ sở nhập khẩu chỉ được phép đưa ra lưu hành, sử dụng lô vắc xin, sinh phẩm là huyết thanh chứa kháng thể, dẫn xuất của máu và huyết tương người sau khi có giấy chứng nhận chất lượng do Viện Kiểm định Quốc gia vắc xin và sinh phẩm y tế cấp, xác nhận lô vắc xin, sinh phẩm đạt tiêu chuẩn chất lượng, bảo đảm an toàn, hiệu quả.
2. Trong thời hạn quy định tại Khoản 3 Điều 7 Thông tư này, kể từ ngày nhận đủ mẫu và hồ sơ theo quy định tại Điều 11 Thông tư này, Viện Kiểm định Quốc gia vắc xin và sinh phẩm y tế tiến hành:
a) Rà soát hồ sơ, tiến hành kiểm nghiệm mẫu vắc xin, sinh phẩm gửi tới;
b) Cấp giấy chứng nhận chất lượng theo quy định tại Mẫu số 08 Phụ lục III ban hành kèm theo Thông tư này, trong đó chỉ rõ các nội dung đáp ứng hoặc không đáp ứng yêu cầu và kết luận về chất lượng, an toàn, hiệu quả của lô vắc xin, sinh phẩm;
c) Thông báo kết quả kiểm nghiệm về Bộ Y tế (Cục Quản lý Dược).
1. Đối với vắc xin, sinh phẩm là huyết thanh chứa kháng thể, dẫn xuất của máu và huyết tương người được sản xuất trong nước: Cơ sở sản xuất gửi hồ sơ sản xuất và mẫu của lô sản phẩm (thành phẩm, bán thành phẩm) tới Viện Kiểm định Quốc gia vắc xin và sinh phẩm y tế bao gồm:
a) Phiếu gửi mẫu kiểm nghiệm;
c) Hồ sơ tóm tắt sản xuất và kiểm tra chất lượng của lô vắc xin, sinh phẩm (bản sao có đóng dấu xác nhận của cơ sở sản xuất);
d) Phiếu kiểm nghiệm lô của cơ sở sản xuất.
2. Đối với vắc xin, sinh phẩm là huyết thanh chứa kháng thể, dẫn xuất của máu và huyết tương người nhập khẩu: Cơ sở nhập khẩu phải gửi hồ sơ sản xuất và mẫu của lô sản phẩm tới Viện Kiểm định Quốc gia vắc xin và sinh phẩm y tế bao gồm:
a) Phiếu gửi mẫu kiểm nghiệm;
c) Hồ sơ tóm tắt sản xuất và kiểm tra chất lượng của lô vắc xin, sinh phẩm nhập khẩu (bản sao có đóng dấu xác nhận của cơ sở sản xuất hoặc của cơ sở nhập khẩu);
đ) Bảng dữ liệu theo dõi điều kiện bảo quản (dây chuyền lạnh) trong quá trình vận chuyển lô hàng nhập khẩu (có đóng dấu xác nhận của cơ sở nhập khẩu) từ các thiết bị tự ghi nhiệt độ, kết quả chỉ thị đông băng (nếu có).
QUY ĐỊNH VỀ THU HỒI THUỐC VÀ XỬ LÝ THUỐC VI PHẠM
Điều 12. Thủ tục thu hồi thuốc theo hình thức bắt buộc
1. Tiếp nhận thông tin về thuốc vi phạm:
Bộ Y tế (Cục Quản lý Dược) tiếp nhận thông tin về thuốc vi phạm từ:
a) Thông tin đánh giá thuốc không bảo đảm hiệu quả điều trị, tính an toàn của Hội đồng tư vấn đăng ký thuốc hoặc Hội đồng tư vấn về xử lý tai biến sau tiêm chủng vắc xin;
b) Thông tin về chất lượng thuốc không đạt từ cơ sở kiểm nghiệm thuốc;
c) Thông tin về thuốc vi phạm do Cục Quản lý Dược, Cơ quan thanh tra y tế/ dược phát hiện;
d) Thông báo về thuốc vi phạm của cơ sở sản xuất, cơ quan quản lý, cơ quan kiểm tra chất lượng nhà nước về thuốc của nước ngoài;
đ) Thông tin về thuốc vi phạm do cơ quan công an, hải quan, quản lý thị trường phát hiện;
e) Thông tin về thuốc do cơ sở kinh doanh dược đề nghị thu hồi tự nguyện cung cấp.
2. Xác định mức độ vi phạm:
Trường hợp cần xin ý kiến của Hội đồng tư vấn cấp giấy đăng ký lưu hành thuốc để xác định mức độ vi phạm theo quy định tại Mục IV Phụ lục II ban hành kèm theo Thông tư này, thời hạn xác định mức độ vi phạm của thuốc phải thực hiện tối đa 7 ngày.
b) Mức độ vi phạm của thuốc được quy định tại Phụ lục II ban hành kèm theo Thông tư này;
c) Đối với thông tin về thuốc vi phạm quy định tại Điểm b Khoản 1 Điều này, việc xử lý được tiến hành theo quy định tại Điều 14 Thông tư này.
3. Ban hành quyết định thu hồi thuốc:
a) Trong thời hạn không quá 24 giờ, kể từ thời điểm kết luận về việc thu hồi thuốc, Bộ Y tế (Cục Quản lý Dược) ban hành quyết định thu hồi thuốc theo quy định tại Khoản 1 Điều 65 của Luật dược;
b) Quyết định thu hồi phải bao gồm các thông tin sau: tên thuốc, số giấy đăng ký lưu hành hoặc số giấy phép nhập khẩu, tên hoạt chất, nồng độ, hàm lượng, dạng bào chế, số lô, hạn dùng, cơ sở sản xuất, cơ sở nhập khẩu, mức độ thu hồi, cơ sở chịu trách nhiệm thu hồi thuốc.
4. Thông báo quyết định thu hồi thuốc:
a) Quyết định thu hồi thuốc của Bộ Y tế (Cục Quản lý Dược) thông báo dưới các hình thức thư tín, fax, email, điện thoại hoặc các phương tiện thông tin đại chúng. Phạm vi thông báo quyết định thu hồi theo quy định tại Khoản 3 Điều 63 của Luật dược;
b) Ngay sau khi có quyết định thu hồi, Bộ Y tế (Cục Quản lý Dược) công bố quyết định thu hồi thuốc trên Cổng thông tin điện tử của Bộ Y tế, Trang thông tin điện tử của Cục Quản lý Dược và trên cơ sở dữ liệu quốc gia về dược của Bộ Y tế;
Sở Y tế công bố thông tin về quyết định thu hồi thuốc trên Trang thông tin điện tử của Sở ngay sau khi nhận được quyết định thu hồi.
Cơ sở sản xuất thuốc trong nước, cơ sở nhập khẩu phải thông báo thông tin về thuốc bị thu hồi đến các cơ sở kinh doanh, sử dụng đã mua thuốc.
c) Trường hợp thu hồi thuốc vi phạm ở mức độ 1, ngoài việc thực hiện theo quy định tại Điểm b Khoản này, quyết định thu hồi thuốc phải được Bộ Y tế thông báo trên Đài truyền hình Việt Nam và Đài tiếng nói Việt Nam.
a) Cơ sở kinh doanh, sử dụng thuốc phải dừng việc cung cấp, sử dụng; biệt trữ thuốc còn tồn tại cơ sở; lập danh sách các cơ sở kinh doanh, sử dụng, cá nhân (nếu có) đã mua thuốc, liên hệ và tiếp nhận thuốc được trả về; trả về cơ sở cung cấp thuốc;
b) Cơ sở sản xuất (đối với thuốc sản xuất trong nước), cơ sở nhập khẩu phối hợp với cơ sở ủy thác nhập khẩu hoặc cơ sở đầu mối phân phối thuốc (đối với thuốc nhập khẩu) chịu trách nhiệm thực hiện thu hồi thuốc vi phạm. Biên bản thu hồi thuốc thực hiện theo quy định tại Mẫu số 04 Phụ lục III ban hành kèm theo Thông tư này.
Trường hợp cơ sở kinh doanh, cung cấp thuốc không thực hiện thu hồi thuốc hoặc không tiếp nhận thuốc trả về, cơ sở, cá nhân mua, sử dụng thuốc báo cáo Sở Y tế trên địa bàn để xử lý theo quy định.
c) Việc thu hồi thuốc phải được hoàn thành trong thời hạn quy định tại Khoản 3 Điều 63 của Luật dược.
6. Báo cáo kết quả thu hồi, đánh giá hiệu quả thu hồi và xử lý bổ sung:
a) Trong thời hạn 01 ngày đối với trường hợp thu hồi mức độ 1, 03 ngày đối với trường hợp thu hồi mức độ 2, mức độ 3 kể từ ngày hoàn thành việc thu hồi, cơ sở chịu trách nhiệm thực hiện thu hồi phải báo cáo bằng văn bản kết quả thu hồi về Bộ Y tế (Cục Quản lý Dược) và Sở Y tế trên địa bàn cơ sở kinh doanh được chịu trách nhiệm thu hồi thuốc. Báo cáo gồm các tài liệu sau đây:
- Báo cáo tóm tắt về thuốc bị thu hồi theo quy định tại Mẫu số 05 Phụ lục III ban hành kèm theo Thông tư này;
- Danh sách các cơ sở kinh doanh, sử dụng thuốc (bao gồm cơ sở được cung cấp trực tiếp từ cơ sở chịu trách nhiệm thực hiện thu hồi thuốc vi phạm và các cơ sở được cung cấp từ các cơ sở phân phối) kèm theo thông tin về địa chỉ, số điện thoại, email (nếu có), số lượng cung cấp, số lượng thuốc đã thu hồi;
- Biên bản giao nhận, hóa đơn xuất trả lại hàng hoặc các bằng chứng khác thể hiện việc thu hồi thuốc;
- Báo cáo tự đánh giá về hiệu quả thu hồi thuốc;
- Kết quả điều tra, đánh giá nguyên nhân, đánh giá nguy cơ đối với các lô khác của thuốc vi phạm và/hoặc các thuốc khác được sản xuất trên cùng dây chuyền sản xuất.
b) Bộ Y tế (Cục Quản lý Dược) xem xét báo cáo kết quả thu hồi quy định tại Điểm a Khoản này, đánh giá hoặc giao Sở Y tế đánh giá hiệu quả thu hồi. Trường hợp hiệu quả thu hồi được đánh giá chưa triệt để, sản phẩm có khả năng vẫn tiếp tục được lưu hành, sử dụng và có nguy cơ ảnh hưởng xấu đến sức khỏe người sử dụng, Cục Quản lý Dược phối hợp với Sở Y tế và cơ quan chức năng có liên quan tổ chức thực hiện cưỡng chế thu hồi.
Điều 13. Thủ tục thu hồi thuốc theo hình thức tự nguyện
1. Cơ sở kinh doanh dược thu hồi thuốc theo hình thức tự nguyện tự đánh giá, xác định mức độ vi phạm của thuốc và báo cáo bằng văn bản về Bộ Y tế (Cục Quản lý Dược), trong đó nêu rõ thông tin về thuốc vi phạm, mức độ vi phạm, lý do thu hồi, đề xuất biện pháp xử lý thuốc bị thu hồi theo quy định tại Khoản 3, Khoản 4 Điều 15 Thông tư này.
2. Trong thời hạn 03 ngày, kể từ ngày nhận được báo cáo của cơ sở kinh doanh dược, Bộ Y tế (Cục Quản lý Dược) xem xét báo cáo của cơ sở kinh doanh dược, xác định mức độ vi phạm của thuốc theo quy định tại Phụ lục II ban hành kèm theo Thông tư này.
a) Trường hợp đồng ý với đề xuất của cơ sở kinh doanh dược về vi phạm mức độ 3 của thuốc, Bộ Y tế (Cục Quản lý Dược) có văn bản đồng ý để cơ sở thu hồi tự nguyện;
b) Trường hợp xác định thuốc vi phạm mức độ 1 hoặc 2, Bộ Y tế (Cục Quản lý Dược) thực hiện các thủ tục thu hồi thuốc quy định tại các Khoản 3, 4, 5 và 6 Điều 12 Thông tư này;
c) Trường hợp cần bổ sung hoặc làm rõ thông tin trong báo cáo của cơ sở kinh doanh dược, Bộ Y tế (Cục Quản lý Dược) có văn bản yêu cầu cơ sở cung cấp bổ sung, giải trình. Trong thời hạn 05 ngày, kể từ ngày nhận được văn bản của Bộ Y tế (Cục Quản lý Dược), cơ sở phải có văn bản bổ sung, giải trình.
3. Trong thời hạn 24 giờ, kể từ thời điểm Bộ Y tế (Cục Quản lý Dược) có văn bản đồng ý để cơ sở thu hồi tự nguyện, cơ sở kinh doanh được ban hành quyết định thu hồi thuốc, thông báo tới các cơ sở kinh doanh, sử dụng và thực hiện việc thu hồi thuốc quy định tại các Khoản 5 và Khoản 6 Điều 12 Thông tư này.
Điều 14. Xử lý thuốc không đạt tiêu chuẩn chất lượng theo nơi lấy mẫu
1. Trường hợp mẫu thuốc vi phạm do cơ quan kiểm tra chất lượng lấy tại cơ sở bán lẻ thuốc, cơ sở khám bệnh, chữa bệnh hạng III, hạng IV:
a) Trong thời hạn 24 giờ, kể từ thời điểm nhận được phiếu kiểm nghiệm hoặc phiếu phân tích do cơ sở kiểm nghiệm gửi tới, Sở Y tế tiến hành niêm phong thuốc không đạt chất lượng tại cơ sở đã lấy mẫu;
b) Trong thời hạn 48 giờ, kể từ thời điểm nhận được phiếu kiểm nghiệm hoặc phiếu phân tích do cơ sở kiểm nghiệm gửi tới, Bộ Y tế (Cục Quản lý Dược) có văn bản yêu cầu cơ sở đăng ký, cơ sở sản xuất hoặc cơ sở nhập khẩu có trách nhiệm:
- Báo cáo về việc phân phối thuốc gửi Bộ Y tế (Cục Quản lý Dược);
- Đề nghị cơ quan kiểm tra chất lượng lấy mẫu bổ sung tại cơ sở sản xuất thuốc trong nước hoặc cơ sở nhập khẩu đối với thuốc nước ngoài và tại ít nhất 02 cơ sở bán buôn, trong đó có cơ sở bán buôn đã cung cấp thuốc cho cơ sở đã được lấy mẫu;
- Gửi mẫu đã lấy tới cơ sở kiểm nghiệm tuyến Trung ương để kiểm tra chất lượng đối với chỉ tiêu không đạt.
c) Trường hợp ít nhất 01 (một) mẫu thuốc được lấy bổ sung không đạt tiêu chuẩn chất lượng, Bộ Y tế (Cục Quản lý Dược) xác định mức độ vi phạm và kết luận về việc thu hồi thuốc vi phạm theo quy định tại Phụ lục II ban hành kèm theo Thông tư này, ban hành quyết định thu hồi thuốc theo quy định tại Khoản 3 Điều 12 Thông tư này. Phạm vi và thời gian thu hồi thực hiện theo quy định tại Khoản 3 Điều 63 Luật dược;
d) Trường hợp các mẫu thuốc được lấy bổ sung đạt tiêu chuẩn chất lượng, Bộ Y tế (Cục Quản lý Dược) chỉ xác định mức độ vi phạm, kết luận về việc thu hồi thuốc vi phạm, ban hành quyết định thu hồi và xử lý đối với thuốc của cơ sở đã lấy mẫu ban đầu.
2. Trường hợp mẫu thuốc vi phạm do cơ quan kiểm tra chất lượng lấy tại cơ sở bán buôn, cơ sở khám bệnh, chữa bệnh hạng II trở lên:
a) Trong thời hạn 24 giờ, kể từ thời điểm nhận được phiếu kiểm nghiệm hoặc phiếu phân tích do cơ sở kiểm nghiệm gửi tới, Sở Y tế tiến hành niêm phong thuốc không đạt chất lượng tại cơ sở đã lấy mẫu;
b) Trong thời hạn 48 giờ, kể từ thời điểm nhận được phiếu kiểm nghiệm hoặc phiếu phân tích do cơ sở kiểm nghiệm gửi tới, Bộ Y tế (Cục Quản lý Dược) ban hành quyết định thu hồi thuốc trên địa bàn tỉnh, thành phố trực thuộc Trung ương nơi lấy mẫu và các cơ sở kinh doanh, sử dụng đã được cơ sở bán buôn nơi lấy mẫu thuốc cung cấp theo quy định tại Khoản 3 Điều 12 Thông tư này và có văn bản yêu cầu cơ sở đăng ký, cơ sở sản xuất hoặc cơ sở nhập khẩu có trách nhiệm:
- Báo cáo về việc phân phối thuốc gửi Bộ Y tế (Cục Quản lý Dược);
- Đề nghị cơ quan kiểm tra chất lượng lấy mẫu bổ sung ít nhất 02 mẫu thuốc tại cơ sở bán buôn khác, trong đó có cơ sở bán buôn đã cung cấp thuốc cho cơ sở đã được lấy mẫu;
- Gửi mẫu đã lấy tới cơ sở kiểm nghiệm tuyến Trung ương để kiểm tra chất lượng đối với chỉ tiêu không đạt.
c) Trường hợp ít nhất 01 (một) mẫu thuốc được lấy bổ sung không đạt tiêu chuẩn chất lượng, Bộ Y tế (Cục Quản lý Dược) xác định mức độ vi phạm và kết luận về việc thu hồi thuốc vi phạm theo quy định tại Phụ lục II ban hành kèm theo Thông tư này, ban hành quyết định thu hồi thuốc theo quy định tại Khoản 3 Điều 12 Thông tư này. Phạm vi và thời gian thu hồi thực hiện theo quy định tại Khoản 3 Điều 63 Luật dược;
d) Trường hợp các mẫu thuốc được lấy bổ sung đạt tiêu chuẩn chất lượng, Bộ Y tế (Cục Quản lý Dược) chỉ thực hiện quy định tại Điểm b Khoản này.
3. Trường hợp mẫu thuốc do cơ quan kiểm tra chất lượng lấy lại cơ sở sản xuất, cơ sở nhập khẩu, cơ sở kinh doanh dịch vụ bảo quản hoặc mẫu thuốc được xác định vi phạm chất lượng do nguyên nhân trong quá trình sản xuất, Bộ Y tế (Cục Quản lý Dược) xác định mức độ vi phạm và kết luận về việc thu hồi thuốc vi phạm theo quy định tại Phụ lục II ban hành kèm theo Thông tư này, ban hành quyết định thu hồi thuốc theo quy định tại Khoản 3 Điều 12 Thông tư này. Phạm vi và thời gian thu hồi thực hiện theo quy định tại Khoản 3 Điều 63 Luật Dược.
Điều 15. Xử lý thuốc bị thu hồi
2. Thuốc bị thu hồi phải tiêu hủy khi thuộc một trong các trường hợp sau đây:
a) Thuốc bị thu hồi do vi phạm mức độ 1 hoặc mức độ 2;
b) Thuốc bị thu hồi do vi phạm mức độ 3, được Bộ Y tế (Cục Quản lý Dược) xem xét theo quy định tại Khoản 3, Khoản 4 Điều này và kết luận không thể khắc phục, tái xuất được;
c) Thuốc bị thu hồi do vi phạm mức độ 3 được Bộ Y tế (Cục Quản lý Dược) cho phép khắc phục hoặc tái xuất nhưng cơ sở không thực hiện được việc khắc phục, tái xuất.
3. Thủ tục đề nghị khắc phục thuốc bị thu hồi:
a) Cơ sở có thuốc bị thu hồi có văn bản gửi Bộ Y tế (Cục Quản lý Dược) kèm theo quy trình khắc phục, đánh giá nguy cơ đối với chất lượng, độ ổn định của thuốc, chương trình theo dõi, giám sát chất lượng, an toàn, hiệu quả của thuốc trong quá trình lưu hành;
b) Trong thời hạn tối đa 60 ngày, kể từ ngày nhận được văn bản đề nghị khắc phục của cơ sở, Bộ Y tế (Cục Quản lý Dược) phải xem xét, có ý kiến trả lời bằng văn bản đồng ý hoặc không đồng ý việc khắc phục. Trường hợp không đồng ý phải nêu rõ lý do;
c) Trường hợp cần bổ sung hoặc làm rõ thông tin liên quan đến việc khắc phục, trong thời hạn tối đa 60 ngày, kể từ ngày nhận được văn bản của Bộ Y tế (Cục Quản lý Dược), cơ sở phải nộp tài liệu bổ sung, giải trình. Sau thời hạn trên, cơ sở không nộp tài liệu bổ sung, giải trình thì đề nghị khắc phục không còn giá trị.
4. Thủ tục đề nghị tái xuất thuốc bị thu hồi:
a) Cơ sở có thuốc bị thu hồi có văn bản gửi Bộ Y tế (Cục Quản lý Dược) kèm theo phương án tái xuất nêu rõ thời gian và nước tái xuất;
b) Trong thời hạn tối đa 15 ngày, kể từ ngày nhận được văn bản đề nghị của cơ sở, Bộ Y tế (Cục Quản lý Dược) có ý kiến trả lời bằng văn bản đồng ý hoặc không đồng ý tái xuất; trường hợp không đồng ý phải nêu rõ lý do.
5. Việc khắc phục, tái xuất thuốc bị thu hồi chỉ được thực hiện sau khi có ý kiến đồng ý bằng văn bản của Bộ Y tế (Cục Quản lý Dược).
a) Người đứng đầu cơ sở có thuốc bị tiêu hủy ra quyết định thành lập Hội đồng hủy thuốc. Hội đồng có ít nhất là 03 người, trong đó phải có 1 đại diện là người chịu trách nhiệm chuyên môn;
b) Việc hủy thuốc phải bảo đảm an toàn cho người, súc vật và tránh ô nhiễm môi trường theo các quy định của pháp luật về bảo vệ môi trường;
c) Việc hủy thuốc phải kiểm soát đặc biệt phải thực hiện theo quy định tại Điều 48 của Nghị định số 54/2017/NĐ-CP;
d) Cơ sở hủy thuốc phải báo cáo kèm theo biên bản hủy thuốc tới Sở Y tế theo quy định tại Mẫu số 06 Phụ lục III ban hành kèm theo Thông tư này.
7. Thời hạn xử lý thuốc bị thu hồi không quá 12 tháng kể từ thời điểm hoàn thành việc thu hồi theo quy định tại các Điểm a, b và c Khoản 3 Điều 63 của Luật dược.
Điều 16. Trách nhiệm thu hồi thuốc
1. Trách nhiệm của cơ sở kinh doanh dược, cơ sở khám bệnh, chữa bệnh và người sử dụng:
a) Thực hiện quy định tại các Khoản 1, 2 và 3 Điều 64 của Luật dược;
b) Thường xuyên kiểm tra, cập nhật thông tin về thu hồi thuốc trên Cổng thông tin điện tử của Bộ Y tế, Trang thông tin điện tử của Cục Quản lý Dược và Sở y tế.
2. Trách nhiệm của Cục Quản lý Dược:
a) Tiếp nhận thông tin, xác định mức độ vi phạm của thuốc và ban hành quyết định thu hồi thuốc;
b) Thông báo quyết định thu hồi thuốc theo quy định tại Điểm a Khoản 4 Điều 12 Thông tư này, công bố thông tin về thuốc bị thu hồi trên Cổng thông tin điện tử của Bộ Y tế và Trang thông tin điện tử của Cục Quản lý Dược sau khi có quyết định thu hồi thuốc. Phối hợp với Đài truyền hình Việt Nam, Đài tiếng nói Việt Nam công bố thông tin về thu hồi thuốc vi phạm ở mức độ 1;
c) Xem xét báo cáo đánh giá và trả lời về đề xuất tự nguyện thu hồi, đề xuất xử lý khắc phục, tái xuất thuốc bị thu hồi của cơ sở kinh doanh dược;
d) Phối hợp với các đơn vị liên quan (Thanh tra Bộ, Sở Y tế, Y tế các ngành) thanh tra, kiểm tra việc tổ chức và thực hiện thu hồi thuốc; xử lý cơ sở vi phạm theo quy định của pháp luật;
đ) Có văn bản hướng dẫn chi tiết về quy trình xử lý, thu hồi thuốc, đánh giá hiệu quả thực hiện thông báo thu hồi thuốc của các cơ sở sản xuất, kinh doanh dược.
a) Công bố thông tin quyết định thu hồi thuốc trên Trang thông tin điện tử của Sở Y tế;
b) Tổ chức thông báo, phổ biến cho các cơ sở sản xuất, kinh doanh dược, cơ sở khám bệnh, chữa bệnh trên địa bàn về các thông tin thu hồi thuốc;
c) Thực hiện hoặc chỉ đạo trung tâm kiểm nghiệm phối hợp với cơ sở có thuốc vi phạm chất lượng lấy mẫu thuốc bổ sung theo quy định tại Điểm b Khoản 1 hoặc Điểm b Khoản 2 Điều 14 Thông tư này;
d) Tổ chức giám sát việc thu hồi thuốc trên địa bàn; xử lý, xử phạt cơ sở vi phạm các quy định về thu hồi thuốc theo thẩm quyền;
đ) Tham gia hoặc thực hiện đánh giá hiệu quả thu hồi thuốc của các cơ sở kinh doanh dược trên địa bàn theo chỉ đạo của Bộ Y tế (Cục Quản lý Dược). Báo cáo Bộ Y tế (Cục Quản lý Dược) về các trường hợp cơ sở sản xuất, cơ sở nhập khẩu, cơ sở bán buôn là đầu mối phân phối thuốc không thực hiện hoặc thực hiện không đầy đủ việc thu hồi thuốc;
e) Tổ chức, tham gia việc cưỡng chế thu hồi thuốc
1. Thông tư này có hiệu lực thi hành từ ngày 20 tháng 6 năm 2018.
2. Bãi bỏ các văn bản sau đây kể từ ngày Thông tư này có hiệu lực:
a) Thông tư số 09/2010/TT-BYT ngày 28 tháng 4 năm 2010 của Bộ trưởng Bộ Y tế hướng dẫn việc quản lý chất lượng thuốc;
b) Thông tư số 04/2010/TT-BYT ngày 12 tháng 02 năm 2010 của Bộ trưởng Bộ Y tế hướng dẫn việc lấy mẫu thuốc để xác định chất lượng.
1. Cục Quản lý Dược có trách nhiệm:
a) Chủ trì, phối hợp với các đơn vị liên quan tổ chức tuyên truyền, phổ biến, triển khai thực hiện Thông tư này;
Triển khai việc lấy mẫu thuốc để kiểm tra chất lượng và cập nhật vào hệ thống dữ liệu thông tin kiểm tra chất lượng thuốc của Bộ Y tế các thông tin về mẫu thuốc, nguyên liệu làm thuốc được lấy (bao gồm các thông tin: tên thuốc, nguyên liệu làm thuốc, nồng độ, hàm lượng, dạng bào chế, số lô, hạn dùng, số giấy đăng ký lưu hành hoặc giấy phép nhập khẩu, cơ sở sản xuất, cơ sở nhập khẩu, cơ sở lấy mẫu) và kết quả kiểm tra chất lượng đối với mẫu thuốc, nguyên liệu làm thuốc;
c) Cung cấp thông tin về khoa học kỹ thuật liên quan đến bảo đảm chất lượng thuốc, nguyên liệu làm thuốc.
Cung cấp cho Viện Kiểm nghiệm thuốc Trung ương, Viện Kiểm nghiệm thuốc thành phố Hồ Chí Minh mẫu nhãn và bản tiêu chuẩn chất lượng của thuốc, nguyên liệu làm thuốc đã được cấp giấy đăng ký lưu hành hoặc giấy phép nhập khẩu, bản cập nhật trong trường hợp có thay đổi. Đối với vắc xin và sinh phẩm, mẫu nhãn và bản tiêu chuẩn chất lượng được chuyển đến Viện Kiểm định Quốc gia vắc xin và sinh phẩm y tế;
d) Tổ chức kiểm tra chất lượng thuốc, nguyên liệu làm thuốc sản xuất, pha chế, lưu hành và sử dụng trên toàn quốc. Chỉ đạo, giám sát hệ thống kiểm nghiệm thuốc trên toàn quốc. Kết luận về chất lượng thuốc trên cơ sở kết quả kiểm nghiệm thuốc của cơ sở kiểm nghiệm của nhà nước về thuốc và các hồ sơ liên quan;
đ) Chủ trì hoặc phối hợp thực hiện chức năng kiểm tra nhà nước, thanh tra và xử lý vi phạm pháp luật về chất lượng thuốc theo thẩm quyền.
2. Sở Y tế có trách nhiệm:
a) Tổ chức thực hiện việc kiểm tra chất lượng thuốc trên địa bàn và xử lý vi phạm theo quy định của pháp luật;
c) Cập nhật vào hệ thống dữ liệu thông tin kiểm tra chất lượng thuốc của Bộ Y tế các thông tin về mẫu thuốc, nguyên liệu làm thuốc được lấy (bao gồm các thông tin: tên thuốc, nguyên liệu làm thuốc, nồng độ, hàm lượng, dạng bào chế, số lô, hạn dùng, số giấy lưu hành hoặc giấy phép nhập khẩu, cơ sở sản xuất, cơ sở nhập khẩu, cơ sở lấy mẫu) và kết quả kiểm tra chất lượng đối với mẫu thuốc, nguyên liệu làm thuốc.
3. Hệ thống kiểm nghiệm thuốc có trách nhiệm:
- Thực hiện phân tích, kiểm nghiệm mẫu để xác định chất lượng thuốc, nguyên liệu làm thuốc sản xuất, lưu hành, sử dụng; báo cáo kết quả kiểm nghiệm về Bộ Y tế (Cục Quản lý Dược) và Sở Y tế nơi lấy mẫu;
- Nghiên cứu, thiết lập và công bố trên trang thông tin điện tử của các Viện và của Cục Quản lý Dược danh mục các chất chuẩn, chất đối chiếu, tạp chất chuẩn phục vụ cho việc phân tích, kiểm nghiệm mẫu thuốc, nguyên liệu làm thuốc được sản xuất, nhập khẩu, lưu hành, sử dụng trên lãnh thổ Việt Nam;
- Viện Kiểm nghiệm thuốc Trung ương, Viện Kiểm nghiệm thuốc thành phố Hồ Chí Minh chịu trách nhiệm cung cấp cho Trung tâm kiểm nghiệm thuốc tỉnh, thành phố trực thuộc Trung ương, theo địa bàn được phân công, bản sao hoặc văn bản điện tử của tiêu chuẩn chất lượng thuốc, nguyên liệu làm thuốc;
- Viện Kiểm định Quốc gia vắc xin và sinh phẩm y tế, theo định kỳ hàng năm, rà soát, đánh giá xu hướng chất lượng vắc xin, sinh phẩm và trình Bộ Y tế xem xét ban hành Hướng dẫn về kiểm nghiệm xuất xưởng vắc xin, sinh phẩm là huyết thanh chứa kháng thể, dẫn xuất của máu và huyết tương người (bao gồm cả việc xem xét các chỉ tiêu phải thử nghiệm khi kiểm nghiệm để cấp giấy chứng nhận chất lượng đối với từng lô vắc xin, sinh phẩm).
Cập nhật thông tin về việc cấp giấy chứng nhận chất lượng vắc xin, sinh phẩm là huyết thanh chứa kháng thể, dẫn xuất của máu và huyết tương của người trên trang thông tin điện tử của Viện Kiểm định và Cục Quản lý Dược,
b) Trung tâm Kiểm nghiệm tỉnh, thành phố trực thuộc Trung ương:
- Thực hiện phân tích, kiểm nghiệm mẫu để xác định chất lượng thuốc, nguyên liệu làm thuốc sản xuất, lưu hành, sử dụng;
- Báo cáo kết quả kiểm nghiệm về Sở Y tế và Bộ Y tế (Cục Quản lý Dược).
4. Cơ sở kinh doanh có trách nhiệm:
a) Tổ chức nghiên cứu và triển khai thực hiện quy định của pháp luật về chất lượng thuốc, nguyên liệu làm thuốc được ban hành tại Thông tư này;
b) Triển khai các quy định về kiểm tra, kiểm soát nguồn gốc, chất lượng thuốc, nguyên liệu làm thuốc. Thực hiện hoạt động quản lý chất lượng để bảo đảm chất lượng thuốc, nguyên liệu làm thuốc trong suốt quá trình hoạt động của cơ sở;
- Xây dựng kế hoạch lấy mẫu thuốc để kiểm tra, giám sát chất lượng thuốc, nguyên liệu làm thuốc; dự trù và tiếp nhận sử dụng kinh phí hàng năm cho hoạt động lấy mẫu, kiểm nghiệm mẫu thuốc, nguyên liệu làm thuốc;
- Thực hiện việc lấy mẫu thuốc, nguyên liệu làm thuốc theo kế hoạch được phê duyệt tại cơ sở kinh doanh dược, cơ sở sử dụng thuốc;
- Cập nhật thông tin về mẫu thuốc, nguyên liệu làm thuốc được lấy để kiểm tra chất lượng và kết quả kiểm nghiệm đối với mẫu thuốc, nguyên liệu làm thuốc vào hệ thống dữ liệu thông tin kiểm tra chất lượng thuốc của Bộ Y tế;
- Báo cáo kết quả kiểm nghiệm về Bộ Y tế (Cục Quản lý Dược) và Sở y tế nơi lấy mẫu đối với mẫu thuốc, nguyên liệu làm thuốc không đạt tiêu chuẩn chất lượng theo quy định tại Khoản 3 Điều 7 Thông tư này.
- Viện Kiểm nghiệm thuốc Trung ương xây dựng hệ thống dữ liệu thông tin kiểm tra chất lượng thuốc của Bộ Y tế;
b) Trung tâm Kiểm nghiệm tỉnh, thành phố trực thuộc Trung ương:
- Xây dựng kế hoạch lấy mẫu để kiểm tra, giám sát chất lượng thuốc, nguyên liệu làm thuốc; dự trù và tiếp nhận sử dụng kinh phí hàng năm cho hoạt động lấy mẫu, kiểm nghiệm mẫu thuốc, nguyên liệu làm thuốc;
- Thực hiện lấy mẫu thuốc, nguyên liệu làm thuốc để kiểm tra chất lượng theo kế hoạch được phê duyệt tại cơ sở kinh doanh, sử dụng thuốc;
- Cập nhật thông tin về mẫu thuốc, nguyên liệu làm thuốc được lấy để kiểm tra chất lượng và kết quả kiểm nghiệm vào hệ thống dữ liệu thông tin kiểm tra chất lượng thuốc của Bộ Y tế;
- Báo cáo kết quả kiểm nghiệm về Bộ Y tế (Cục Quản lý Dược), Sở Y tế đối với mẫu thuốc, nguyên liệu làm thuốc không đạt tiêu chuẩn chất lượng theo quy định tại Khoản 3 Điều 7 Thông tư này.
Cục trưởng Cục Quản lý Dược, Chánh Văn phòng Bộ, Chánh Thanh tra Bộ, Thủ trưởng các đơn vị thuộc và trực thuộc Bộ Y tế, Sở Y tế các tỉnh, thành phố trực thuộc Trung ương, các cơ sở kinh doanh dược và các cơ quan, tổ chức cá nhân khác có liên quan chịu trách nhiệm thi hành Thông tư này.
Trong quá trình thực hiện nếu có vấn đề vướng mắc, đề nghị các cơ quan, tổ chức, cá nhân phản ánh về Bộ Y tế (Cục Quản lý Dược) để xem xét, giải quyết.
|
|
KT. BỘ TRƯỞNG |
HƯỚNG
DẪN VIỆC LẤY MẪU THUỐC, NGUYÊN LIỆU LÀM THUỐC ĐỂ XÁC ĐỊNH CHẤT LƯỢNG
(Kèm
theo Thông tư số 11/2018/TT-BYT ngày 04 tháng 5 năm 2018 của Bộ trưởng
Bộ Y tế)
I. Trình tự lấy mẫu và các thao tác lấy mẫu
1. Dụng cụ lấy mẫu thuốc, nguyên liệu làm thuốc
Dụng cụ lấy mẫu, đồ đựng mẫu phải được làm bằng vật liệu trơ, sạch thích hợp với đặc điểm của từng loại mẫu, đảm bảo không làm ảnh hưởng đến chất lượng mẫu, không đưa tạp chất vào mẫu gây ô nhiễm, nhiễm chéo đối với mẫu cũng như phải đảm bảo an toàn cho người lấy mẫu (Tham khảo Mục III).
2. Lượng mẫu cần lấy
2.1. Lượng mẫu cần lấy để phân tích và để lưu được tính toán tùy thuộc vào yêu cầu kiểm tra, tiêu chuẩn chất lượng thuốc, nguyên liệu làm thuốc áp dụng, phương pháp thử của mẫu nhưng ít nhất phải đủ cho ba lần phân tích hoặc phải đủ để thực hiện các phép thử đảm bảo thu được kết quả chính xác và tin cậy.
2.2. Thông thường, mỗi lô sản xuất được lấy hai mẫu (một mẫu phân tích và một mẫu lưu tại cơ quan kiểm nghiệm). Trường hợp cần thiết, số mẫu phân tích và mẫu lưu có thể nhiều hơn hai để đủ gửi kiểm nghiệm và lưu ở các cơ quan, tổ chức có liên quan.
3. Thao tác lấy mẫu
3.1. Nguyên tắc lấy mẫu:
- Tùy theo mục đích kiểm tra và theo từng loại sản phẩm, người lấy mẫu quyết định lựa chọn phương pháp lấy mẫu thích hợp.
- Quá trình lấy mẫu phải được giám sát và được ghi chép lại đầy đủ. Tất cả các dấu hiệu không đồng nhất, hư hỏng của thuốc và bao bì bảo quản đều phải được ghi chép lại.
- Quy trình lấy mẫu phải đảm bảo sao cho có thể kịp thời phát hiện tính không đồng nhất của thuốc trong từng đơn vị lấy mẫu và của cả lô thuốc. Các dấu hiệu không đồng nhất bao gồm sự khác nhau về hình dạng, kích thước, hoặc màu sắc của các tiểu phân chất rắn ở dạng kết tinh, dạng hạt hoặc dạng bột; lớp vỏ ẩm của các chất hút có tính hút ẩm; sự lắng đọng các dược chất ở dạng rắn trong thuốc dạng chất lỏng hoặc bán rắn; sự tách lớp của thuốc dạng chất lỏng.
- Không trộn lẫn, phối hợp các mẫu được lấy từ các phần có dấu hiệu khác nhau, từ các bao bì có nghi ngờ chất lượng của lô thuốc, vì sự trộn lẫn này làm che khuất các dấu hiệu tạp nhiễm, hàm lượng thấp hoặc các vấn đề chất lượng khác. Phải tạo thành mẫu riêng biệt từ các phần, các bao bì này.
- Đối với thành phẩm thuốc, quy trình lấy mẫu cần tính đến các phép thử chính thức và phép thử bổ sung đối với từng dạng thuốc (ví dụ: thuốc viên nén, hoặc thuốc tiêm truyền...). Các phép thử bổ sung bao gồm các phép thử để xác định thuốc giả mạo, thuốc bị pha trộn, thuốc thêm các chất không được phép.
- Không nên trộn lại thuốc đã lấy ra khỏi bao bì trực tiếp với thuốc còn trong bao bì.
3.2. Trình tự lấy mẫu
- Kiểm tra tình trạng vật lý của lô hàng: phân tách theo từng loại sản phẩm và từng lô sản xuất, mỗi lô lại tách riêng các thùng hàng có dấu hiệu bị hư hại, không đảm bảo vệ sinh để kiểm tra, lấy mẫu riêng. Loại bỏ các đơn vị bao gói không có nhãn.
- Từ lô sản phẩm lấy ra các đơn vị lấy mẫu, mở các bao gói để lấy các mẫu ban đầu và làm kín ngay lại các bao gói đã được lấy mẫu. Số lượng nguyên liệu trong mẫu ban đầu được tính toán đủ để chuẩn bị mẫu tiếp sau.
- Trộn đều các mẫu ban đầu thành những mẫu riêng của từng đơn vị lấy mẫu.
- Trộn đều các mẫu riêng thành một mẫu chung.
- Tạo mẫu cuối cùng: Từ mẫu chung lấy ra các phần bằng nhau tạo thành mẫu cuối cùng gồm mẫu phân tích và mẫu lưu.
3.3. Các mẫu phân tích và mẫu lưu phải được cho vào đồ đựng, hàn kín và dán nhãn. Nhãn của đồ đựng mẫu phải ghi rõ tên thuốc, tên nhà sản xuất, ký hiệu lô sản xuất, hạn dùng, số thùng đã lấy mẫu, nơi lấy mẫu, số lượng mẫu đã lấy (nếu mẫu lấy là nguyên liệu thuốc gây nghiện, hướng thần, tiền chất dùng làm thuốc và nguyên liệu thuốc phóng xạ số lượng cần phải ghi bằng chữ), ngày lấy mẫu, các điều kiện bảo quản phù hợp với biên bản lấy mẫu.
3.4. Sau khi lấy mẫu xong, các thành viên tham gia lấy mẫu phải niêm phong riêng biệt mẫu phân tích và mẫu lưu để đảm bảo mẫu được an toàn trong quá trình vận chuyển từ nơi lấy mẫu đến nơi giao mẫu. Trên niêm phong của mẫu phải ghi rõ ngày tháng lấy mẫu và có ít nhất chữ ký của người lấy mẫu và đại diện cơ sở được lấy mẫu.
Trong trường hợp cần thiết, phần còn lại sau khi lấy mẫu cũng phải niêm phong để đề phòng sự tráo mẫu thuốc, nguyên liệu làm thuốc.
3.5. Lập biên bản lấy mẫu: biên bản lấy mẫu phải ghi rõ số lô, ngày lấy mẫu, địa điểm lấy mẫu, các điều kiện bảo quản, ghi chép về bất cứ nhận xét nào khác liên quan và những bất thường của quá trình lấy mẫu, có ít nhất tên và chữ ký của người lấy mẫu và đại diện cơ sở được lấy mẫu.
Trong trường hợp đoàn kiểm tra chất lượng tiến hành lấy mẫu thì phải có thêm chữ ký của Trường đoàn kiểm tra.
Trong trường hợp đại diện cơ sở được lấy mẫu không ký biên bản, thì biên bản có chữ ký của người lấy mẫu và người chứng kiến.
Biên bản phải làm thành ít nhất ba bản: một bản lưu tại cơ sở được lấy mẫu, một bản lưu ở cơ quan kiểm nghiệm, một bản lưu tại cơ quan quản lý, kiểm tra chất lượng thuốc.
4. Lấy mẫu nguyên liệu làm thuốc
4.1. Trường hợp nguyên liệu chỉ có một bao gói:
a) Lấy mẫu nguyên liệu dạng rắn: Lấy mẫu ban đầu ở các vị trí khác nhau của thùng hàng (phía trên, giữa và đáy). Nếu các mẫu ban đầu không có các dấu hiệu cảm quan khác nhau thì trộn đều các mẫu ban đầu thành mẫu riêng.
b) Lấy mẫu nguyên liệu dạng lỏng hoặc bán rắn: Nấu không đồng đều thì phải trộn đều trước khi lấy mẫu. Ví dụ nếu chế phẩm lỏng phân lớp phải khuấy đều trước khi lấy mẫu, hoặc nếu có cặn lắng trong chất lỏng phải làm tan cặn lắng hoặc phân tán đều trước khi lấy mẫu bằng cách có thể làm ấm hoặc khuấy trộn đều.
4.2. Trường hợp lô nguyên liệu có nhiều bao gói:
Tùy theo mục đích của lấy mẫu kiểm tra, mức độ đồng nhất và chất lượng của lô thuốc mà chọn phương án lấy mẫu thích hợp theo quy định tại Mục I, Khoản 9 của Phụ lục này.
5. Lấy mẫu bán thành phẩm chưa đóng gói
Các sản phẩm loại này là thuốc bột, thuốc nước, siro thuốc, thuốc mỡ, thuốc cốm, thuốc viên, thuốc tiêm... chứa trong các bao gói lớn để chuyển đến cơ sở đóng gói lẻ. Mỗi lô sản xuất được lấy mẫu theo cách sau:
1. Nếu lô sản phẩm chỉ có 1 - 2 bao gói, thì mở cả hai bao gói. Nếu lô sản phẩm có từ 3 bao gói trở lên thì mở ba bao gói. Lấy ít nhất 3 mẫu ban đầu ở các vị trí khác nhau của mỗi bao gói.
2. Trộn các mẫu ban đầu lại thành mẫu chung rồi tạo mẫu cuối cùng gồm mẫu phân tích và mẫu lưu.
6. Lấy mẫu vật liệu bao gói
Lấy mẫu vật liệu bao gói thực hiện theo quy định tại Mục I, Khoản 9 của Phụ lục này.
7. Lấy mẫu thuốc thành phẩm
7.1. Lấy mẫu thuốc thành phẩm để kiểm tra hoặc giám sát chất lượng:
a) Việc lấy mẫu theo nguyên tắc lấy mẫu ngẫu nhiên và phải lấy mẫu ở những vị trí khác nhau của lô hàng.
b) Căn cứ tiêu chuẩn chất lượng thuốc, số lượng thuốc được lấy sao cho đủ để thử nghiệm và lưu mẫu. Trường hợp không có đủ thông tin để tính toán chính xác số lượng thuốc cần lấy, tham khảo số lượng thuốc thành phẩm tối thiểu cần lấy theo quy định tại Mục V của Phụ lục này.
c) Trình tự lấy mẫu được thực hiện trên cơ sở hướng dẫn tại Mục II của Phụ lục này.
7.2. Lấy mẫu để kiểm tra cảm quan khi nhập thuốc: số lượng mẫu lấy để kiểm tra cảm quan theo quy định tại Mục IV của Phụ lục này.
Dược liệu hoặc dược liệu đã được chế biến một phần, kể cả động vật, thực vật (cây thuốc đã làm khô và các phần của cây) và khoáng chất, được coi như nguyên liệu không đồng đều, lấy mẫu theo quy định tại Mục I, Khoản 9, sơ đồ r của Phụ lục này.
9. Sơ đồ lấy mẫu nguyên liệu ban đầu và vật liệu bao gói
9.1. Trước khi thực hiện việc lấy mẫu, người lấy mẫu phải kiểm tra tính nguyên vẹn, mức độ hư hỏng của thùng đựng, sự đồng đều của sản phẩm bên trong của mỗi đơn vị lấy mẫu.
9.2. Việc lấy mẫu có thể được thực hiện theo một trong ba sơ đồ lấy mẫu ghi tại Bảng 1 dưới đây.
Bảng 1: Các giá trị n, p hoặc r cho N đơn vị bao gói
|
Giá trị n, p, r |
Giá trị N |
||
|
Sơ đồ n |
Sơ đồ p |
Sơ đồ r |
|
|
2 |
Tới 3 |
Tới 25 |
Tới 2 |
|
3 |
4 - 6 |
25 - 56 |
3 - 4 |
|
4 |
7 - 13 |
57 - 100 |
5 - 7 |
|
5 |
14 - 20 |
101 - 156 |
8 - 11 |
|
6 |
21 - 30 |
157 - 225 |
12 - 16 |
|
7 |
31 - 42 |
|
17 - 22 |
|
8 |
43 - 56 |
|
23 - 28 |
|
9 |
57 - 72 |
|
29 - 36 |
|
10 |
73 - 90 |
|
37 - 44 |
a) Sơ đồ n
Sử dụng “Sơ đồ n” trong trường hợp lô
nguyên liệu cần lấy mẫu được coi là đồng nhất và được cung cấp từ một nguồn xác
định. Có thể lấy mẫu từ bất kỳ phần nào trong thùng nguyên liệu (thường từ lớp trên
cùng). “Sơ đồ n” dựa trên
công thức n = 1 +![]() , với N là số đơn vị bao
gói của lô hàng, số đơn vị lấy mẫu tối thiểu n có được bằng cách làm
tròn đơn giản. Từ n đơn vị lấy mẫu được chọn ngẫu nhiên, lấy ra các mẫu ban đầu, đựng
trong các đồ đựng mẫu riêng biệt. Nếu các mẫu ban đầu lấy được không có nghi ngờ
gì về cảm quan và định tính, các mẫu ban đầu được trộn đều thành mẫu riêng, mẫu
chung để chia thành mẫu phân tích và mẫu lưu theo trình tự chung.
, với N là số đơn vị bao
gói của lô hàng, số đơn vị lấy mẫu tối thiểu n có được bằng cách làm
tròn đơn giản. Từ n đơn vị lấy mẫu được chọn ngẫu nhiên, lấy ra các mẫu ban đầu, đựng
trong các đồ đựng mẫu riêng biệt. Nếu các mẫu ban đầu lấy được không có nghi ngờ
gì về cảm quan và định tính, các mẫu ban đầu được trộn đều thành mẫu riêng, mẫu
chung để chia thành mẫu phân tích và mẫu lưu theo trình tự chung.
b) Sơ đồ p
Sử dụng “sơ đồ p” trong trường hợp lô
nguyên liệu được xem là đồng nhất, từ một nguồn xác định và mục đích chính là để
kiểm tra định tính. “Sơ đồ p” dựa vào công thức p = 0,4![]() ,
với N là số đơn vị bao gói của lô hàng. Giá trị p có được bằng cách làm tròn
lên đến số nguyên lớn nhất tiếp theo. Các mẫu ban đầu được lấy từ mỗi trong số
N đơn vị bao gói của lô hàng và được đựng trong các đồ đựng mẫu riêng biệt. Các
mẫu ban đầu này được kiểm tra về cảm quan, định tính. Nếu kết quả phù
hợp, p mẫu chung dược tạo thành bằng cách trộn lẫn thích hợp các mẫu ban đầu để
lưu hoặc phân tích (nếu cần thiết).
,
với N là số đơn vị bao gói của lô hàng. Giá trị p có được bằng cách làm tròn
lên đến số nguyên lớn nhất tiếp theo. Các mẫu ban đầu được lấy từ mỗi trong số
N đơn vị bao gói của lô hàng và được đựng trong các đồ đựng mẫu riêng biệt. Các
mẫu ban đầu này được kiểm tra về cảm quan, định tính. Nếu kết quả phù
hợp, p mẫu chung dược tạo thành bằng cách trộn lẫn thích hợp các mẫu ban đầu để
lưu hoặc phân tích (nếu cần thiết).
c) Sơ đồ r
Sử dụng “sơ đồ r” khi lô nguyên liệu bị
nghi ngờ là không đồng nhất và/hoặc tiếp nhận từ nguồn không xác định, dược liệu
hay các nguyên liệu ban đầu là dược liệu
đã được chế biến một phần. Sơ đồ này dựa trên công thức r = 1,5![]() , với N là số đơn vị bao
gói của lô sản phẩm. Giá trị r thu được bằng cách làm tròn tới số nguyên lớn
nhất tiếp theo.
, với N là số đơn vị bao
gói của lô sản phẩm. Giá trị r thu được bằng cách làm tròn tới số nguyên lớn
nhất tiếp theo.
Các mẫu ban đầu được lấy từ mỗi trong số N đơn vị bao gói và được đựng trong các đồ đựng mẫu riêng biệt. Các mẫu ban đầu này được kiểm tra cảm quan và định tính. Nếu kết quả phù hợp, lựa chọn ngẫu nhiên r mẫu để thực hiện kiểm nghiệm riêng rẽ. Nếu kết quả kiểm nghiệm đồng nhất, các mẫu lưu có thể được gộp lại thành 01 mẫu lưu.
9.3. Lấy mẫu nguyên liệu ban đầu để định tính đối với các cơ sở sản xuất không áp dụng các sơ đồ trên mà theo nguyên tắc “Thực hành tốt sản xuất thuốc” theo khuyến cáo của Tổ chức Y tế thế giới (GMP-WHO).
II. Các bước thực hiện lấy mẫu
1. Các chế phẩm lỏng chờ đóng gói
Các bước cần được xem xét khi lấy mẫu các chế phẩm lỏng chờ đóng gói như sau:
- Đọc và hiểu các khuyến cáo thận trọng để đảm bảo an toàn khi cấp phát nguyên liệu.
- Tập trung các thiết bị lấy mẫu cần thiết (ống lấy mẫu hay bình lấy mẫu có thể cân được weighted sampling, các bình đựng mẫu lấy và nhãn) và kiểm tra để đảm bảo tất cả những dụng cụ cần thiết đều sạch.
- Xác định vị trí của lô.
- Kiểm tra các đồ đựng xem có dấu hiệu ô nhiễm lô hay không. Ghi lại bất cứ điểm nghi ngờ nào.
- Kiểm tra các nhãn để phát hiện những khác biệt rõ ràng và những dấu hiệu thay đổi, kể cả tẩy xóa và ghi nhãn nhầm. Ghi lại bất cứ điểm nghi ngờ nào.
- Tìm hiểu và làm rõ các nguồn gốc gây sai sót vì bất kỳ lý do gì trước khi tiến hành.
- Chọn ống lấy mẫu chế phẩm lỏng có cỡ và miệng phù hợp với độ nhớt của chế phẩm lỏng cần lấy mẫu.
- Lấy mẫu chế phẩm lỏng, hỗn dịch hay nhũ tương (đã được khuấy đều, nếu thích hợp) bằng cách ấn từ từ ống lấy mẫu để mở vào chế phẩm lỏng theo phương thẳng đứng sao cho lấy được sản phẩm từ mỗi lớp.
- Đóng chặt ống mẫu, rút ống mẫu ra khỏi chế phẩm lỏng và để cho chế phẩm dính bên ngoài ống được róc hết. Chuyển toàn bộ mẫu đã lấy trong ống sang một bình đựng mẫu sạch và có dán nhãn.
- Lặp lại các bước trên cho đến khi lấy đủ mẫu để phân tích và để lưu.
- Niêm phong bình đựng mẫu.
- Niêm phong lại thùng sản phẩm vừa lấy mẫu và dán nhãn “đã lấy mẫu”.
- Làm sạch và khô ống lấy mẫu, lưu ý những thận trọng về an toàn.
- Tiếp tục lấy mẫu ở những thùng sản phẩm khác theo cách tương tự các bước ở trên.
- Làm sạch ống lấy mẫu bằng quy trình làm sạch đã quy định.
- Chuyển các mẫu phân tích tới phòng kiểm nghiệm và các mẫu lưu đến kho lưu mẫu. Báo cáo lại bất cứ điểm nghi ngờ nào liên quan tới việc lấy mẫu mà người phân tích và thanh tra viên cần lưu ý.
- Kiểm tra giấy chứng nhận phân tích của nhà cung cấp so với các tiêu chuẩn, nếu có.
2. Nguyên liệu ban đầu dạng bột
Các bước cần thực hiện khi lấy mẫu nguyên liệu ban đầu dạng bột như sau:
- Đọc và hiểu các lưu ý thận trọng cần thực hiện để đảm bảo an toàn khi xử lý nguyên liệu.
- Tập hợp các thiết bị lấy mẫu (xiên lấy mẫu, bình đựng mẫu lấy và nhãn) và kiểm tra xem tất cả có sạch hay không.
- Xác định đợt hàng và đếm số thùng
- Kiểm tra tất cả các thùng xem có gì khác và có dấu hiệu bị hư hỏng không. Ghi lại bất cứ điểm nghi ngờ nào.
- Kiểm tra tất cả các nhãn xem có khác hay có dấu hiệu thay đổi nào không, kể cả tẩy xóa và ghi nhầm nhãn. Ghi lại bất cứ điểm nghi ngờ nào.
- Tách các thùng bị hư hỏng và những thùng mà sản phẩm bên trong nghi bị hỏng để kiểm tra riêng. Sau đó những thùng này phải được đề cập hay bị từ chối.
- Tách riêng các thùng có số lô khác và xử lý riêng.
- Đánh số những thùng còn lại.
- Chọn sơ đồ lấy mẫu thích hợp (n, p hoặc r).
- Chọn những thùng cần lấy mẫu theo yêu cầu của sơ đồ đã được chọn (dùng bảng số ngẫu nhiên, vẽ sơ đồ lô hay dùng đánh số ngẫu nhiên).
- Mỗi lần mở một thùng và kiểm tra sản phẩm bên trong. Ghi lại nếu có khác biệt.
- Chọn xiên lấy mẫu thích hợp và sạch, xiên (với cửa lấy mẫu đóng kín) vào bột thuốc sao cho đầu xiên chạm đáy thùng.
- Mở cửa để lấy bột thuốc vào các khoang xiên, sau đó đóng lại
- Rút xiên ra khỏi thùng đựng mẫu và chuyển xiên đã chứa bột thuốc được lấy sang một bình đựng mẫu đã dán nhãn
- Lặp lại các bước trên cho đến khi lấy đủ vật liệu để phân tích và lưu.
- Niêm phong bình đựng mẫu lấy.
- Niêm phong lại thùng sản phẩm vừa lấy mẫu và dán nhãn có ghi “đã lấy mẫu”.
- Lau sạch xiên lấy mẫu nếu cần, chú ý những thận trọng về an toàn, trước khi lấy mẫu các thùng khác.
- Lặp lại các bước như trên với mỗi thùng đã chọn.
- Lau sạch xiên lấy mẫu dùng quy trình làm sạch đã quy định.
- Chuyển các mẫu phân tích tới phòng kiểm nghiệm và các mẫu lưu đến kho lưu mẫu. Báo cáo lại bất cứ nghi ngờ nào liên quan tới lấy mẫu mà người phân tích và thanh tra viên cần lưu ý.
- Kiểm tra giấy chứng nhận phân tích của nhà cung cấp so với các tiêu chuẩn, nếu có.
3. Nguyên liệu bao gói
Các bước cần xem xét thực hiện khi lấy mẫu nguyên liệu đóng gói như sau:
- Kiểm tra đợt hàng so với hồ sơ liên quan.
- Kiểm tra các thùng trung chuyển theo các chi tiết sau và báo cáo bất cứ sự chênh lệch nào nếu cần:
+ Xác định các thông tin đúng;
+ Niêm phong còn nguyên vẹn, nếu có niêm phong;
+ Không bị hư hỏng.
- Lấy mẫu cần thiết từ số thùng nguyên liệu theo yêu cầu, đặc biệt lưu ý đến những quy định về lấy mẫu nguyên liệu đóng gói ở Mục I, Khoản 9 của Phụ lục này.
- Đưa mẫu đã lấy vào các đồ đựng mẫu thích hợp.
- Đánh dấu các thùng nguyên liệu đã được lấy mẫu.
- Lưu ý bất kỳ tình huống đặc biệt nào xảy ra trong quá trình lấy mẫu (ví dụ: hàng kém chất lượng hay các thành phần bị hư hại). Báo cáo những bất thường quan sát được.
- Chuyển tất cả các pa-lét hay thùng nguyên liệu đã lấy mẫu khỏi khu vực lấy mẫu cùng với toàn bộ hồ sơ.
- Kiểm tra giấy chứng nhận phân tích của nhà cung cấp so với các tiêu chuẩn, nếu có.
4. Thuốc thành phẩm
Khi lấy mẫu thành phẩm cần cân nhắc các bước sau:
- Xác định số pa-lét cho mỗi lô trong đợt hàng.
- Tính toán số pa-lét dựa theo số đơn vị lấy mẫu để kiểm tra mẫu bằng cảm quan quy định:
+ Kiểm tra điều kiện của pa-lét và bao bì về tính toàn vẹn của nguyên liệu đóng gói bên ngoài.
+ Kiểm tra phía ngoài của hàng hóa trên các pa-lét xem có sạch không.
+ Kiểm tra xem ghi nhãn trên các pa-lét có phù hợp với danh mục hàng hóa đóng gói không.
+ Đếm, phân loại và ghi chép các sai sót.
- Tính tổng số gói (hộp) đựng hàng vận chuyển trên số pa-lét hiện có và xác minh tổng số căn cứ vào danh mục đóng gói hàng.
- Kiểm tra các gói (hộp) hàng vận chuyển (đơn vị đóng gói trung gian) từ số pa-lét đã chọn:
+ Kiểm tra xem nguyên liệu đóng gói của các hộp đựng hàng có còn nguyên vẹn không.
+ Kiểm tra xem các hộp có sạch không.
+ Kiểm tra xem nhãn trên các hộp có bị hư hỏng không.
+ Kiểm tra các hộp xem có hư hỏng gì không.
+ Kiểm tra các nhãn xem có lỗi chính tả không.
+ Kiểm tra ngày sản xuất và hạn dùng trên các nhãn.
+ Đếm, phân loại và ghi chép các sai sót.
- Kiểm tra bằng cảm quan các đơn vị đóng gói cuối cùng từ các đơn vị đóng gói trung gian:
+ Kiểm tra xem vật liệu đóng gói của các đơn vị đóng gói cuối cùng có còn nguyên vẹn không.
+ Kiểm tra xem các gói hàng có sạch không.
+ Kiểm tra hình dạng và màu sắc của các gói hàng.
+ Kiểm tra xem nhãn trên các gói hàng có bị hư hỏng không.
+ Kiểm tra các gói xem có hư hỏng gì không.
+ Kiểm tra các nhãn xem có lỗi chính tả không.
+ Kiểm tra ngày sản xuất và hạn dùng trên các nhãn.
+ Đếm, phân loại và ghi chép số lỗi.
- Từ số gói hàng được chọn, dựa theo tiêu chuẩn chất lượng, bằng phương pháp lấy mẫu ngẫu nhiên, tính số gói hàng cần kiểm tra lý học, hóa học và số lượng cần cho mẫu lưu.
- Kiểm tra giấy xác nhận phân tích của nhà cung cấp so với các tiêu chuẩn, nếu có.
III. Các loại dụng cụ lấy mẫu

Hình 1. Các loại xẻng lấy mẫu chế phẩm rắn

Hình 2. Tuýp lấy mẫu chế phẩm lỏng và chế phẩm bôi ngoài da
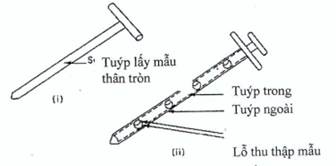
Hình 3. Lấy mẫu từ các đồ đựng nguyên liệu rắn sâu lòng
(i) Tuýp lấy mẫu thân tròn (Hình 3.i): gồm một ống rỗng với một thanh bên trong có một đầu nhọn để chọc được vào bột ở một vị trí kín. Đầu của thanh bên trong thường nhọn để ít ảnh hưởng tới lớp bột. Một số loại có khóa cho phép ước lượng mẫu lấy ở mức cần thiết, nên sẽ giảm được chênh lệch về khối lượng giữa các mẫu lấy.
(ii) Tuýp lấy mẫu kép: (Hình 3.ii): gồm hai ống đồng tâm, ống bên trong làm bằng vật liệu cứng trừ các khoang đựng mà mẫu được lấy vào đó, ống bên ngoài rỗng có lỗ hổng có thể khớp với các khoang đựng mẫu ở ống bên trong, đầu nhọn để giảm thiểu tình trạng làm vỡ đối với lớp bột.
Chú ý: Khi đưa dụng cụ này vào một hỗn hợp bột tĩnh sẽ làm xáo trộn hỗn hợp bột, làm di chuyển bột thuốc từ các lớp trên xuống các lớp dưới. Mức độ xáo trộn tùy thuộc vào động tác đưa dụng cụ theo kiểu đưa từ từ hay giật cục hay xoáy. Do đó cán bộ phải được đào tạo sử dụng kỹ thuật thích hợp.
Góc đưa dụng cụ vào khối bột thuốc cũng có thể ảnh hưởng tới mẫu lấy được. Nếu đưa dụng cụ lấy mẫu vào khối bột thuốc theo phương thẳng đứng thì có thể lấy được mẫu với kích thước tiểu phân khác so với những mẫu lấy được khi dùng cùng dụng cụ đó nhưng được đưa vào khối bột theo một góc nhọn. Ngoài ra, mẫu lấy được cũng bị ảnh hưởng bởi vị trí của buồng đựng mẫu của dụng cụ lấy mẫu so với khối bột thuốc (tức là buồng đựng mẫu ở vị trí đỉnh, đáy hoặc ở giữa của dụng cụ lấy mẫu).
Mẫu lấy được cũng bị ảnh hưởng bởi độ dày (độ sâu) của bao bì đựng thuốc, do bột nguyên liệu thuốc bị đẩy vào các buồng đựng mẫu bởi lực nén tĩnh của khối bột thuốc. Lực nén ở dưới đáy của thùng lớn lớn hơn nhiều so với lực nén ở lớp giữa hay ở trên cùng. Do vậy, với cùng một dụng cụ lấy mẫu, có khả năng lấy được các phần của mẫu có kích thước tiểu phân bột thuốc khác nhau ở lớp trên và lớp đáy của khối bột thuốc tĩnh.
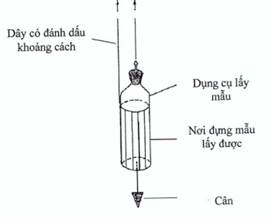
Hình 4. Dụng cụ lấy mẫu có thể cân được (weighted container)
Lấy mẫu từ các bể chứa và thùng chứa lớn thì dùng loại dụng cụ lấy mẫu có thể cân được. Đồ đựng này được thiết kế sao cho có thể mở ra ở một độ sâu cần thiết. Các điểm đánh dấu trên dây được dùng để xác định khi nào thì dụng cụ đựng tới độ sâu phù hợp.
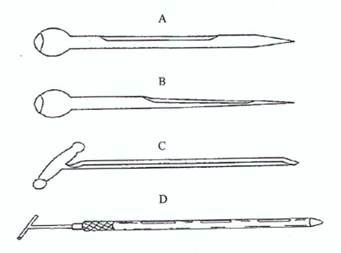
Hình 5. Các loại xiên lấy mẫu đơn giản
A: Xiên lấy mẫu đóng, được sử dụng lấy mẫu có kích thước hạt lớn như sắn
B: Xiên lấy mẫu đóng, được sử dụng lấy mẫu có kích thước hạt nhỏ
C: Xiên lấy mẫu mở
D: Xiên lấy mẫu hai tuýp
Các loại xiên để lấy mẫu từ các túi sản phẩm, để dễ dàng đưa dụng cụ lấy mẫu vào túi sản phẩm xiên lấy mẫu thường có hình vót thon, đường kính ngoài khoảng 12 mm, nhưng có thể tới 25 mm, dài khoảng 40 - 45 cm.
IV. Số đơn vị bao gói thương phẩm của thuốc thành phẩm cần lấy để kiểm tra bằng cảm quan (ISO 2859-1)
|
Cỡ lô |
Số đơn vị bao gói thương phẩm cần lấy cho một mẫu kiểm tra |
|
Từ 2 đến 8 |
2 |
|
9 - 15 |
3 |
|
16 - 25 |
5 |
|
26 - 50 |
8 |
|
51 – 90 |
13 |
|
91 - 150 |
20 |
|
151 - 280 |
32 |
|
281 - 500 |
50 |
|
501 - 1200 |
80 |
|
1201 - 3200 |
125 |
|
3201 - 10000 |
200 |
|
10001 - 35000 |
315 |
|
35001 - 150000 |
500 |
|
150001 - 500000 |
600 |
|
500001 trở lên |
1250 |
V. Cơ số mẫu lấy để kiểm tra chất lượng
Số mẫu thuốc, nguyên liệu làm thuốc được lấy để kiểm tra chất lượng (chưa bao gồm mẫu để lưu) được quy định như sau:
|
STT |
Dạng bào chế |
Chủng loại, quy cách |
Số lượng |
|
1 |
Thuốc viên nén, viên nang, viên bao |
1 hoạt chất |
80 viên |
|
≥ 2 hoạt chất |
120 viên |
||
|
2 |
Thuốc nước |
≥ 100 ml |
20 chai (lọ) |
|
10 - 100 ml |
30 chai (lọ) |
||
|
5ml - 10ml |
50 chai (lọ) |
||
|
< 5ml |
100 chai (lọ) |
||
|
3 |
Cốm, bột |
Đóng gói theo đơn vị đơn liều hoặc đa liều |
~ 100 gam |
|
Hoàn cứng, hoàn mềm |
> 0,5 g/viên |
120 viên |
|
|
0,1 - 0,5 g/viên |
200 viên |
||
|
< 0,1 g/viên |
500 viên |
||
|
4 |
Rượu thuốc |
≤ 650 ml |
7 chai |
|
> 650 ml |
5 chai |
||
|
5 |
Dịch truyền |
≥ 250 ml |
20 chai |
|
100 ml - 250 ml |
25 chai |
||
|
< 100 ml |
50 chai |
||
|
Ống tiêm |
1ml |
150 ống |
|
|
≥ 2 ml |
120 ống |
||
|
Nước cất tiêm |
2 ml |
250 ống |
|
|
5 ml |
100 ống |
||
|
10 ml |
80 ống |
||
|
6 |
Thuốc nhỏ mắt |
≤ 2ml/100mg |
100 lọ (tuýp) |
|
> 2ml/100mg |
80 lọ (tuýp) |
||
|
7 |
Thuốc mỡ, kem, gel dùng ngoài |
≤ 100mg |
30 lọ (tuýp) |
|
> 100mg |
40 lọ (tuýp) |
||
|
8 |
Thuốc bột tiêm |
< 100 mg |
150 lọ |
|
100 - 450 mg |
120 lọ |
||
|
> 450 mg |
100 lọ |
||
|
9 |
Dầu xoa |
1 - 2 ml |
30 lọ |
|
≥ 5 ml |
20 lọ |
||
|
10 |
Cao thuốc |
Các loại |
~100g |
|
11 |
Dược liệu |
Chứa tinh dầu |
250 g |
|
Không chứa tinh dầu |
100 g |
||
|
12 |
Tinh dầu |
Các loại |
150 ml |
|
13 |
Vắc xin, sinh phẩm |
Các loại |
Theo quy định của nhà sản xuất |
|
14 |
Nguyên liệu |
Nguyên liệu quý |
20 g |
|
Nguyên liệu kháng sinh |
50 g |
||
|
Nguyên liệu thuốc gây nghiện, hướng thần, tiền chất |
10 g |
||
|
Nguyên liệu thường |
100 g |
||
|
Nhựa hạt |
200 g |
||
|
15 |
Dây truyền dịch |
Các loại |
30 bộ |
|
16 |
Ống thủy tinh rỗng |
2 ml |
500 ống |
|
≥ 5 ml |
300 ống |
||
|
17 |
Chai đựng dịch truyền |
Các loại |
10 chai |
XÁC
ĐỊNH MỨC ĐỘ VI PHẠM VÀ KẾT LUẬN CÁC TRƯỜNG HỢP THUỐC PHẢI THU HỒI
(Kèm
theo Thông tư số 11/2018/TT-BYT ngày 04
tháng 5 năm 2018 của Bộ trưởng Bộ Y tế)
I. Thuốc vi phạm mức độ 1: là thuốc vi phạm có nguy cơ gây tổn hại nghiêm trọng đối với sức khỏe hoặc ảnh hưởng đến tính mạng của người sử dụng, thuộc một trong các trường hợp sau đây:
1. Thuốc giả, thuốc nhập lậu, thuốc không rõ nguồn gốc, xuất xứ;
2. Thuốc có chứa các chất bị cấm sử dụng trong sản xuất thuốc;
3. Thuốc thành phẩm được sản xuất từ nguyên liệu không phải mục đích dùng cho người hoặc nguyên liệu chưa có giấy phép sử dụng trong sản xuất thuốc hoặc thực phẩm dùng cho người;
4. Thuốc được sản xuất tại cơ sở chưa có giấy chứng nhận đủ điều kiện kinh doanh;
6. Thuốc có thông báo thu hồi khẩn cấp của cơ quan nhà nước có thẩm quyền nước ngoài;
7. Thuốc có kết luận không bảo đảm yêu cầu về an toàn của cơ quan nhà nước có thẩm quyền;
8. Thuốc nhầm lẫn hoạt chất;
9. Thuốc nhầm lẫn hàm lượng có thể gây hậu quả nghiêm trọng;
10. Thuốc tiêm truyền không đạt chỉ tiêu vô trùng hoặc không đạt chỉ tiêu chất gây sốt hoặc chỉ tiêu nội độc tố;
11. Thuốc tiêm không vô trùng;
12. Thuốc ghi nhãn không đúng về hàm lượng, đường dùng, liều dùng đối với thuốc có chứa hoạt chất có hoạt tính mạnh, giới hạn an toàn nhỏ.
II. Thuốc vi phạm mức độ 2: là thuốc có bằng chứng không bảo đảm đầy đủ hiệu quả điều trị hoặc có nguy cơ không an toàn cho người sử dụng nhưng chưa đến mức gây tổn hại nghiêm trọng đối với sức khỏe hoặc chưa ảnh hưởng đến tính mạng của người sử dụng, thuộc một trong các trường hợp sau đây:
1. Thuốc có kết luận không bảo đảm yêu cầu về hiệu quả điều trị của cơ quan nhà nước có thẩm quyền;
2. Thuốc được sản xuất từ nguyên liệu không đạt tiêu chuẩn chất lượng;
4. Thuốc không có giấy đăng ký lưu hành hoặc chưa được phép nhập khẩu;
5. Thuốc có giấy đăng ký lưu hành được cấp dựa trên hồ sơ giả mạo theo kết luận của cơ quan có thẩm quyền;
6. Thuốc thành phẩm được sản xuất từ nguyên liệu làm thuốc đã hết hạn dùng hoặc nguyên liệu đã có thông báo thu hồi của cơ quan nhà nước có thẩm quyền hoặc nguyên liệu không có nguồn gốc hợp pháp (nhập lậu, cơ sở sản xuất nguyên liệu chưa có giấy chứng nhận đủ điều kiện kinh doanh dược);
7. Thuốc được sản xuất tại cơ sở sản xuất trong thời gian đình chỉ hoạt động hoặc trong thời gian bị tước quyền sử dụng giấy chứng nhận đủ điều kiện kinh doanh dược;
8. Thuốc có hàm lượng nằm ngoài mức giới hạn 5% so với giới hạn quy định tại hồ sơ đăng ký;
9. Thuốc có nhầm lẫn hoạt chất (trừ trường hợp được đánh giá vi phạm ở mức độ 1);
11. Thuốc tiêm, thuốc tiêm truyền không đạt tiêu chuẩn chất lượng về độ trong, tạp chất, tiểu phân nhìn thấy hoặc tiểu phân không nhìn thấy bằng mắt thường;
12. Thuốc viên không đạt tiêu chuẩn chất lượng về độ tan rã mà thời gian tan rã trong môi trường acid kéo dài hơn 02 (hai) giờ (trừ thuốc viên tan rã trong ruột);
13. Thuốc viên tan rã trong ruột chứa hoạt chất không bền hoặc gây kích ứng trong dạ dày không đạt tiêu chuẩn chất lượng về chỉ tiêu độ rã trong môi trường acid hoặc chỉ tiêu độ hòa tan trong môi trường acid;
14. Thuốc tiêm dạng lỏng có thể tích nhỏ hơn 75% so với thể tích trên nhãn;
15. Thuốc tiêm bột có khối lượng thuốc nhỏ hơn 75% so với khối lượng trên nhãn;
16. Thuốc viên có độ hòa tan trung bình nhỏ hơn 50% so với mức chất lượng quy định trong tiêu chuẩn chất lượng;
17. Thuốc không đạt tiêu chuẩn chất lượng về tạp chất liên quan;
18. Thuốc tiêm, tiêm truyền không đạt tiêu chuẩn chất lượng về độ pH;
19. Thuốc viên giải phóng kéo dài, giải phóng biến đổi không đạt tiêu chuẩn chất lượng về chỉ tiêu độ hòa tan;
20. Thuốc không đạt tiêu chuẩn chất lượng về độ lắng của hỗn dịch, nhũ dịch tiêm;
21. Thuốc bị thu hồi bởi cơ quan quản lý nước ngoài, trừ trường hợp thu hồi khẩn cấp, và được kiểm tra có nhập khẩu vào Việt Nam;
22. Thuốc không đúng chủng loại do nhầm lẫn trong sản xuất, dán nhãn; thuốc có nhãn ghi không đúng đường dùng, liều dùng, hàm lượng, nồng độ hoạt chất, công dụng (nhưng không thuộc trường hợp quy định tại Mục I);
23. Thuốc sản xuất, nhập khẩu không đúng hồ sơ đăng ký hoặc giấy phép nhập khẩu;
24. Thuốc có chứa các chất có hàm lượng, nồng độ vượt quá giới hạn cho phép.
III. Thuốc vi phạm mức độ 3: là thuốc không thuộc trường hợp quy định tại Mục I, II mà do các nguyên nhân khác nhưng không ảnh hưởng đến hiệu quả điều trị và an toàn khi sử dụng, thuộc một trong các trường hợp sau đây:
1. Thuốc không đạt chất lượng về chỉ tiêu cảm quan: biến đổi màu sắc; tách lớp đối với thuốc mỡ, kem gel;
2. Thuốc không đạt chất lượng về chỉ tiêu tỷ trọng;
3. Thuốc viên không đạt chất lượng về chỉ tiêu chênh lệch khối lượng (khối lượng trung bình viên);
4. Thuốc kem, mỡ không đạt chất lượng về chỉ tiêu chênh lệch khối lượng;
5. Thuốc tiêm bột có khối lượng lớn hơn 75% so với nhãn nhưng nhỏ hơn giới hạn tiêu chuẩn chất lượng đã đăng ký;
6. Thuốc viên giải phóng trong dạ dày không đạt tiêu chuẩn chất lượng về độ tan rã nhưng thời gian tan rã ít hơn 02 (hai) giờ;
7. Thuốc viên bao đường, viên hoàn cứng không đạt độ tan rã;
8. Thuốc viên không đạt tiêu chuẩn chất lượng về độ hòa tan (trừ trường hợp quy định tại Khoản 17 Mục II);
9. Thuốc viên không đạt tiêu chuẩn chất lượng về chỉ tiêu hàm lượng hoạt chất nhưng nằm trong phạm vi 5% so với giới hạn quy định tại hồ sơ đăng ký;
10. Thuốc viên dược liệu không đạt tiêu chuẩn chất lượng về tạp chất, độ ẩm;
11. Thuốc viên tân dược, thuốc tiêm bột, thuốc tiêm đông khô không đạt tiêu chuẩn chất lượng về độ ẩm;
12. Thuốc dạng lỏng không đạt tiêu chuẩn chất lượng về độ pH (trừ trường hợp quy định tại mức độ 2);
13. Thuốc nước uống không đạt tiêu chuẩn chất lượng về độ lắng cặn;
14. Thuốc nước uống, thuốc nước dùng ngoài không đạt tiêu chuẩn chất lượng về thể tích;
15. Thuốc tiêm không đạt tiêu chuẩn chất lượng về thể tích nhưng không thấp hơn 75% so với thể tích trên nhãn ký;
16. Thuốc tiêm truyền không đạt tiêu chuẩn chất lượng về thể tích;
17. Thuốc không đáp ứng đầy đủ yêu cầu về ghi nhãn, trừ trường hợp mức độ 1 và 2 nêu trên;
18. Thuốc có vật liệu bao bì và dạng đóng gói không đáp ứng yêu cầu bảo quản;
IV. Các trường hợp vi phạm khác: Cục Quản lý Dược kết luận mức độ vi phạm của thuốc sau khi có ý kiến của Hội đồng tư vấn cấp giấy đăng ký lưu hành thuốc của Bộ Y tế. Ý kiến của Hội đồng được xác định trên cơ sở đánh giá nguy cơ ảnh hưởng của thuốc vi phạm đến sức khỏe của người sử dụng.
BIỂU
MẪU
(Kèm
theo Thông tư số 11/2018/TT-BYT ngày 04 tháng 5 năm 2018 của Bộ trưởng
Bộ Y tế)
Mẫu số 01: Biên bản lấy mẫu thuốc
|
Tên đơn vị
chủ quản |
CỘNG HÒA XÃ
HỘI CHỦ NGHĨA VIỆT NAM |
|
|
………., ngày…… tháng…… năm 20… |
BIÊN BẢN LẤY MẪU THUỐC ĐỂ XÁC ĐỊNH CHẤT LƯỢNG
Giấy giới thiệu hoặc thẻ thanh tra (ghi rõ số, ngày, tháng năm, tên cơ quan cấp): ……………………
Họ tên, chức vụ, cơ quan của những người tham gia lấy mẫu:
1 ........................................................................................................................................
2 ........................................................................................................................................
3 ........................................................................................................................................
Tên cơ sở được lấy mẫu: ………………………………
Phân loại cơ sở được lấy mẫu: ……………………………………
Địa chỉ:…………………………….. Điện thoại: ……………………………..
|
STT |
Tên thuốc, nồng độ, hàm lượng, số đăng ký |
Lô SX, ngày SX, hạn dùng |
Đơn vị đóng gói nhỏ nhất |
Số lượng lấy |
Tên nhà sản xuất và địa chỉ |
Tên nhà nhập khẩu (nếu là thuốc NK), nhà phân phối |
Nhận xét tình trạng lô thuốc trước khi lấy mẫu |
|
|
|
|
|
|
|
|
|
Điều kiện bảo quản khi lấy mẫu: ………………….
Biên bản này được làm thành 03 bản: 01 bản lưu tại cơ sở được lấy mẫu, 01 bản lưu tại cơ quan kiểm nghiệm, 01 bản lưu tại ………. (cơ quan quản lý, kiểm tra chất lượng).
|
Người lấy mẫu |
Đại diện cơ
sở được lấy mẫu |
|
Tên đơn vị
chủ quản |
CỘNG HÒA XÃ
HỘI CHỦ NGHĨA VIỆT NAM |
Số:
Mẫu để kiểm nghiệm:
Cơ sở sản xuất:
Cơ sở nhập khẩu (đối với thuốc nước ngoài):
Số lô: Ngày sản xuất: Hạn dùng:
Số giấy đăng ký đăng ký lưu hành hoặc số giấy phép nhập khẩu:
Nơi lấy mẫu (gửi mẫu):
Người lấy mẫu (gửi mẫu):
Yêu cầu kiểm nghiệm (ghi rõ nội dung, số, ngày, tháng, năm của biên bản lấy mẫu hoặc giấy tờ kèm theo)
Ngày tháng năm nhận mẫu:
Số đăng ký kiểm nghiệm:
Người giao mẫu: Người nhận mẫu:
Tiêu chuẩn áp dụng:
Tình trạng mẫu khi nhận và khi mở niêm phong để kiểm nghiệm:
|
|
Chỉ tiêu chất lượng |
Yêu cầu chất lượng |
Kết quả và kết luận |
|
1. |
|
|
|
|
2. |
|
|
|
|
3… |
|
|
|
Kết luận: (Ghi rõ tình trạng Lô sản phẩm đáp ứng hay không đáp ứng tiêu chuẩn chất lượng; trường hợp không đáp ứng phải ghi rõ lý do không đạt).
|
|
….., ngày….tháng….năm…… |
|
Tên đơn vị
chủ quản |
CỘNG HÒA XÃ
HỘI CHỦ NGHĨA VIỆT NAM |
Số:
Mẫu để phân tích:
Cơ sở sản xuất:
Cơ sở nhập khẩu (đối với thuốc nước ngoài):
Số lô: Ngày sản xuất: Hạn dùng:
Số giấy đăng ký lưu hành hoặc số giấy phép nhập khẩu:
Nơi gửi mẫu:
Người gửi mẫu:
Yêu cầu phân tích (ghi rõ nội dung, số, ngày, tháng, năm của biên bản lấy mẫu hoặc giấy tờ kèm theo)
Ngày tháng năm nhận mẫu:
Số đăng ký phân tích:
Người giao mẫu: Người nhận mẫu:
Tiêu chuẩn áp dụng:
Tình trạng mẫu khi nhận và khi mở niêm phong để phân tích:
|
Chỉ tiêu chất lượng |
Yêu cầu chất lượng |
Kết quả |
|
1. |
|
|
|
2. |
|
|
|
3... |
|
|
|
|
…….., ngày...
tháng... năm… |
Mẫu số 04: Biên bản thu hồi thuốc
|
Tên đơn vị
chủ quản |
CỘNG HÒA XÃ
HỘI CHỦ NGHĨA VIỆT NAM |
|
|
……, ngày tháng năm…… |
Chúng tôi gồm (ghi rõ họ tên, chức vụ từng thành viên):
1/......................................................................................................................................
2/......................................................................................................................................
3/ .....................................................................................................................................
thuộc ................................................................................................................................
được giao nhiệm vụ thu hồi thuốc không đạt chất lượng theo công văn số: …………..
ngày.... tháng.... năm.... của ..............................................................................................
Đã tiến hành thu hồi tại…………………… số thuốc sau:
|
Số TT |
Tên thuốc, nồng độ, hàm lượng |
Đơn vị |
Số lượng thu hồi |
Số lô sản xuất |
Đơn vị sản xuất |
Ghi chú |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Đại diện cơ sở nơi thu hồi thuốc |
Các thành viên |
Trưởng bộ phận thu hồi |
Mẫu số 05: Báo cáo thu hồi thuốc
|
Tên đơn vị
chủ quản |
CỘNG HÒA XÃ
HỘI CHỦ NGHĨA VIỆT NAM |
|
|
…………., ngày tháng năm …… |
Kính gửi:...
Thực hiện công văn số... ngày... tháng... năm... của.... về việc thu hồi thuốc..., số đăng ký..., số lô sản xuất..., ngày sản xuất..., hạn dùng... do... sản xuất,... nhập khẩu (đối với thuốc nhập khẩu),... (Tên cơ sở) xin báo cáo kết quả thu hồi thuốc như sau:
1. Thông tin về lô thuốc bị thu hồi:
- Tên thuốc, số giấy đăng ký lưu hành hoặc số giấy phép nhập khẩu, tên hoạt chất, nồng độ/hàm lượng, dạng bào chế, số lô, hạn dùng, cơ sở sản xuất cơ sở nhập khẩu;
- Thời gian xuất xưởng/nhập khẩu;
2. Kết quả thu hồi thuốc:
2.1. Kết quả thu hồi thuốc từ các cơ sở kinh doanh dược:
|
STT |
Tên cơ sở kinh doanh đã mua thuốc |
Đơn vị tính |
Số lượng đã mua |
Số lượng đưa ra lưu hành |
Số lượng thu hồi |
Ghi chú |
|
1 |
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
3... |
|
|
|
|
|
|
|
Tổng số |
|
|
|
|
|
|
2.2. Tổng hợp kết quả thu hồi thuốc
- Số lượng thuốc đã sản xuất nhập khẩu;
- Số lượng thuốc đưa ra lưu hành trên thị trường;
- Số lượng thuốc đã thu hồi.
|
|
…….., ngày...
tháng... năm ……. |
|
Tên đơn vị
chủ quản |
CỘNG HÒA XÃ
HỘI CHỦ NGHĨA VIỆT NAM |
|
Số: |
……….., ngày…….. tháng……… năm……… |
Thực hiện quyết định số:…….. ngày... tháng … năm...của ………về việc hủy thuốc không đạt chất lượng, thuốc quá hạn dùng.
Hôm nay, ngày… tháng... năm… tại (tên địa điểm hủy thuốc): …………
Hội đồng hủy thuốc được thành lập theo quyết định số.... ngày …tháng... năm… của …………gồm có:
1 ................................................................................................................................
2 ................................................................................................................................
3 ................................................................................................................................
...................................................................................................................................
đã chứng kiến và tiến hành hủy các thuốc sau:
|
STT |
Tên thuốc, nồng độ, hàm lượng |
Số lô |
Tên đơn vị sản xuất |
Số lượng thuốc hủy theo chứng từ |
Số thuốc thực hủy |
Chênh lệch (*) |
Ghi chú |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
((*) Nếu có chênh lệch giữa số thuốc thực hủy và số lượng thuốc hủy theo chứng từ thì phải giải trình lý do)
Phương thức hủy:
...........................................................................................................................................
...........................................................................................................................................
Biên bản hủy thuốc báo cáo lên ...........................................................................................
Biên bản này lập thành….. bản, mỗi bên giữ 01 bản, gửi báo cáo……. bản
|
Các thành
viên tham gia hủy thuốc |
Chủ tịch Hội
đồng hủy thuốc |
Mẫu số 07: Báo cáo việc lấy mẫu kiểm tra chất lượng thuốc
|
Tên đơn vị
chủ quản |
CỘNG HÒA XÃ
HỘI CHỦ NGHĨA VIỆT NAM |
|
Số … |
…………, ngày…… tháng…… năm …… |
BÁO CÁO VIỆC LẤY MẪU KIỂM TRA CHẤT LƯỢNG THUỐC
Kính gửi: Cục Quản lý Dược - Bộ Y tế
|
Tên và địa chỉ cơ sở sản xuất |
Tên nước sản xuất |
Tên thuốc (dạng bào chế), HC, HL |
SĐK hoặc GPNK |
Số lô, NSX (nếu có), HD |
Quy cách đóng gói /Đvt (đơn vị đóng gói nhỏ nhất) |
Số lượng nhập khẩu (*) |
Tên, sđt cơ sở đăng ký (*) |
Tên, sđt cơ sở nhập khẩu |
Tên, sđt cơ sở ủy thác NK (nếu có) (*) |
Tên, sđt (các) cơ sở phân phối cấp 1 (nếu có) (*) |
Ngày nhập khẩu (*) |
Tên, sđt cơ sở lấy mẫu và cơ sở kiểm nghiệm |
Ngày lấy mẫu |
Ngày ban hành PKN |
KQKN (đạt/kg đạt) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(*) Cơ sở lấy mẫu & cơ sở kiểm nghiệm không báo cáo những nội dung này.
|
|
...,ngày...
tháng... năm… |
Mẫu số 08: Giấy chứng nhận xuất xưởng vắc xin, sinh phẩm
|
Tên đơn vị
chủ quản |
CỘNG HÒA XÃ
HỘI CHỦ NGHĨA VIỆT NAM |
GIẤY CHỨNG NHẬN CHẤT LƯỢNG VẮC XIN, SINH PHẨM
Số:
|
Tên thương mại: Tên chung: |
Số giấy đăng ký lưu hành hoặc số giấy phép nhập khẩu: Mã số mẫu của cơ sở kiểm nghiệm: |
|
Lô số (trên lọ/bơm tiêm/ống): |
Lô số (trên vỏ hộp): |
|
Ngày sản xuất: |
Hạn dùng: |
|
Dạng đóng gói: |
Lô nước hồi chỉnh số (nếu có): Hạn dùng: |
|
Cơ sở sản xuất: |
Cơ sở nhập khẩu: |
|
Ngày sản xuất/ nhập khẩu: |
Số lượng sản xuất/ nhập khẩu: |
Kết luận:
(Ghi rõ tình trạng Lô sản phẩm đáp ứng hay không đáp ứng về tiêu chuẩn chất lượng đã được Bộ Y tế phê duyệt, về soát xét hồ sơ và về điều kiện bảo quản trong dây chuyền lạnh trong quá trình nhập khẩu; trường hợp không đáp ứng phải ghi rõ lý do không đạt).
|
|
……., ngày...
tháng... năm…… |
(Không có nội dung)
Vì chưa Đăng Nhập nên Bạn chỉ xem được Thuộc tính của Văn bản. Bạn chưa xem được Hiệu lực của Văn bản, Văn bản Liên quan, Văn bản thay thế, Văn bản gốc, Văn bản tiếng Anh,...
Nếu chưa có Tài khoản, mời Bạn Đăng ký Tài khoản tại đây
(Không có nội dung)
Vì chưa Đăng Nhập nên Bạn chỉ xem được Thuộc tính của Văn bản. Bạn chưa xem được Hiệu lực của Văn bản, Văn bản Liên quan, Văn bản thay thế, Văn bản gốc, Văn bản tiếng Anh,...
Nếu chưa có Tài khoản, mời Bạn Đăng ký Tài khoản tại đây
Vì chưa Đăng Nhập nên Bạn chỉ xem được Thuộc tính của Văn bản. Bạn chưa xem được Hiệu lực của Văn bản, Văn bản Liên quan, Văn bản thay thế, Văn bản gốc, Văn bản tiếng Anh,...
Nếu chưa có Tài khoản, mời Bạn Đăng ký Tài khoản tại đây
Vì chưa Đăng Nhập nên Bạn chỉ xem được Thuộc tính của Văn bản. Bạn chưa xem được Hiệu lực của Văn bản, Văn bản Liên quan, Văn bản thay thế, Văn bản gốc, Văn bản tiếng Anh,...
Nếu chưa có Tài khoản, mời Bạn Đăng ký Tài khoản tại đây
Vì chưa Đăng Nhập nên Bạn chỉ xem được Thuộc tính của Văn bản. Bạn chưa xem được Hiệu lực của Văn bản, Văn bản Liên quan, Văn bản thay thế, Văn bản gốc, Văn bản tiếng Anh,...
Nếu chưa có Tài khoản, mời Bạn Đăng ký Tài khoản tại đây
- Tải Văn bản tiếng Việt Tải Văn bản tiếng Việt
- Tải bản PDF Tải bản PDF
- Tải Văn bản tiếng Anh Tải Văn bản tiếng Anh
- Tải Văn bản gốc Tải Văn bản gốc
Vì chưa Đăng Nhập nên Bạn chỉ xem được Thuộc tính của Văn bản. Bạn chưa xem được Hiệu lực của Văn bản, Văn bản Liên quan, Văn bản thay thế, Văn bản gốc, Văn bản tiếng Anh,...
Nếu chưa có Tài khoản, mời Bạn Đăng ký Tài khoản tại đây














