Thông tư 16/2014/TT-BNNPTNT về quy chuẩn kỹ thuật Quốc gia về Kiểm dịch và Bảo vệ thực vật do Bộ Nông nghiệp và Phát triển nông thôn ban hành
Thông tư 16/2014/TT-BNNPTNT về quy chuẩn kỹ thuật Quốc gia về Kiểm dịch và Bảo vệ thực vật do Bộ Nông nghiệp và Phát triển nông thôn ban hành
| Số hiệu: | 16/2014/TT-BNNPTNT | Loại văn bản: | Thông tư |
| Nơi ban hành: | Bộ Nông nghiệp và Phát triển nông thôn | Người ký: | Lê Quốc Doanh |
| Ngày ban hành: | 05/06/2014 | Ngày hiệu lực: | Đã biết |
| Ngày công báo: | 28/06/2014 | Số công báo: | 623-624 |
| Tình trạng: | Đã biết |
| Số hiệu: | 16/2014/TT-BNNPTNT |
| Loại văn bản: | Thông tư |
| Nơi ban hành: | Bộ Nông nghiệp và Phát triển nông thôn |
| Người ký: | Lê Quốc Doanh |
| Ngày ban hành: | 05/06/2014 |
| Ngày hiệu lực: | Đã biết |
| Ngày công báo: | 28/06/2014 |
| Số công báo: | 623-624 |
| Tình trạng: | Đã biết |
|
BỘ NÔNG NGHIỆP VÀ
PHÁT TRIỂN NÔNG THÔN |
CỘNG HÒA XÃ
HỘI CHỦ NGHĨA VIỆT NAM |
|
Số: 16/2014/TT-BNNPTNT |
Hà Nội, ngày 05 tháng 06 năm 2014 |
BAN HÀNH QUY CHUẨN KỸ THUẬT QUỐC GIA VỀ KIỂM DỊCH VÀ BẢO VỆ THỰC VẬT
Căn cứ Luật Tiêu chuẩn và Quy chuẩn kỹ thuật ngày 29 tháng 6 năm 2006;
Căn cứ Pháp lệnh Bảo vệ và Kiểm dịch thực vật số 36/2001/PL-UBTVQH10 ngày 25/7/2001;
Căn cứ Nghị định số 127/2007/NĐ-CP ngày 01 tháng 8 năm 2007 của Chính phủ quy định chi tiết thi hành một số điều của Luật Tiêu chuẩn và Quy chuẩn kỹ thuật;
Căn cứ Nghị định số 199/2013/NĐ-CP ngày 26 tháng 11 năm 2013 của Chính phủ quy định chức năng, nhiệm vụ, quyền hạn và cơ cấu tổ chức của Bộ Nông nghiệp và Phát triển nông thôn;
Xét đề nghị của Cục trưởng Cục Bảo vệ thực vật;
Bộ trưởng Bộ Nông nghiệp và Phát triển nông thôn ban hành Quy chuẩn kỹ thuật quốc gia về Kiểm dịch và Bảo vệ thực vật,
Điều 1. Ban hành kèm theo Thông tư này Quy chuẩn kỹ thuật quốc gia về lĩnh vực Kiểm dịch và Bảo vệ thực vật:
Ký hiệu: QCVN 01 - 159 : 2014/BNNPTNT
Ký hiệu: QCVN 01 - 160 : 2014/BNNPTNT
Ký hiệu: QCVN 01 - 161 : 2014/BNNPTNT
Ký hiệu: QCVN 01 - 162 : 2014/BNNPTNT
Ký hiệu: QCVN 01 - 163 : 2014/BNNPTNT
Ký hiệu: QCVN 01 - 164 : 2014/BNNPTNT
Ký hiệu: QCVN 01 - 165 : 2014/BNNPTNT
8. Quy chuẩn kỹ thuật Quốc gia về Phương pháp điều tra phát hiện dịch hại lúa.
Ký hiệu: QCVN 01 - 166 : 2014/BNNPTNT
9. Quy chuẩn kỹ thuật Quốc gia về Phương pháp điều tra phát hiện dịch hại cây ngô.
Ký hiệu: QCVN 01 - 167 : 2014/BNNPTNT
10. Quy chuẩn kỹ thuật Quốc gia về Phương pháp điều tra phát hiện dịch hại trên cây lạc, đậu tương.
Ký hiệu: QCVN 01 - 168 : 2014/BNNPTNT
11. Quy chuẩn kỹ thuật Quốc gia về Phương pháp điều tra phát hiện dịch hại cây rau họ hoa thập tự.
Ký hiệu: QCVN 01 - 169 : 2014/BNNPTNT
Ký hiệu: QCVN 01 - 170 : 2014/BNNPTNT
Ký hiệu: QCVN 01 - 171 : 2014/BNNPTNT
14. Quy chuẩn kỹ thuật Quốc gia về Phương pháp điều tra phát hiện sinh vật chính hại cây hồ tiêu.
Ký hiệu: QCVN 01 - 172 : 2014/BNNPTNT
Ký hiệu: QCVN 01 - 173 : 2014/BNNPTNT
Ký hiệu: QCVN 01 - 174 : 2014/BNNPTNT
Ký hiệu: QCVN 01 - 175 : 2014/BNNPTNT
Ký hiệu: QCVN 01 - 176 : 2014/BNNPTNT
Ký hiệu: QCVN 01 - 177 : 2014/BNNPTNT
Ký hiệu: QCVN 01 - 178 : 2014/BNNPTNT
Ký hiệu: QCVN 01 - 179 : 2014/BNNPTNT
Ký hiệu: QCVN 01 - 180 : 2014/BNNPTNT
Ký hiệu: QCVN 01 - 181 : 2014/BNNPTNT
Điều 2. Thông tư này có hiệu lực kể từ ngày 05 tháng 11 năm 2014.
Điều 3. Vụ trưởng Vụ Khoa học Công nghệ và Môi trường, Cục trưởng Cục Bảo vệ thực vật, Thủ trưởng các cơ quan, tổ chức và cá nhân có liên quan chịu trách nhiệm tổ chức thực hiện.
Trong quá trình thực hiện, nếu có vấn đề vướng mắc, đề nghị các cơ quan, tổ chức, cá nhân kịp thời phản ánh về Bộ Nông nghiệp và Phát triển nông thôn để Bộ nghiên cứu, sửa đổi, bổ sung../.
|
|
KT. BỘ TRƯỞNG |
National technical regulation on Procedure for identification of Karnal bunt of wheat (Tilletia indica Mitra) - Plant quarantine pest of Vietnam
Lời nói đầu
QCVN 01 - 159 : 2014/BNNPTNT do Trung tâm Giám định Kiểm dịch thực vật biên soạn, Cục Bảo vệ thực vật trình duyệt Bộ Nông nghiệp & PTNT ban hành tại Thông tư số 16/TT-BNNPTNT ngày 05 tháng 6 năm 2014.
QUY CHUẨN KỸ THUẬT QUỐC GIA VỀ QUY TRÌNH GIÁM ĐỊNH BỆNH PHẤN ĐEN LÚA MỲ TILLETIA INDICA MITRA LÀ DỊCH HẠI KIỂM DỊCH THỰC VẬT CỦA VIỆT NAM
National technical regulation on Procedure for identification of Karnal bunt of wheat (Tilletia indica Mitra) - Plant quarantine pest of Vietnam
I. QUY ĐỊNH CHUNG
1.1. Phạm vi điều chỉnh
Quy chuẩn này quy định quy trình giám định bệnh phấn đen lúa mỳ Tilletia indica Mitra - là dịch hại kiểm dịch thực vật nhóm I của Việt Nam
1.2. Đối tượng áp dụng
Quy chuẩn này áp dụng đối với các tổ chức, cá nhân Việt Nam hoặc nước ngoài có hoạt động liên quan đến lĩnh vực bảo vệ và kiểm dịch thực vật thực hiện giám định bệnh phấn đen lúa mỳ Tilletia indica Mitra - là dịch hại kiểm dịch thực vật (KDTV) nhóm I thuộc Danh mục dịch hại KDTV của Việt Nam.
1.3. Giải thích từ ngữ
Trong quy chuẩn này, các từ ngữ dưới đây được hiểu như sau:
1.3.1. Dịch hại kiểm dịch thực vật (plant quarantine pest):
Là loài dịch hại có nguy cơ gây hại nghiêm trọng tài nguyên thực vật trong một vùng mà ở đó loài sinh vật này chưa xuất hiện hoặc xuất hiện có phân bố hẹp và phải được kiểm soát chính thức.
1.3.2. Thực vật (plant):
Là cây và những bộ phận của cây còn sống, kể cả hạt giống và sinh chất có khả năng làm giống.
1.3.3. Mẫu (sample):
Là khối lượng thực vật, sản phẩm thực vật hoặc tàn dư của sản phẩm thực vật được lấy ra theo một qui tắc nhất định.
1.3.8. Tiêu bản (specimen):
Là mẫu vật điển hình tiêu biểu của dịch hại được xử lý để dùng cho việc định loại, nghiên cứu, giảng dạy, phổ biến kỹ thuật và trưng bày thành các bộ sưu tập.
1.3.9. Phản ứng chuỗi trùng hợp hoặc phản ứng khuếch đại gen (Polymerase Chain Reaction - PCR):
Là kỹ thuật phổ biến trong sinh học phân tử nhằm khuếch đại (tạo ra nhiều bản sao) một đoạn DNA mà không cần sử dụng các sinh vật sống.
II. QUY ĐỊNH KỸ THUẬT
2.1. Phương pháp thu thập và bảo quản mẫu
2.1.1. Thu thập mẫu
Đối với hàng xuất, nhập khẩu, quá cảnh hoặc vận chuyển, bảo quản trong nước: Tiến hành lấy mẫu theo tiêu chuẩn Việt Nam TCVN 4731:891 "Kiểm dịch thực vật - phương pháp lấy mẫu", quy chuẩn kỹ thuật quốc gia QCVN 01-23:2010/BNNPTNT1 "Phương pháp kiểm tra các loại hạt xuất, nhập khẩu và quá cảnh".
Đối với cây trồng ngoài đồng ruộng; Lấy mẫu theo Quy chuẩn kỹ thuật quốc gia QCVN 01-38/2010/BNNPTNT1 "Phương pháp điều tra phát hiện dịch hại cây trồng".
2.1.2. Bảo quản mẫu
Các bộ phận tươi (bông) có triệu chứng bệnh chứa trong các túi ni-lông có lỗ thông khí bảo quản trong tủ lạnh ở nhiệt độ 3 - 5oC.
Mẫu hạt được chứa trong các túi ni-lông hoặc hộp nhựa kín và bảo quản ở nhiệt độ phòng.
Các tiêu bản lam của nấm được dán nhãn, để trong hộp chuyên dụng đựng tiêu bản lam và bảo quản ở nhiệt độ phòng.
2.2. Thiết bị dụng cụ, hóa chất
Kính lúp soi nổi có độ phóng đại 10 - 40 lần, kính hiển vi có độ phóng đại 40 - 1.000 lần.
Lưới lọc (kích thước mắt lưới 53mm, 20mm), bình tam giác, máy ly tâm, máy lắc, tủ sấy, tủ định ôn, cân điện, bể ổn nhiệt, máy PCR, máy điện di, hệ thống chụp ảnh...
Bộ dao, kim giải phẫu, panh, kéo, bộ micro pipet.
Đèn cồn, đĩa petri, ống hút, lam, lamen, cốc đong, giấy parafilm.
Cồn 70o, lactophenol, acid lactic, nước cất vô trùng, Tween 20, Na2HPO4, KH2PO4, Glycerol, ethylium bromide, agarose, cycloheximide.
Kít chiết tách DNA, kit PCR
2.3. Phương pháp phát hiện và giám định bệnh
2.3.1. Phát hiện và thu thập mẫu bệnh
Cây nhiễm bệnh thấp hơn, bông ngắn, số lượng hạt trên bông giảm (hình 1, phụ lục 1). Nấm chỉ gây bệnh trên một số hạt trên bông, các hạt nhiễm bệnh thường bị lép.
Ban đầu có chấm đen nhỏ dưới phần nội nhũ và rãnh hạt.
Khi xâm nhiễm trên hạt, nấm làm cho hạt có mùi tanh (do trimethylamine) tương tự như nấm T. tritici, T. foetida và T. controversa. Hạt bị xâm nhiễm từ phần rốn hạt và chạy dọc theo đường rãnh hạt (không gây nhiễm nội nhũ), hạt có thể bị vỡ hoàn toàn hoặc bị nứt một phần (hình 2, phụ lục 1). Khi bệnh nặng, mô dọc theo rãnh hạt và vùng tiếp giáp nội nhũ bị thay thế bởi các bào tử. Mày hạt bị tách ra làm cho hạt bị nhiễm bệnh lộ ra ngoài, cả hạt và phần mày hạt có thể bị rụng khỏi bông.
2.3.2. Phương pháp giám định bằng đặc điểm hình thái nấm gây bệnh
2.3.2.1. Phương pháp kiểm tra trực tiếp
Dùng kim khêu nấm khêu lớp bào tử trên hạt đặt lên lam kính đã có sẵn một giọt axit lactic và đậy lamen.
Đặt lam lên kính hiển vi và quan sát đặc điểm hình thái và đo kích thước của bào tử nấm.
Đối chiếu với hình dạng và kích thước bào tử phấn đen lúa mỳ Tilletia indica Mitra (phụ lục 1).
2.3.2.2. Phương pháp rửa quay ly tâm
Lấy 50g hạt lúa mỳ cho vào bình tam giác 250ml. Thêm vào bình 100ml dung dịch Tween-20 nồng độ 0,01%, đậy nắp bình (có thể bao kín bằng giấy parafilm). Đặt bình tam giác lên máy lắc hoặc lắc bằng tay trong vòng 3 phút để các bào tử rời ra khỏi hạt lúa mỳ. Chuẩn bị một bình lọc bao gồm một bình tam giác, một phễu trong đó có 1 lưới lọc kích thước 53mm. Đỗ dịch và hạt lúa mỳ lên phễu của bình tam giác đã chuẩn bị. Dùng bình phun nước cất rửa hạt lúa mì còn ở trên lưới 3 lần (mỗi lần dùng 20-50ml nước cất). Tiếp tục rửa hạt lúa mì bằng nước cất đến khi lượng nước trong bình đạt từ 300-400ml. Bỏ lưới lọc, rửa phễu lọc 2 lần bằng nước cất mỗi lần 10-20ml nước.
Chuẩn bị bộ lọc thứ 2 bao gồm 1 bình tam giác; 1 phễu trong đó có đặt một lưới lọc 20mm (lưới lọc này có thể ngâm trong nước trước để có hiệu quả lọc tốt hơn). Rót dịch thu được ở trên qua bộ lọc đã chuẩn bị. Rửa bình chứa dịch 2 lần bằng 10ml nước cất. Nghiêng lưới lọc một góc 30-35o rửa nhẹ nhàng lưới lọc bằng nước cất sao cho phần cặn còn lại trên lưới lọc dồn sang bên cạnh của lưới lọc. Dùng công tơ hút hút dịch và cặn trên lưới lọc vào ống ly tâm. Ly tâm dịch thu được ở tốc độ 4000 vòng/phút trong 3 phút. Phần cặn thu được sau ly tâm hòa tan lại trong nước cất để đạt dung tích khoảng 50-100ml.
Hút dịch lên lam kính, đậy lamen quan sát và đo đếm đặc điểm hình thái của bào tử nấm gây bệnh trên kính hiển vi và so sánh với đặc điểm bào tử của nấm Tilletia indica (phụ lục 1)
Lưu ý: Trong trường hợp mẫu hạt đã qua xử lý hóa chất diệt nấm, hạt phải được ngâm trong NaOH (0,2% hoặc 1%) trong 24 giờ trước khi rửa, quay ly tâm
2.3.2. Phương pháp giám định PCR
Sử dụng phương pháp PCR để giám định đối với nấm gây bệnh phấn đen lúa mỳ Tilletia indica Mitra.
Quy trình chi tiết như phụ lục 2.
III. THẨM ĐỊNH KẾT QUẢ GIÁM ĐỊNH VÀ BÁO CÁO
Sau khi khẳng định kết quả giám định bệnh phấn đen lúa mỳ Tilletia indica Mitra - là dịch hại kiểm dịch thực vật của Việt Nam, đơn vị giám định phải gửi báo cáo về Cục Bảo vệ thực vật kèm theo phiếu kết quả giám định (phụ lục 3).
Tất cả các đơn vị thuộc hệ thống Bảo vệ và KDTV phải lưu giữ, quản lý và khai thác dữ liệu về kết quả điều tra, báo cáo và giám định bệnh phấn đen lúa mỳ Tilletia indica Mitra.
Đối với đơn vị lần đầu tiên giám định và phát hiện được bệnh phấn đen lúa mỳ Tilletia indica Mitra phải gửi mẫu hoặc tiêu bản về Trung tâm Giám định kiểm dịch thực vật để thẩm định.
Đơn vị giám định phải đảm bảo thời gian lưu mẫu theo quy định hiện hành.
IV. TỔ CHỨC THỰC HIỆN
Cục Bảo vệ thực vật có trách nhiệm phổ biến; tổ chức, hướng dẫn và kiểm tra việc thực hiện Quy chuẩn này trong hệ thống tổ chức chuyên ngành Bảo vệ và Kiểm dịch thực vật cũng như các tổ chức, cá nhân khác có liên quan;
Các tổ chức, cá nhân có hoạt động liên quan đến điều tra, thu thập mẫu, xử lý và bảo quản mẫu bệnh phấn đen lúa mỳ tại Việt Nam phải tuân theo quy định của quy chuẩn này cũng như các quy định của pháp luật có liên quan hiện hành.
Phụ lục 1.
Thông tin về dịch hại
1. Phân bố và ký chủ
1.1. Phân bố
Trong nước: Bệnh chưa có ở Việt Nam
Trên thế giới: Châu Á (Ấn Độ, Afghanistan, Iraq, Nepal, Iran, Pakistan), Châu Phi (Nam Phi), Châu Mỹ (Kenya, Hoa Kì, Mexico).
1.2. Ký chủ: Lúa Mỳ (Triticum aestivum) Ngoài ra trong lây nhiễm nhân tạo nấm còn kí sinh trên Aegilops spp., Bromus spp., Lolium spp. và Oryzopsis.
2. Tên khoa học và vị trí phân loại
Tên tiếng Việt: Bệnh phấn đen lúa mỳ
Tên khoa học: Tilletia indica Mitra
Tên khác: Neovossia indica (Mitra) Mundk.
Vị trí phân loại:
Lớp: Ustilaginomycetes
Bộ: Tilletiales
Họ: Tilletiaceae
3. Triệu chứng bệnh phấn đen lúa mỳ
|
|
|
|
Hình 1: bông lúa mì nhiễm bệnh (Nguồn: CABI, 2012) |
Hình 2: hạt lúa mỳ nhiễm bệnh (Nguồn: CABI, 2012) |
4. Đặc điểm hình thái bào tử nấm Tilletia indica
Bào tử đông (Teliospore) dạng cầu tới gần cầu, đường kính thông thường 22-47mm, có thể lớn hơn (35-41mm); Màu sắc từ vàng cam nhạt tới nâu tới nâu đậm, đỏ nâu; một số bào tử có màu đen hoặc màu đen mờ. Gai dày đầu gai nhọn hoặc tù, một số trường hợp đầu hơi cong, độ dài gai 1,5-5,0mm. Bề mặt gai có dạng vỏ não với những rãnh hẹp. Các gai được bao bọc bởi một màng mỏng trong suốt (hình 3 hình 4).
Tế bào bất dục: hình cầu tới gần cầu hoặc hình giọt lệ, màu vàng nâu, 10-28x48mm, có hoặc không có đỉnh nhỏ (gai ngắn), vách tế bào mượt dày khoảng 7mm và tạo phiến.
|
|
|
|
Hình 3: Bề mặt bào tử T. indica (Nguồn: EPPO, 2012) |
Hình 4: Bào tử T. indica quan sát ở điểm giữa (Nguồn: EPPO, 2012) |
5. Phân biệt với một số nấm Tilletia khác
Bào tử đông của T. indica có thể bị nhầm lẫn bởi một số loài Tilletia lẫn tạp trong hạt lúa mỳ như: T. walkeri (hình 5) và T. horrida (hình 6) có thể phân biệt như sau.
|
|
T. horrida |
T. walkeri |
T. indica |
|
|
Kích thước bào tử to nhất (mm) |
<36 |
36-45 |
45-50 |
|
|
Kích thước trung bình (mm) |
24-28 |
30-31 |
35-41 |
|
|
Màu sắc bào tử đông |
Vàng nhạt tới màu hạt dẻ nhạt hoặc đậm (tới đen mờ) |
Vàng nhạt tới nâu đỏ (không có màu đen đục) |
Màu cam nhạt nhưng chủ yếu là màu đỏ nâu đậm tới đen mờ |
|
|
Hình thái và phân bố gai |
Gai nhọn, nhìn bề mặt có nhiều góc cạnh; ít khi có dạng rãnh vỏ não hoặc hiếm khi có dạng bụi. Đầu gai nhọn, có thể trở thành cụt, ít khi cong |
Dạng thô; dạng vân tương tự vỏ não không hoàn hảo hoặc bụi dày. Gai dạng nón tới cụt |
Gai dày, có dạng vỏ não. Đầu gai nhọn hoặc gẫy đầu. |
|
|
|
|
|||
|
Hình 5: Bào tử T. walkeri (thước 10um) Nguồn: PaDIL, 2012 |
Hình 6: Bào tử T. horrida (thước 10um) Nguồn: PaDIL, 2012 |
|||
Phụ lục 2.
(quy định)
Quy trình giám định nấm T. indica bằng PCR
1. Nhân sinh khối.
Rửa sạch bào tử thu được ở phương pháp rửa bằng cách rửa bằng nước cất trên lưới lọc 20mm. Hút dịch thu được vào ống mới thêm nước cất cho đủ 3ml ngâm qua đêm ở 21oC. Ly tâm 4000 vòng/phút trong 3 phút. Loại bỏ dịch trong ống chỉ thu phần cặn ly tâm. Hòa tan cặn ly tâm trong nước xà phòng 10%, thay nắp mới và lắc nhẹ ống ly tâm. Ly tâm ở 4000 vòng/phút trong 1 phút loại bỏ dịch rửa. Thêm vào 1ml nước cất vô trùng để rửa cặn ly tâm (Ly tâm và rửa 2 lần).Tiếp tục ly tâm 1200g trong 5 phút loại bỏ dịch rửa. Hòa tan lại cặn ly tâm trong 1ml nước cất vô trùng. Trang 200ml dịch hòa tan ở bước 10 lên môi trường Agar (WA) nuôi cấy ở 21oC chu kì ánh sáng 12 giờ tối/12 giờ sáng trong 5 ngày. Bọc các đĩa môi trường bằng giấy parafilm hoặc cho vào túi bóng, tiếp tục nuôi cấy trong 7-14 ngày.
Kiểm tra sự nảy mầm của bào tử. Cắt miếng thạch có bào tử nảy mầm gắn trên nắp hộp petri trong đó chứa 5ml môi trường khoai tây dextrose lỏng (potato dextrose broth), nuôi cấy ở 21oC chu kì ánh sáng 12 giờ tối/12 giờ sáng trong 2-3 ngày. Kiểm tra sự hình thành bào tử đảm trên bề mặt môi trường nếu chưa thấy nuôi cấy thêm 5 ngày. (hình 7). Dùng kim khêu vô trùng lấy những màng nấm trong môi trường đặt trên các miếng giấy lọc vô trùng để loại bỏ môi trường bám dính. Đặt các màng nấm vào các ống để tách chiết DNA.
|
|
|
|
|
T. indica |
T. walkeri |
T. horrida |
Hình 7: Tản nấm trên môi trường PDA sau 14 ngày
Nguồn: EPPO, 2007
2. Tách chiết DNA
0,1g nấm thu được cho vào ống ly tâm 2ml. Thêm vào 1ml nước tinh khiết dùng trong công nghệ phân tử (MGW) nghiền đều bằng chày thủy tinh hoặc chày nhựa vô trùng. Ủ trong 30 giây. Tách DNA bằng kít tách chiết DNA tổng số của nấm.
3. Giám định bằng PCR
- Cặp mồi sử dụng
Mồi xuôi Tin 3 (5'-CAA TGT TGG CGT GGC GGC GC-3')
Mồi ngược Tin 4 (5'-CAA CTC CAG TGA TGG CTCCG-3').
- Master mix:
20,2 ml of MGW
2,5 mL of 10 X PCR buffer chứa 15 mM MgCI2
0,25 mL dNTPs [10 mM]
0,1 mL AmpliTaq [5 U mL-1]
0,1 mL of mỗi mồi [25 mM]
1,0 mL dịch DNA chiết tách từ nấm
- Chu trình nhiệt
94oC trong 1 phút,
25 chu kỳ: 94oC trong 15 giây, 65oC trong 15 giây và 72oC trong 15 giây,
72oC trong 6 phút.
- Đọc kết quả:
- Điện di bằng agarose gel 2% Mẫu dương tính sẽ cho đoạn gen có kích thước 414kbp
Phụ lục 3.
(quy định)
Mẫu phiếu kết quả giám định
|
Cơ quan Bảo vệ |
CỘNG HÒA XÃ
HỘI CHỦ NGHĨA VIỆT NAM |
|
|
……….. ngày …. tháng …. năm 20….. |
PHIẾU KẾT QUẢ GIÁM ĐỊNH
Bệnh phấn đen lúa mỳ Tilletia indica Mitra - là dịch hại kiểm dịch thực vật của Việt Nam
|
1. Tên hàng hóa |
: |
|
|
2. Nước xuất khẩu |
: |
|
|
3. Xuất xứ |
: |
|
|
4. Phương tiện vận chuyển |
: |
Khối lượng: |
|
5. Địa điểm lấy mẫu |
: |
|
|
6. Ngày lấy mẫu |
: |
|
|
7. Người lấy mẫu |
: |
|
|
8. Tình trạng mẫu |
: |
|
|
9. Ký hiệu mẫu |
: |
|
|
10. Số mẫu lưu |
: |
|
|
11. Người giám định |
: |
|
12. Phương pháp giám định: Theo quy chuẩn kỹ thuật quốc gia QCVN 01 - 159 : 2014/BNNPTNT về "Quy trình giám định bệnh phấn đen lúa mỳ Tilletia indica Mitra - là dịch hại kiểm dịch thực vật của Việt Nam".
13. Kết quả giám định
Tên khoa học: Tilletia indica Mitra
Lớp: Ustilaginomycetes
Bộ: Tilletiales
Họ: Tilletiaceae
Là dịch hại kiểm dịch thực vật thuộc danh mục dịch hại kiểm dịch thực vật của Việt Nam.
|
TRƯỞNG PHÒNG KỸ
THUẬT |
THỦ TRƯỞNG ĐƠN VỊ |
National technical regulation on bio-efficacy against anthracnose (Colletotrichum spp.) on chilli of fungicides
Lời nói đầu
QCVN 01 - 160 : 2014/BNNPTNT do Trung tâm Kiểm định và Khảo nghiệm thuốc bảo vệ thực vật phía Bắc biên soạn, Cục Bảo vệ thực vật trình duyệt, Bộ Nông nghiệp & PTNT ban hành tại Thông tư số 16/TT-BNNPTNT ngày 05 tháng 6 năm 2014.
QUY CHUẨN KỸ THUẬT QUỐC GIA VỀ KHẢO NGHIỆM TRÊN ĐỒNG RUỘNG HIỆU LỰC PHÒNG TRỪ BỆNH THÁN THƯ (COLLETOTRICHUM SPP.) HẠI CÂY ỚT CỦA CÁC THUỐC TRỪ BỆNH
National technical regulation on bio-efficacy against anthracnose (Colletotrichum spp.) on chilli of fungicides
I. QUY ĐỊNH CHUNG
1.1. Phạm vi điều chỉnh
Quy chuẩn này quy định những nguyên tắc, nội dung và phương pháp chủ yếu để đánh giá hiệu lực phòng trừ bệnh thán thư (Colletotrichum spp.) hại cây ớt của các thuốc phòng trừ bệnh trên đồng ruộng.
1.2. Đối tượng áp dụng
Quy chuẩn này áp dụng cho các cơ quan, tổ chức thực hiện khảo nghiệm thuốc bảo vệ thực vật.
1.3. Giải thích từ ngữ
Những thuật ngữ trong quy chuẩn này được hiểu như sau:
1.3.1. Dịch hại
Là bất cứ loài, chủng hoặc biotype của tác nhân gây tổn hại thực vật, động vật hoặc gây bệnh cho thực vật hoặc sản phẩm thực vật (FAO, 1995; IPPC, 1997).
1.4. Điều kiện khảo nghiệm
Khảo nghiệm phải được tiến hành tại các cơ sở có đủ điều kiện theo quy định hiện hành về khảo nghiệm thuốc bảo vệ thực vật của Bộ Nông nghiệp và Phát triển nông thôn.
Khảo nghiệm được bố trí trên những ruộng cây ớt thường bị bệnh thán thư gây hại, tại các thời gian có điều kiện thuận lợi cho bệnh phát triển và ở các địa điểm đại diện cho các vùng sinh thái.
Điều kiện trồng trọt (đất, phân bón, giống cây trồng, mật độ trồng...) phải đồng đều trên toàn khu khảo nghiệm và phù hợp với tập quán canh tác tại địa phương.
Các khảo nghiệm trên diện hẹp và diện rộng phải được tiến hành ở ít nhất 2 vùng sản xuất nông nghiệp (phía Bắc và phía Nam) đại diện cho khu vực sản xuất cây ớt.
Trong thời gian khảo nghiệm không được sử dụng bất kỳ một loại thuốc phòng trừ bệnh nào khác trên khu khảo nghiệm (bao gồm cả các công thức và dải phân cách). Nếu khu khảo nghiệm bắt buộc phải sử dụng thuốc để trừ các đối tượng gây hại khác như: sâu, cỏ dại, điều hòa sinh trưởng... thì thuốc được sử dụng để trừ đối tượng này phải không làm ảnh hưởng đến thuốc cần khảo nghiệm, không làm ảnh hưởng đến đối tượng khảo nghiệm và phải được phun rải đều trên tất cả các ô khảo nghiệm, kể cả ô đối chứng. Các trường hợp trên (nếu có) phải được ghi chép lại.
Khi xử lý thuốc không để thuốc ở ô khảo nghiệm này tạt sang ô khảo nghiệm khác.
II. QUY ĐỊNH KỸ THUẬT
2.1. Phương pháp khảo nghiệm
2.1.1. Bố trí công thức khảo nghiệm
Khảo nghiệm được bố trí theo phương pháp khối ngẫu nhiên đầy đủ hoặc theo các phương pháp khác đã được quy định trong thống kê sinh học.
Mỗi khảo nghiệm phải thực hiện theo các công thức sau:
Công thức khảo nghiệm là công thức sử dụng các loại thuốc định khảo nghiệm ở những liều lượng hoặc theo cách sử dụng khác nhau
Công thức so sánh là công thức sử dụng một loại thuốc phòng trừ bệnh đã được đăng ký trong danh mục thuốc bảo vệ thực vật được phép sử dụng ở Việt Nam và đang được sử dụng phổ biến, có hiệu quả ở địa phương để phòng trừ bệnh thán thư hại cây ớt.
Công thức đối chứng là công thức không sử dụng bất kỳ loại thuốc bảo vệ thực vật nào để phòng trừ bệnh thán thư hại cây ớt. Với khảo nghiệm là thuốc phun: công thức đối chứng được phun bằng nước lã.
2.1.2. Diện tích ô khảo nghiệm và số lần nhắc lại
Khảo nghiệm diện hẹp: Diện tích của mỗi ô khảo nghiệm từ 30 m2 - 50 m2, số lần nhắc lại 3 - 4 lần.
Khảo nghiệm diện rộng: Diện tích của mỗi ô khảo nghiệm từ 300 m2 - 500 m2, không nhắc lại.
Các ô khảo nghiệm phải có dạng hình vuông hay hình chữ nhật nhưng chiều dài phải không vượt quá hai lần chiều rộng.
Giữa các công thức khảo nghiệm phải có dải phân cách ít nhất là 1 luống cây ớt.
2.2. Tiến hành xử lý thuốc
2.2.1. Lượng thuốc và lượng nước thuốc sử dụng
Lượng thuốc sử dụng được tính bằng kg; lít chế phẩm hoặc gam hoạt chất trên đơn vị diện tích 1 ha.
Với dạng thuốc thương phẩm pha với nước để phun: Lượng nước sử dụng phải theo hướng dẫn cụ thể đối với từng loại thuốc, phù hợp với từng giai đoạn sinh trưởng của cây ớt cũng như cách thức tác động của từng loại thuốc. Trong trường hợp không có khuyến cáo của các tổ chức cá nhân đăng ký về lượng nước thuốc, lượng nước thuốc sử dụng từ 400 - 600 lít/ha.
Các số liệu về lượng thuốc thành phẩm và lượng nước sử dụng (l/ha) phải được ghi rõ.
2.2.2. Dụng cụ xử lý thuốc
Dụng cụ xử lý thuốc: Bình bơm động cơ, bình bơm tay đeo vai, cốc đong, cân, pipet...
Khi xử lý thuốc, phải sử dụng các công cụ phun, rải thuốc thích hợp đảm bảo yêu cầu của khảo nghiệm, ghi chép đầy đủ tình hình vận hành của công cụ phun rải thuốc để đảm bảo yêu cầu kỹ thuật.
2.2.3. Thời điểm và số lần xử lý thuốc
Thời điểm và số lần xử lý thuốc thực hiện đúng theo hướng dẫn sử dụng của từng loại thuốc khảo nghiệm và phù hợp với mục đích khảo nghiệm.
Khi không có khuyến cáo cụ thể thời điểm xử lý thuốc thì tùy theo mục đích khảo nghiệm, các đặc tính hóa học, phương thức tác động của thuốc và đặc điểm sinh trưởng của cây trồng thì số lần xử lý từ 1-2 lần cách nhau 5 ngày. Xử lý thuốc lần đầu khi tỷ lệ bệnh khoảng 5%.
2.3. Điều tra và thu thập số liệu
2.3.1. Chỉ tiêu, phương pháp và thời điểm điều tra
2.3.1.1. Chỉ tiêu điều tra
|
+ Tỷ lệ bệnh (%) = |
Số quả (lá) bị bệnh |
x 100 |
|
Tổng số quả (lá) điều tra |
|
+ Chỉ số bệnh (%) = |
9n9 + 7n7 + 5n5 + 3n3 + n1 |
x 100 |
|
9 N |
Trong đó:
n1: số (quả) lá bị bệnh ở cấp 1 với ≤ 5 % diện tích (quả) lá bị bệnh
n3: số (quả) lá bị bệnh ở cấp 3 với > 5 - 15 % diện tích (quả) lá bị bệnh
n5: số (quả) lá bị bệnh ở cấp 5 với > 15 - 25 % diện tích (quả) lá bị bệnh
n7: số (quả) lá bị bệnh ở cấp 7 với > 25 - 50 % diện tích (quả) lá bị bệnh
n9: số (quả) lá bị bệnh ở cấp 9 với > 50 % diện tích (quả) lá bị bệnh
N: tổng số (quả) lá điều tra.
(Xem thêm Phân cấp chỉ số bệnh phụ lục 3)
2.3.1.2. Phương pháp điều tra
Mỗi ô chọn 5 điểm cố định nằm trên 2 đường chéo góc (đối với khảo nghiệm diện hẹp) và 10 điểm (đối với khảo nghiệm diện rộng), mỗi điểm điều tra toàn bộ số (quả) lá trên 4 cây cố định, các điểm này nằm cách mép ô khảo nghiệm ít nhất 1 hàng cây ớt.
2.3.1.3. Thời điểm điều tra
Thời điểm và số lần điều tra ngay trước mỗi lần xử lý thuốc và sau lần xử lý thuốc cuối 5, 10 ngày.
2.3.1.4. Xử lý số liệu
Hiệu lực phòng trừ của thuốc phòng trừ bệnh thán thư cây ớt được đánh giá qua tỷ lệ bệnh và chỉ số bệnh tại các lần điều tra.
Các số liệu thu được qua khảo nghiệm diện hẹp phải được xử lý bằng các phương pháp thống kê thích hợp.
2.3.1.5. Đánh giá tác động của thuốc đến cây ớt
Đánh giá ảnh hưởng của thuốc khảo nghiệm (nếu có) đến sự sinh trưởng và phát triển của cây ớt theo thang phân cấp (phụ lục 1).
Những chỉ tiêu có thể đo đếm được phải biểu thị bằng các số liệu cụ thể theo các phương pháp điều tra phù hợp.
Các chỉ tiêu đánh giá được bằng mắt như độ cháy lá, quăn lá, sự thay đổi màu sắc lá... phải mô tả.
Khi thuốc làm ảnh hưởng đến sinh trưởng, phát triển cây ớt phải theo dõi và ghi nhận ngày cây phục hồi trở lại.
2.3.1.6. Quan sát và ghi chép về thời tiết
Ghi chép các số liệu về nhiệt độ, ẩm độ, lượng mưa trong suốt thời gian khảo nghiệm theo số liệu thời tiết tại trạm khí tượng gần nhất.
III. QUY ĐỊNH VỀ QUẢN LÝ THỰC HIỆN
3.1. Báo cáo và công bố kết quả
3.1.1. Đánh giá mức độ độc của thuốc đối với cây trồng (Phụ lục 1)
3.1.2. Nội dung báo cáo (Phụ lục 2)
3.2. Tổ chức quản lý, thực hiện
Đơn vị thực hiện khảo nghiệm phải hoàn toàn chịu trách nhiệm về số liệu đưa ra trong báo cáo và có trách nhiệm lưu giữ số liệu thô của khảo nghiệm.
Căn cứ yêu cầu quản lý, Cục Bảo vệ thực vật có trách nhiệm kiến nghị Bộ Nông nghiệp và Phát triển nông thôn sửa đổi, bổ sung quy chuẩn này khi cần thiết.
Phụ lục 1.
Bảng phân cấp mức độ độc của thuốc khảo nghiệm đối với cây ớt
|
Cấp 1 2 3 4 5 6 7 8 9 |
Triệu chứng nhiễm độc Cây chưa có biểu hiện ngộ độc Ngộ độc nhẹ, sinh trưởng của cây giảm nhẹ Có triệu chứng ngộ độc nhẹ nhìn thấy bằng mắt Triệu chứng ngộ độc nhưng chưa ảnh hưởng đến năng suất Cành lá biến màu hoặc cháy, thuốc gây ảnh hưởng đến năng suất Thuốc làm giảm năng suất ít Thuốc gây ảnh hưởng nhiều đến năng suất Triệu chứng ngộ độc tăng dần tới làm chết cây Cây bị chết hoàn toàn |
Nếu cây ớt bị ngộ độc thuốc, cần xác định bao nhiêu ngày sau thì phục hồi.
Phụ lục 2.
Nội dung chính cho bản báo cáo khảo nghiệm
1. Tên khảo nghiệm
2. Yêu cầu của khảo nghiệm
3. Điều kiện khảo nghiệm:
- Đơn vị khảo nghiệm
- Tên cán bộ tiến hành khảo nghiệm
- Thời gian khảo nghiệm
- Địa điểm khảo nghiệm
- Nội dung khảo nghiệm
- Đặc điểm khảo nghiệm
- Đặc điểm đất đai, canh tác, giống cây trồng...
- Đặc điểm thời tiết trong quá trình khảo nghiệm
- Tình hình phát sinh và phát triển của bệnh hại cây ớt trong khu thí nghiệm
4. Phương pháp khảo nghiệm:
- Công thức khảo nghiệm
- Phương pháp bố trí khảo nghiệm
- Số lần nhắc lại
- Kích thước ô khảo nghiệm
- Dụng cụ phun, rải thuốc
- Lượng thuốc sử dụng kg, lít thuốc thương phẩm/ha hay g(kg) hoạt chất/ha
- Lượng nước thuốc sử dụng (l/ha)
- Ngày xử lý thuốc
- Phương pháp điều tra và đánh giá hiệu lực của các loại thuốc khảo nghiệm
5. Kết quả khảo nghiệm:
- Các bảng số liệu
- Đánh giá hiệu lực của từng loại thuốc
- Nhận xét tác động của từng loại thuốc đến cây ớt và các ảnh hưởng khác (xem phụ lục)
6. Kết luận: Nhận xét về hiệu lực và ảnh hưởng của thuốc khảo nghiệm đối với cây ớt phải căn cứ vào số liệu thu được
Phụ lục 3.
Phân cấp chỉ số bệnh thán thư hại cây ớt
![]()
Cấp 1: ≤ 5% diện tích quả bị bệnh
![]()
Cấp 3: >5 - 15% diện tích quả bị bệnh
![]()
Cấp 5: >15 - 25% diện tích quả bị bệnh

Cấp 7: >25 - 50% diện tích quả bị bệnh
![]()
Cấp 9: > 50% diện tích quả bị bệnh
National technical regulation on Procedure for identification of tomato canker (Clavibacter michiganensis subsp. michiganensis (Smith) Davis et al.) - Plant Quarantine pest of Vietnam
Lời nói đầu
QCVN 01 - 161 : 2014/BNNPTNT do Trung tâm giám định Kiểm dịch thực vật biên soạn, Cục Bảo vệ thực vật trình duyệt Bộ Nông nghiệp & PTNT ban hành tại Thông tư số 16/TT-BNNPTNT ngày 05 tháng 6 năm 2014.
QUY CHUẨN KỸ THUẬT QUỐC GIA VỀ QUY TRÌNH GIÁM ĐỊNH BỆNH THỐI LOÉT CÀ CHUA CLAVIBACTER MICHIGANENSIS SUBSP. MICHIGANENSIS (SMITH) DAVIS ET AL. LÀ DỊCH HẠI KIỂM DỊCH THỰC VẬT CỦA VIỆT NAM
National technical regulation on Procedure for identification of tomato canker (Clavibacter michiganensis subsp. michiganensis (Smith) Davis et al.) - Plant Quarantine pest of Vietnam
I. QUY ĐỊNH CHUNG
1.1. Phạm vi điều chỉnh
Quy chuẩn này quy định quy trình giám định bệnh thối loét cà chua (Clavibacter michiganensis subsp. michiganensis (Smith) Davis et al.) là dịch hại kiểm dịch thực vật nhóm I của Việt Nam
1.2. Đối tượng áp dụng
Quy chuẩn này áp dụng đối với các tổ chức, cá nhân Việt Nam hoặc nước ngoài có hoạt động liên quan đến lĩnh vực bảo vệ và kiểm dịch thực vật thực hiện giám định bệnh thối loét cà chua (Clavibacter michiganensis subsp. michiganensis (Smith) Davis et al.) là dịch hại kiểm dịch thực vật (KDTV) nhóm I thuộc Danh mục dịch hại KDTV của Việt Nam.
1.3. Giải thích từ ngữ
Trong quy chuẩn này, các từ ngữ dưới đây được hiểu như sau:
1.3.1. Dịch hại kiểm dịch thực vật (plant quarantine pest)
Là loài dịch hại có nguy cơ gây hại nghiêm trọng tài nguyên thực vật trong một vùng mà ở đó loài sinh vật này chưa xuất hiện hoặc xuất hiện có phân bố hẹp và phải được kiểm soát chính thức.
1.3.2. Thực vật (plant)
Là cây và những bộ phận của cây còn sống, kể cả hạt giống và sinh chất có khả năng làm giống.
1.3.3. Mẫu (sample)
Là khối lượng thực vật, sản phẩm thực vật hoặc tàn dư của sản phẩm thực vật được lấy ra theo một qui tắc nhất định.
1.3.8. Tiêu bản (specimen)
Là mẫu vật điển hình tiêu biểu của dịch hại được xử lý để dùng cho việc định loại, nghiên cứu, giảng dạy, phổ biến kỹ thuật và trưng bày thành các bộ sưu tập.
1.3.9. Xét nghiệm hấp thụ miễn dịch liên kết với enzyme ((Enzyme-Linked ImmunoSorbent Assay - ELISA) hay (Enzyme Immuno Assay - EIA)
Là một kỹ thuật sinh hóa để phát hiện kháng thể hay kháng nguyên trong mẫu cần phân tích.
1.3.10. Phản ứng chuỗi trùng hợp hoặc phản ứng khuếch đại gen (Polymerase Chain Reaction - PCR)
Là một kỹ thuật trong sinh học phân tử nhằm khuếch đại (tạo ra nhiều bản sao) một đoạn DNA mà không cần sử dụng các sinh vật sống
II. QUY ĐỊNH KỸ THUẬT
2.1. Phương pháp thu thập và bảo quản mẫu
2.1.1. Thu thập mẫu
Đối với hàng xuất, nhập khẩu, quá cảnh hoặc vận chuyển, bảo quản trong nước: Tiến hành lấy mẫu theo tiêu chuẩn quốc gia TCVN 4731:891 "Kiểm dịch thực vật - phương pháp lấy mẫu", quy chuẩn kỹ thuật quốc gia QCVN 01-21:2010/BNNPTNT1 "Phương pháp kiểm tra củ, quả xuất nhập khẩu và quá cảnh", QCVN 01-23:2010/BNNPTNT1 "Phương pháp kiểm tra các loại hạt xuất, nhập khẩu và quá cảnh", QCVN 01-22:2010/BNNPTNT1 "Phương pháp kiểm tra cây xuất nhập khẩu và quá cảnh".
Đối với cây trồng ngoài đồng ruộng: Lấy mẫu theo Quy chuẩn kỹ thuật quốc gia QCVN 01-38/2010/BNNPTNT1 về phương pháp điều tra phát hiện dịch hại cây trồng
2.1.2. Bảo quản mẫu
Các bộ phận tươi có triệu chứng bệnh (cành, lá, thân, quả...) chứa trong các túi ni-lông có lỗ thông khí bảo quản trong tủ lạnh ở nhiệt độ 3-5oC.
Mẫu hạt được chứa trong các túi ni-lông hoặc hộp nhựa kín và bảo quản ở nhiệt độ phòng.
2.2. Thiết bị, dụng cụ, hóa chất
Máy ly tâm, máy lắc, tủ sấy, tủ định ôn, cân điện tử, máy ủ, máy rửa, bể ổn nhiệt, hệ thống ELISA, PCR, máy điện di, hệ thống chụp ảnh, tủ lạnh và tủ âm sâu.
Bộ dao, kim giải phẫu, panh, kéo, bộ micro pipet, túi ni-lông, bản ELISA
Đèn cồn, đĩa petri, ống hút, lam, lamen, cốc đong, giấy parafilm.
Na2CO3, NaHCO3, NaN3, NaCI, KCl, MgCI2.6H2O, HN(CH2CH2OH)2, MgSO4.7H2O, KH2PO4, K2HPO4, Na2HPO4, NaOH,
Cồn tuyệt đối, cồn 70% nước cất vô trùng, Tween 20, glycerol, ethylium bromide, agarose, cycloheximide. môi trường NGA (Nutrient Glucose Agar) hoặc YPGA (Yeast Peptone Glucose Agar). Kít PCR, kháng thể
2.3. Phương pháp phát hiện và giám định bệnh
2.3.1. Phát hiện và thu thập mẫu bệnh
Trên lá, vết bệnh ban đầu là những đốm màu xanh nhợt có dạng giọt dầu ở phần phiến lá giữa các gân lá. Các vết này nhanh chóng khô đi tạo ra các vết chết hoại có màu trắng hoặc màu nâu (hình 1, phụ lục 1). Khi bệnh từ phiến lá xâm nhiễm vào hệ thống mạch dẫn một số lá chét ở một phía của lá kép bị héo rũ (hình 2, phụ lục 1).
Trên thân cây, triệu chứng bệnh có thể là các sọc vàng, đôi khi thân bị nứt dọc theo các đốt thân (hình 3, phụ lục 1). Bó mạch của các cây nhiễm bệnh có màu vàng sậm hoặc nâu (hình 4, phụ lục 1).
Trên quả, triệu chứng thường bắt đầu từ những đốm nhỏ hơi lồi lên, vết bệnh có viền hoặc quầng trắng. Các vết bệnh phát triển to ra và có màu nâu ở tâm vết bệnh tạo ra dạng "mắt chim" (hình 5, phụ lục 1).
Trên hạt, bệnh không biểu hiện triệu chứng.
2.3.2. Phân lập vi khuẩn
2.3.2.1. Tách chiết vi khuẩn
Tách chiết vi khuẩn từ mô cây (lá, thân, quả): Cắt một đoạn mô cây đã được khử trùng bề mặt bằng cồn 70o ngâm trong nước cất vô trùng 30 phút hoặc nghiền nhỏ mô cây trong nước cất vô trùng.
Tách chiết vi khuẩn từ hạt: Lượng mẫu tối thiểu để tách chiết là 2.000 hạt (khoảng 7g). Hạt được cho vào bình tam giác có chứa 20ml dịch chiết hạt (phụ lục 2) và lắc mạnh bằng tay trong 20-30 giây. Sau đó, đưa bình tam giác có dịch chiết hạt lên máy lắc và lắc trong 36-48 giờ với tốc độ 150 vòng/phút.
2.3.2.2. Phân lập vi khuẩn trên môi trường nhân tạo
Trải đều 1ml dịch chiết thu được từ mô cây hoặc từ hạt trên môi trường bán đặc hiệu và nuôi cấy ở 26oC trong 8 ngày.Theo dõi sự xuất hiện của khuẩn lạc. Khuẩn lạc của vi khuẩn C. michiganensis subsp. michiganensis có màu vàng sáng, phồng, có dạng tròn đôi khi có dạng bất định.
Các khuẩn lạc điển hình được cấy truyền trên môi trường NGA (Nutrient Glucose Agar) hoặc YPGA (Yeast Peptone Glucose Agar)
2.3.3. Giám định bằng phương pháp ELISA (chỉ áp dụng đối với mẫu quả, cây, vi khuẩn nuôi cấy trên môi trường nhân tạo)
2.3.3.1. Chuẩn bị dịch mẫu
Mẫu mô cây (quả, thân, lá): lấy một mẫu nhỏ mô cây (quả hoặc thân hoặc lá) ngâm trong 1ml nước cất khoảng 15-20 phút. Sau đó nước chứa vi khuẩn được ly tâm 13.000 vòng/phút trong 5 phút thu tủa vi khuẩn. Hòa tan tủa vi khuẩn thu được trong 1ml dung dịch đệm chiết mẫu (phụ lục 2).
Đối với vi khuẩn nuôi cấy trên môi trường nhân tạo: Hòa tan một phần khuẩn lạc trong 1ml dung dịch đệm chiết mẫu.
2.3.3.2. Quy trình giám định bằng phương pháp ELISA
Nhỏ vào mỗi giếng ELISA 100ml dịch mẫu đã chuẩn bị. Bọc bản giếng bằng túi ni-lông ủ ở 37oC qua đêm (khoảng 4-6 giờ). Sau đó, nhỏ thêm vào mỗi giếng 200ml dung dịch đệm cố định mẫu (phụ lục 2). Bọc bản giếng bằng túi ni-lông ủ 30 phút ở nhiệt độ phòng. Rửa giếng bằng đệm rửa (phụ lục 2) ba lần sau đó loại sạch đệm rửa bằng cách vỗ nhẹ bản giếng trên giấy thấm. Thêm vào mỗi giếng 100ml kháng thể. Bọc bản giếng bằng túi ni-lông ủ 1 giờ ở nhiệt độ phòng. Rửa giếng bằng đệm rửa tám lần sau đó loại sạch đệm rửa bằng cách vỗ nhẹ bản giếng trên giấy thấm. Thêm vào mỗi giếng 100ml Enzym gắn. Bọc bản giếng bằng túi ni-lông ủ 1 giờ ở nhiệt độ phòng.
Rửa giếng bằng đệm rửa tám lần sau đó loại sạch đệm rửa bằng cách vỗ nhẹ bản giếng trên giấy thấm. Thêm vào mỗi giếng 100ml đệm cơ chất (phụ lục 2). Ủ 1 giờ ở nhiệt độ phòng.
Đọc kết quả bằng mắt thường hoặc bằng máy đọc ở bước sóng 405nm.
2.3.4. Giám định bằng phương pháp PCR
2.3.4.1. Tách chiết DNA
Tách chiết DNA từ vi khuẩn đã phân lập (xem mục 2.3.2.2): Dùng que cấy vi khuẩn lấy một khuẩn lạc trên môi trường cho vào ống eppendorf đã chứa 100ml nước cất vô trùng khuấy đều để hòa tan khuẩn lạc. Tiếp theo để ống eppendorf ở nhiệt độ 95oC trong 15 phút trong bể ổn nhiệt sau đó đặt ngay lên đá lạnh. Ly tâm dịch vi khuẩn trong 5-10 giây.
Tách chiết DNA từ dịch vi khuẩn (xem mục 2.3.2.1): Cho 100ml dịch chiết vi khuẩn vào ống eppendorf và để ở nhiệt độ 95oC trong 15 phút trong bể ổn nhiệt sau đó đặt ngay lên đá lạnh. Tiếp theo, ly tâm dịch chiết trong 5-10 giây.
2.3.4.2. Quy trình giám định bằng PCR
Đoạn mồi sử dụng
PSA-4: 5'-TCA TTG GTC AAT TCT GTC TCC C -3'
PSA-R: 5-TAC TGA GAT GTT TCA CTT CCC C -3'
Chu trình nhiệt:
|
94oC trong 2,5 phút |
|
|
94oC trong 30 giây |
Lặp lại 30 chu kì |
|
63oC trong 20 giây |
|
|
72oC trong 45 giây |
|
|
72oC trong 10 phút |
|
Đọc kết quả sản phẩm được điện di bằng gel agarose 2% trong đệm TAE, nhuộm bản gel trong dung dịch ethydium bromide và quan sát dưới đèn UV.
Mẫu dương tính cho đoạn gen kích thước 270bp.
III. THẨM ĐỊNH KẾT QUẢ GIÁM ĐỊNH VÀ BÁO CÁO
Sau khi khẳng định kết quả giám định bệnh thối loét cà chua Clavibacter michiganensis subsp. michiganensis (Smith) Davis et al. là dịch hại kiểm dịch thực vật của Việt Nam, đơn vị giám định phải gửi báo cáo về Cục Bảo vệ thực vật kèm theo phiếu kết quả giám định (phụ lục 3).
Đối với đơn vị lần đầu tiên giám định và phát hiện được bệnh thối loét cà chua (Clavibacter michiganensis subsp. michiganensis (Smith) Davis et al.) phải gửi mẫu hoặc tiêu bản về Trung tâm Giám định kiểm dịch thực vật để thẩm định.
Tất cả các đơn vị thuộc hệ thống Bảo vệ và KDTV phải lưu giữ, quản lý và khai thác dữ liệu về kết quả điều tra, báo cáo và giám định bệnh thối loét cà chua là dịch hại kiểm dịch thực vật nhóm I của Việt Nam.
Đơn vị giám định phải đảm bảo thời gian lưu mẫu theo quy định hiện hành.
IV. TỔ CHỨC THỰC HIỆN
Cục Bảo vệ thực vật có trách nhiệm phổ biến; tổ chức, hướng dẫn và kiểm tra việc thực hiện Quy chuẩn này trong hệ thống tổ chức chuyên ngành Bảo vệ và Kiểm dịch thực vật cũng như các tổ chức, cá nhân khác có liên quan;
Các tổ chức, cá nhân có hoạt động liên quan đến điều tra, thu thập mẫu, xử lý và bảo quản mẫu bệnh thối loét cà chua tại Việt Nam phải tuân theo quy định của quy chuẩn này cũng như các quy định của pháp luật có liên quan hiện hành.
Phụ lục 1.
Thông tin về dịch hại
1. Phân bố và ký chủ
1.1. Phân bố
Trong nước: Bệnh chưa có ở Việt Nam
Trên thế giới: Châu Á (Israel, Thổ Nhĩ Kì, Armenia, Azerbaijan, Trung Quốc, Ấn Độ, Indonesia, Iran; Nhật Bản, Hàn Quốc, Syria), Châu Phi (Nam Phi, Ai Cập, Kenya, Madagascar, Togo, Uganda, Zambia, Morocco, Tanzania; Tunisia; Zimbabwe), Châu Mỹ (Canada, Hoa Kì, Uruguay, Costa Rica, Cuba, Dominica, Dominican Republic, Grenada; Guadeloupe, Panama; Argentina, Brazil bang Pernambuco, Sao Paulo, Colombia, Peru, Chile, Ecuador), Châu Âu (Pháp, Hy Lạp, Liên bang Nga, Thụy Sỹ, Cộng hòa Séc, Lithuania, Hà Lan, Belarus, Ba Lan, Romania, Tây Ban Nha, Bulgaria, Cyprus, Đức, Hungary, Italy, Serbia, Slovenia, Ukraine, Liên bang Nam Tư...) và Châu Đại Dương (Australia, New Zealand).
1.2. Kí chủ: Kí chủ chính là cây Cà chua Solanum lycopersicum, ngoài ra còn gây hại trên ớt ngọt Capsicum annuum kí chủ dại họ cà như Solanum douglasii, S. nigrum and S. triflorum (Bradbury, 1986)
2. Tên khoa học và vị trí phân loại
- Tên tiếng Việt:
Bệnh thối loét cà chua
- Tên khoa học:
Clavibacter michiganensis subsp. michiganensis (Smith) Davis et al.
- Tên khác:
Corynebacterium michiganense pv. michiganense (Smith) Dye & Kemp
Corynebacterium michiganense (Smith) Jensen
- Vị trí phân loại:
Lớp: Actinobacteria.
Bộ: Actinomycetales
Họ: Microbacteriaceae
Giống: Clavibacter
C. michiganensis subsp. michiganensis là một vi khuẩn hảo khí, hình gậy cong, không di động, gram dương.
3. Triệu chứng bệnh thối loét cà chua.
|
|
|
|
Hình 1: Triệu chứng trên lá của bệnh thối loét cà chua (Nguồn: CABI, 2012) |
Hình 2: Triệu chứng héo lá một bên của bệnh thối loét cà chua (Nguồn: CABI, 2012) |
|
|
|
|
Hình 3: Triệu chứng vỡ thân của bệnh thối loét cà chua (Nguồn: CABI, 2012) |
Hình 4: Triệu chứng trên bó mạch của bệnh thối loét cà chua (Nguồn: CABI, 2012) |

Hình 5: Triệu chứng trên quả của bệnh thối loét cà chua
(Nguồn: CABI, 2012)
4. Đặc điểm vi khuẩn gây bệnh thối loét cà chua
C. michiganensis subsp. michiganensis là một vi khuẩn hảo khí, gram dương, hình gậy cong, không di động.
Vi khuẩn phát triển chậm trên môi trường nutrient gluco agar (NGA) hoặc yeast peptone glucose agar (YPGA), khuẩn lạc có màu vàng, tròn, sáng, mịn.
Phụ lục 2.
1. Dịch chiết hạt
|
Na2HPO4 KH2PO4 Nước cất pH |
: 4,26 g : 2,72 g : 1000ml : 7,0 |
Hòa tan các thành phần trên vào 1.000 ml nước cất khử trùng ở 121oC trong 15 phút. Khử trùng Tween 20 riêng rẽ để nguội tới 60oC. Thêm Tween 20 với nồng độ 0.02%.
Thêm vào 200mg cycloheximide (1.0 ml dung dịch 200 mg/ml trong 70% ethanol)
2. Dung dịch đệm chiết mẫu
|
Na2CO3 NaHCO3 NaN3 |
: 1,59g : 2,93g : 0,2g |
Hòa tan các thành phần trên trong 1000ml nước cất, chỉnh pH 9,6 bảo quản ở 4oC.
3. Dung dịch đệm rửa
|
NaCl Na2HPO4 KH2PO4 KCI Tween-20 |
: 8,0g : 1,15g : 0,2g : 0,2g : 0,5g |
Hòa tan các thành phần trên trong 1000ml nước cất, chỉnh pH 7,4
4. Dung dịch đệm cố định mẫu
|
Na2HPO4 KCI KH2PO4 NaCl NaN3 |
: 1,15g : 0,2g : 0,2g : 8,0g : 0,2g |
Hòa tan các thành phần trên trong 930ml nước cất, chỉnh pH 7,4 thêm nước cất cho đủ 1000ml. Trước khi dùng cho thêm 5g sữa khô không béo/lít đệm đã pha.
5. Dung dịch đệm cơ chất
|
MgCI2.6H2O NaN3 HN(CH2CH2OH)2 |
: 0,1g : 0,2g : 97ml |
Hòa tan trong 800ml nước, chỉnh pH về 9,8. Thêm nước cất cho đủ 1000ml. bảo quản ở 4oC. Trước khi dùng thêm viên cơ chất để đạt nồng độ 1mg/ml.
Phụ lục 3.
(quy định)
Mẫu phiếu kết quả giám định
|
Cơ quan Bảo vệ |
CỘNG HÒA XÃ
HỘI CHỦ NGHĨA VIỆT NAM |
|
|
……….. ngày …. tháng …. năm 20….. |
PHIẾU KẾT QUẢ GIÁM ĐỊNH
Bệnh thối loét cà chua Clavibacter michiganensis subsp. michiganensis (Smith) Davis et al. - là dịch hại kiểm dịch thực vật của Việt Nam
|
1. Tên hàng hóa |
: |
|
|
2. Nước xuất khẩu |
: |
|
|
3. Xuất xứ |
: |
|
|
4. Phương tiện vận chuyển |
: |
Khối lượng: |
|
5. Địa điểm lấy mẫu |
: |
|
|
6. Ngày lấy mẫu |
: |
|
|
7. Người lấy mẫu |
: |
|
|
8. Tình trạng mẫu |
: |
|
|
9. Ký hiệu mẫu |
: |
|
|
10. Số mẫu lưu |
: |
|
|
11. Người giám định |
: |
|
12. Phương pháp giám định: Theo quy chuẩn kỹ thuật quốc gia QCVN 01 - 161 : 2014/BNNPTNT về "Quy trình giám định bệnh thối loét cà chua Clavibacter michiganensis subsp. michiganensis (Smith) Davis et al. là dịch hại kiểm dịch thực vật của Việt Nam".
13. Kết quả giám định
Clavibacter michiganensis subsp. michiganensis (Smith) Davis et al.
Lớp: Actinobacteria.
Bộ: Actinomycetales
Họ: Microbacteriaceae
Giống: Clavibacter
Là dịch hại kiểm dịch thực vật thuộc danh mục dịch hại kiểm dịch thực vật của Việt Nam.
|
TRƯỞNG PHÒNG KỸ
THUẬT |
THỦ TRƯỞNG ĐƠN VỊ |
National technical regulation on Procedure for identification of South African citrus thrips (Scirtothrips aurantii Faure) - Plant quarantine pest of Vietnam
Lời nói đầu
QCVN 01 - 162 : 2014/BNNPTNT do Trung tâm Giám định Kiểm dịch thực vật biên soạn, Cục Bảo vệ thực vật trình duyệt, Bộ Nông nghiệp & PTNT ban hành tại Thông tư số 16/TT-BNNPTNT ngày 05 tháng 6 năm 2014.
QUY CHUẨN KỸ THUẬT QUỐC GIA VỀ QUY TRÌNH GIÁM ĐỊNH BỌ TRĨ CAM (SCIRTOTHRIPS AURANTii FAURE) LÀ DỊCH HẠI KIỂM DỊCH THỰC VẬT CỦA VIỆT NAM
National technical regulation on Procedure for identification of South African citrus thrips (Scirtothrips aurantii Faure) - Plant quarantine pest of Vietnam
I. QUY ĐỊNH CHUNG
1.1. Phạm vi điều chỉnh
Quy chuẩn này áp dụng thống nhất trên phạm vi toàn quốc cho việc giám định bọ trĩ cam (Scirtothrips aurantii Faure) là dịch hại kiểm dịch thực vật nhóm I của Việt Nam.
1.2. Đối tượng áp dụng
Quy chuẩn này áp dụng đối với mọi tổ chức, cá nhân Việt Nam hoặc nước ngoài có hoạt động liên quan đến lĩnh vực bảo vệ và kiểm dịch thực vật (viết tắt là KDTV) tại Việt Nam thực hiện giám định bọ trĩ cam (Scirtothrips aurantii Faure) là dịch hại KDTV nhóm I thuộc Danh mục dịch hại KDTV của Việt Nam ban hành kèm theo Quyết định số 73/2005/QĐ-BNN ngày 14/11/2005 của Bộ trưởng Bộ Nông nghiệp và Phát triển nông thôn.
1.3. Giải thích từ ngữ
Những thuật ngữ trong quy chuẩn này được hiểu như sau:
1.3.1. Dịch hại kiểm dịch thực vật (plant quarantine pest)
Là loài sinh vật hại có nguy cơ gây hại nghiêm trọng tài nguyên thực vật trong một vùng mà ở đó loài sinh vật này chưa xuất hiện hoặc xuất hiện có phân bố hẹp và được kiểm soát chính thức.
1.3.2. Côn trùng (insect)
Là động vật không xương sống thuộc ngành chân đốt, cơ thể pha trưởng thành gồm 3 phần: đầu, ngực và bụng. Ngực mang 3 đôi chân.
1.3.3. Mẫu (sample)
Là khối lượng thực vật, sản phẩm thực vật, tàn dư của sản phẩm thực vật hoặc đất được lấy ra theo một qui tắc nhất định.
1.3.4. Tiêu bản (specimen)
Là mẫu vật điển hình tiêu biểu của dịch hại được xử lý để dùng cho việc định loại, nghiên cứu, giảng dạy, phổ biến kỹ thuật và trưng bày thành các bộ sưu tập.
II. QUY ĐỊNH KỸ THUẬT
2.1. Phương pháp thu thập và bảo quản mẫu
2.1.1. Thu thập mẫu
- Đối với hàng hóa xuất, nhập khẩu, quá cảnh hoặc vận chuyển, bảo quản trong nước: Tiến hành lấy mẫu theo tiêu chuẩn Việt Nam TCVN 4731:891 "Kiểm dịch thực vật - Phương pháp lấy mẫu", quy chuẩn kỹ thuật quốc gia QCVN 01-21:2010/BNNPTNT1 Phương pháp kiểm tra củ, quả xuất nhập khẩu và quá cảnh"; QCVN 01-22:2010/BNNPTNT1 "Phương pháp kiểm tra cây xuất nhập khẩu và quá cảnh".
- Đối với cây trồng ngoài đồng ruộng: Lấy mẫu theo phương pháp của quy chuẩn kỹ thuật quốc gia QCVN 01-38:2010/BNNPTNT1 "Phương pháp điều tra phát hiện sinh vật hại cây trồng".
2.1.2. Bảo quản mẫu giám định
Mẫu giám định chưa làm tiêu bản được ngâm trong cồn 70%.
2.2. Dụng cụ, hóa chất phục vụ làm tiêu bản và giám định
- Kính lúp soi nổi, kính hiển vi, bàn gia nhiệt.
- Đèn cồn, ống nghiệm, đĩa petri, lọ nút mài, ống nhỏ giọt, kim côn trùng, lam, lamen, bút lông, đũa thủy tinh.
- Dung dịch NaOH hoặc KOH 5%, cồn 70%, nước cất.
- Keo Hoyer's để cố định mẫu (phụ lục 1).
2.3. Phương pháp làm tiêu bản mẫu giám định
Tiêu bản giám định được thực hiện với trưởng thành bọ trĩ cam theo phương pháp sau:
- Ngâm mẫu bọ trĩ trong dung dịch KOH 5% ở nhiệt độ phòng trong thời gian 1 giờ đối với mẫu nhạt màu, 4 - 5 giờ đối với mẫu đậm màu.
- Rửa mẫu bằng nước cất sau đó rửa lại bằng cồn 70% 2 - 3 lần để loại bỏ KOH.
- Nhỏ 1 giọt keo Hoyer's lên chính giữa lam. Dùng kim côn trùng đặt mẫu trưởng thành vào trong giọt Hoyer's, luồn mũi kim xuống phía dưới cánh, đẩy cánh trước và cánh sau tách ra không xếp chồng lên nhau. Đậy lamen lên trên, tránh tạo bọt khí.
- Mẫu lam được sấy trên bàn gia nhiệt ở nhiệt độ 40oC trong 6-8 giờ.
2.4. Trình tự giám định
Quan sát mẫu tiêu bản trên kính lúp hiển vi lần lượt các đặc điểm sau:
- Hình dạng râu đầu, số đốt râu.
- Các lông phía đầu.
- Các lông trên ngực giữa.
- Các lông trên đường vân cánh trước.
- Hàng lông nhỏ phía cuối các đốt bụng.
- Vệt tối màu ở giữa các đốt bụng.
2.5. Đối chiếu kết quả quan sát với đặc điểm hình thái của bọ trĩ cam (Scirtothrips aurantii Faure) (phụ lục 2).
Thông thường, số lượng cá thể nghiên cứu phải đảm bảo là 30 (n=30). Trong trường hợp số lượng cá thể ít hơn hoặc chỉ phát hiện duy nhất một cá thể trưởng thành có các đặc điểm nhận dạng như trên có thể cho phép kết luận là Scirtothrips aurantii Faure (chỉ áp dụng đối với các đơn vị đã từng giám định được Scirtothrips aurantii Faure).
2.6. Thẩm định kết quả giám định và báo cáo
Sau khi khẳng định kết quả giám định là bọ trĩ cam (Scirtothrips aurantii Faure) thuộc danh mục dịch hại KDTV nhóm I của Việt Nam, đơn vị giám định phải gửi báo cáo về Cục Bảo vệ thực vật kèm theo phiếu kết quả giám định (phụ lục 2).
Tất cả các đơn vị thuộc hệ thống Bảo vệ và KDTV phải lưu giữ, quản lý và khai thác dữ liệu về kết quả điều tra, báo cáo và giám định bọ trĩ cam.
Đối với đơn vị lần đầu tiên giám định và phát hiện được bọ trĩ cam phải gửi mẫu hoặc tiêu bản về Trung tâm Giám định kiểm dịch thực vật để thẩm định và báo cáo Cục Bảo vệ thực vật trước khi công bố và xử lý dịch theo quy định của pháp luật hiện hành.
Đơn vị giám định phải lưu mẫu theo Quy chuẩn kỹ thuật hiện hành về thời gian để giải quyết khiếu nại về kết quả giám định (nếu có).
III. TỔ CHỨC THỰC HIỆN
Cục Bảo vệ thực vật có trách nhiệm phổ biến, tổ chức, hướng dẫn và kiểm tra việc thực hiện Quy chuẩn này trong hệ thống tổ chức chuyên ngành Bảo vệ và Kiểm dịch thực vật cũng như các tổ chức, cá nhân khác có liên quan.
Các tổ chức, cá nhân có hoạt động liên quan đến điều tra, thu thập, xử lý và bảo quản mẫu bọ trĩ cam (Scirtothrips aurantii Faure) là dịch hại kiểm dịch thực vật nhóm I tại Việt Nam phải tuân theo quy định của quy chuẩn này cũng như các quy định của pháp luật có liên quan hiện hành.
Phụ lục 1.
Cách pha dung dịch Hoyer's
Thành phần keo Hoyer's:
|
Gum Arabic Chloral hydrate Nước cất Glycerin |
: 15g : 75g : 25ml : 5ml |
Cách pha Hoyer's: Cho gum Arabic vào nước cất, khuấy đều đến khi tan hết, cho chloral hydrate và để hỗn hợp hòa tan hoàn toàn. Cuối cùng cho glycerin vào hỗn hợp và khuấy đều.
Phụ lục 2.
Thông tin về dịch hại
1. Phân bố và ký chủ
- Phân bố: Bọ trĩ cam có phân bố ở châu Á (Yemen), châu Phi (Angola, Ai Cập, Cape Verde, Kenya, Malawi, Mauritius, Nigeria, Nam Phi, Senegal, Sudan, Swaziland, Tanzania, Uganda, Zimbabwe), Châu Úc (Úc).
- Ký chủ: Ký chủ chính của bọ trĩ cam là cây trồng thuộc giống Citrus (cam, chanh...), ngoài ra loài này còn gây hại trên xoài (Mangifera indica), chè (Camellia sinensis), chuối (Musa paradisiaca) và nhiều loại cây trồng khác.
2. Tên khoa học và vị trí phân loại
|
- Tên khoa học - Tên tiếng Việt - Tên khác - Vị trí phân loại |
: Scirtothrips aurantii Faure : Bọ trĩ cam : Scirtothrips acaciae Moulton : |
|
|
Ngành Lớp Bộ Họ Giống |
: Arthropoda : Insecta : Thysanoptera : Thripidae : Scirtothrips |
|
3. Đặc điểm chung của giống Scirtothrips:
Trưởng thành bọ trĩ giống Scirtothrips có các đặc điểm phân biệt với các giống khác thuộc họ Thripidae như sau:
- Ngực có nhiều lông cứng xếp thẳng hàng (Hình 1a).
- Phía mép các đốt bụng trước có nhiều lông nhỏ xếp song song thành hàng (Hình 1b).
- Phía giữa các đốt bụng sau có lông cứng.
- Phía mép trên ngực giữa có hai đôi lông cứng (Hình 1c).
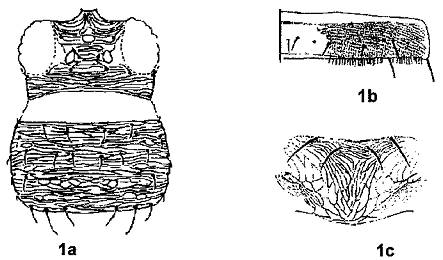
Hình 1. Đặc điểm giống Scritothrips (Nguồn: EPPO PM7/56)
4. Đặc điểm nhận dạng bọ trĩ cam (Scirtothrips aurantii Faure) - dịch hại kiểm dịch thực vật nhóm I của Việt Nam
- Trưởng thành cái:
+ Râu đầu có 8 đốt, 2 đốt cuối nhỏ, thót lại (Hình 2a).
+ Đôi lông III nằm dưới mắt đơn trên cùng, nằm trong hình tam giác nổi giữa 3 mắt đơn (Hình 2b).
+ Phía mép ngực giữa có hai đôi lông cứng (Hình 2c).
+ Trên đường vân thứ 2 của cánh trước có 3 lông cứng (Hình 2d).
+ Mép giữa các đốt bụng màu nâu đậm, xung quanh mép có các vệt màu nâu (Hình 2d).
+ Đốt bụng VIII có một hàng lông nhỏ song song chạy thành một đường liền giữa 2 mép ngoài (Hình 2e), ở đốt bụng IX không có hàng lông này.
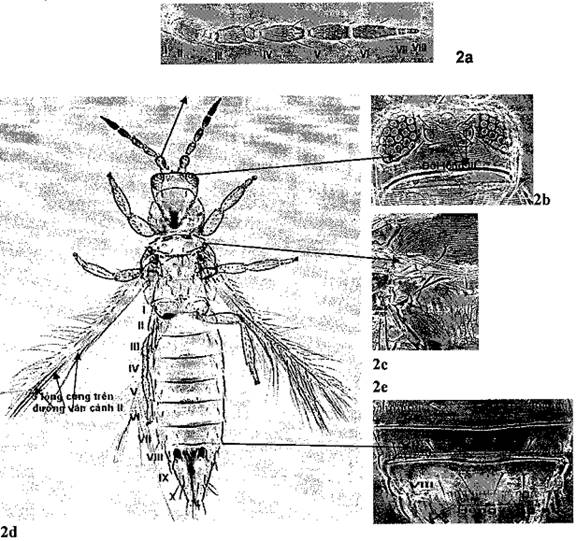
Hình 2. Trưởng thành cái Scritothrips aurantii
(Nguồn: EPPO PM7/56)
- Trưởng thành đực:
+ Đốt đùi chân sau có hàng lông cứng (Hình 3a).
+ Phía bên đốt bụng IX có một đôi lông cứng uốn cong, đậm màu (Hình 3b).
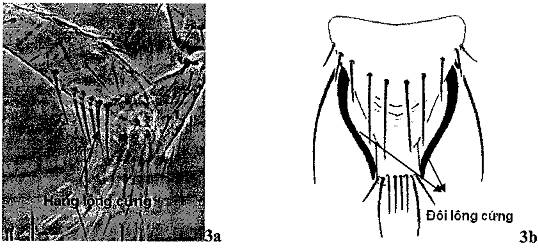
Hình 3. Trưởng thành đực Scirtothrips aurantii
(Nguồn: EPPO PM7/56)
Phụ lục 3.
(quy định)
Mẫu phiếu kết quả giám định
|
Cơ quan Bảo vệ |
CỘNG HÒA XÃ
HỘI CHỦ NGHĨA VIỆT NAM |
|
|
……….. ngày …. tháng …. năm 20….. |
PHIẾU KẾT QUẢ GIÁM ĐỊNH
Bọ trĩ cam (Scirtothrips aurantii Faure) là dịch hại kiểm dịch thực vật của Việt Nam
|
1. Tên hàng hóa |
: |
|
|
2. Nước xuất khẩu |
: |
|
|
3. Xuất xứ |
: |
|
|
4. Phương tiện vận chuyển |
: |
Khối lượng: |
|
5. Địa điểm lấy mẫu |
: |
|
|
6. Ngày lấy mẫu |
: |
|
|
7. Người lấy mẫu |
: |
|
|
8. Tình trạng mẫu |
: |
|
|
9. Ký hiệu mẫu |
: |
|
|
10. Số mẫu lưu |
: |
|
|
11. Người giám định |
: |
|
12. Phương pháp giám định: Theo quy chuẩn kỹ thuật quốc gia QCVN 01 - 162 : 2014/BNNPTNT về "Quy trình giám định bọ trĩ cam (Scirtothrips aurantii Faure) là dịch hại kiểm dịch thực vật của Việt Nam".
|
13. Kết quả giám định Tên khoa học Họ Bộ |
: : : Thripidae : Thysanoptera |
Là dịch hại kiểm dịch thực vật nhóm I thuộc danh mục dịch hại kiểm dịch thực vật của Việt Nam.
|
TRƯỞNG PHÒNG KỸ
THUẬT |
THỦ TRƯỞNG ĐƠN VỊ |
National technical regulation on Procedure for identification of Canada thistle [Cirsium arvense (L.) Scop.] - Plant quarantine pest of Vietnam
Lời nói đầu
QCVN 01 - 163 : 2014/BNNPTNT do Trung tâm Giám định biên soạn, Cục Bảo vệ thực vật trình duyệt, Bộ Nông nghiệp & PTNT ban hành tại Thông tư số 16/TT-BNNPTNT ngày 05 tháng 6 năm 2014.
QUY CHUẨN KỸ THUẬT QUỐC GIA VỀ QUY TRÌNH GIÁM ĐỊNH CÂY KẾ ĐỒNG [CIRSIUM ARVENSE (L.) SCOP.] LÀ DỊCH HẠI KIỂM DỊCH THỰC VẬT CỦA VIỆT NAM
National technical regulation on Procedure for identification of Canada thistle [Cirsium arvense (L.) Scop.] - Plant quarantine pest of Vietnam
I. QUY ĐỊNH CHUNG
1.1. Phạm vi điều chỉnh
Quy chuẩn này áp dụng thống nhất trên phạm vi toàn quốc cho việc giám định cây kế đồng [Cirsium arvense (L.) Scop.] là dịch hại kiểm dịch thực vật nhóm I của Việt Nam.
1.2. Đối tượng áp dụng
Quy chuẩn này áp dụng đối với mọi tổ chức, cá nhân của Việt Nam hoặc nước ngoài có hoạt động liên quan đến lĩnh vực bảo vệ và kiểm dịch thực vật (KDTV) tại Việt Nam thực hiện giám định cây kế đồng [Cirsium arvense (L.) Scop.] là dịch hại KDTV nhóm I thuộc Danh mục dịch hại KDTV của Việt Nam.
1.3. Giải thích từ ngữ
Những thuật ngữ trong quy chuẩn này được hiểu như sau:
1.3.1. Dịch hại kiểm dịch thực vật (plant quarantine pest)
Loài sinh vật gây hại có nguy cơ gây tác hại nghiêm trọng tài nguyên thực vật trong một vùng, mà ở đó loài sinh vật này chưa có mặt hoặc có mặt với phân bố hẹp và được kiểm soát chính thức.
1.3.2. Cỏ dại (weed)
Là những thực vật mọc lẫn với cây trồng, ngoài ý muốn của con người, tranh chấp nước, ánh sáng và các chất dinh dưỡng của cây trồng, ảnh hưởng đến sinh trưởng phát triển của cây, làm xấu đất, tăng chi phí sản xuất. Ngoài ra cỏ dại còn là ký chủ của nhiều côn trùng và bệnh gây hại cho cây trồng.
1.3.3. Mẫu (sample)
Là khối lượng thực vật, sản phẩm thực vật, tàn dư của sản phẩm thực vật hoặc đất được lấy ra theo một qui tắc nhất định.
1.3.4. Tiêu bản (specimen)
Là mẫu vật điển hình tiêu biểu của dịch hại được xử lý để dùng cho việc định loại, nghiên cứu, giảng dạy, phổ biến kỹ thuật và trưng bày thành các bộ sưu tập.
1.3.5. Rễ cây (root)
Là thành phần quan trọng của cơ quan sinh dưỡng ở dưới đất làm nhiệm vụ hấp thụ thức ăn trong đất, giữ cây đứng thẳng, đôi khi làm nhiệm vụ sinh sản, dự trữ và đồng hóa.
1.3.6. Căn hành (rhizome)
Là thân cây bò dài dưới mặt đất, có nhiều rễ ở các đoạn và có chồi ngọn.
1.3.7. Thân cây (stem)
Là bộ phận mang lá, là phần chính của cây, đứng trung gian giữa lá và rễ, lớn lên do chồi, làm nhiệm vụ nâng đỡ và dẫn nhựa theo hai chiều.
1.3.8. Lá cây (leaf)
Là cơ quan dinh dưỡng của thực vật, có chất diệp lục giữ chức năng quang hợp và thoát hơi nước.
1.3.9. Hoa (flower)
Là một cành đặc biệt, sinh sản có hạn, mang các lá, làm nhiệm vụ bảo vệ, hấp dẫn sâu bọ và sinh sản
1.3.10. Quả bế (achene)
Là dạng quả có vỏ cứng, khi chín không mở ra, quả khô nhỏ, có một hạt.
II. QUY ĐỊNH KỸ THUẬT
2.1. Phương pháp thu thập và bảo quản mẫu
2.1.1. Thu thập mẫu
- Đối với hàng hóa xuất, nhập khẩu, quá cảnh hoặc vận chuyển, bảo quản trong nước: Tiến hành lấy mẫu theo phương pháp lấy mẫu của tiêu chuẩn Việt Nam TCVN 4731:891 "Kiểm dịch thực vật - phương pháp lấy mẫu", quy chuẩn kỹ thuật quốc gia QCVN 01-21:2010/BNNPTNT1 "Phương pháp kiểm tra củ, quả xuất nhập khẩu và quá cảnh", QCVN 01-22:2010/BNNPTNT1 "Phương pháp kiểm tra cây xuất nhập khẩu và quá cảnh", QCVN 01-23:2010/BNNPTNT1 "Phương pháp kiểm tra các loại hạt xuất nhập khẩu và quá cảnh".
- Điều tra ngoài đồng ruộng: Điều tra và lấy mẫu theo phương pháp của Viện Bảo vệ thực vật về Phương pháp điều tra cơ bản dịch hại nông nghiệp và thiên địch của chúng (Phương pháp nghiên cứu Bảo vệ thực vật, tập 1, nhà xuất bản Nông nghiệp năm 1997.)
2.1.2. Bảo quản mẫu giám định
Mẫu giám định được bảo quản như sau:
- Tiêu bản ngâm: mẫu vật sau khi thu hái được ngâm trong dung dịch ngâm mẫu.
- Tiêu bản khô: Mẫu vật sau khi thu hái được ép, sấy, phơi rồi khâu dính trên giấy bìa.
- Tiêu bản hạt: Mẫu quả và hạt được phơi ngoài trời hoặc sấy khô trong tủ sấy nhưng tránh phơi trực tiếp dưới ánh sáng mặt trời hoặc sấy ở nhiệt độ quá cao; nhiệt độ thích hợp là duy trì ở 45oC - 60oC cho khô dần đến khi thủy phần hạt nhỏ hơn 13%, sau đó chuyển sang lọ nút mài kín để trong tủ định ôn hoặc phòng có máy hút ẩm.
2.2. Phương pháp làm tiêu bản giám định
2.2.1. Dụng cụ, hóa chất phục vụ làm tiêu bản và giám định
- Kính lúp soi nổi có độ phóng đại từ 10 - 60 lần.
- Lọ nút mài, đĩa petri, hộp tiêu bản, lọ ngâm mẫu, khung gỗ ép mẫu
- Bìa cứng, xốp, panh, bút lông, dao, kéo
- Hóa chất ngâm mẫu: CuSO4 dạng tinh thể, H2SO4 đậm đặc, Na2SO4 dạng tinh thể, H2SO3 đậm đặc, cồn 90%, cồn 70%, focmol, parafin.
2.2.2. Làm mẫu tiêu bản ngâm
Tiêu bản ngâm giám định được thực hiện với cây kế đồng (bao gồm toàn bộ cây và các bộ phận của cây như: rễ, thân, lá hoa, quả và hạt) theo phương pháp sau:
Mẫu cây cỏ thu được đem ngâm trong dung dịch CuSO4 10% trong 24 giờ. Sau đó vớt mẫu vật ra, ngâm rửa lại trong chậu nước sạch và ngâm lại vào dung dịch cố định. Gắn kín nắp lọ bằng parafin và cứ 6 tháng thay dung dịch một lần.
Dung dịch cố định: có thể sử dụng 1 trong 2 loại sau:
|
Dung dịch 1: |
8 ml H2SO4, 1 lít nước cất 10 gram Na2SO4 pha trong 50 ml nước cất |
|
Dung dịch 2: |
85 gram CuSO4 28,4 ml H2SO3 2485 ml nước cất |
2.2.3. Làm mẫu tiêu bản khô
Tiêu bản khô giám định được thực hiện với cây kế đồng (bao gồm toàn bộ cây và các bộ phận của cây như: rễ, thân, lá hoa, quả và hạt) theo phương pháp sau:
- Ép mẫu: Mẫu cây ngay sau khi thu hái phải vuốt phẳng, cố gắng giữ đúng hình dạng tự nhiên đặt vào giữa hai tờ báo trong khung kẹp ép. Các mẫu được ngăn cách bởi một bìa cứng thấm nước. Số lượng mẫu xếp ở mỗi kẹp tiêu bản chỉ vừa đủ để gấp cặp gỗ lại, buộc dây và đưa vào bàn ép. Bàn ép gồm hai mảnh gỗ dày, nặng, diện tích 40 x 60cm, bắt ốc vít ở 4 mép. Ép nặng khoảng 4 - 5 kg. Trong những ngày đầu mới ép phải thường xuyên thay giấy báo để tránh độ ẩm quá cao làm hỏng mẫu.
- Phơi, sấy mẫu: Phơi ngoài trời hoặc sấy khô trong tủ sấy nhưng tránh phơi trực tiếp dưới ánh sáng mặt trời hoặc sấy ở nhiệt độ quá cao; nhiệt độ thích hợp là duy trì ở 45oC - 60oC. Phần quả và hạt phơi sấy riêng.
- Khâu mẫu đã phơi, sấy khô vào giấy cứng để phục vụ việc quan sát và giám định.
2.3. Giám định
Quan sát, đo kích thước mẫu thu thập được và mẫu tiêu bản trên kính lúp soi nổi lần lượt đặc điểm các bộ phận sau:
- Rễ: Hình dạng, cấu tạo
- Thân: Chiều cao, cách phân nhánh, hình dạng, màu sắc.
- Lá: Cách sắp xếp, cách đính lá và hình dạng của lá.
- Hoa: Cấu tạo, hình dạng, kích thước, màu sắc.
- Quả bế (hạt): Kích thước, hình dạng, màu sắc của quả; kích thước, hình dạng, màu sắc của túm lông đầu.
2.4. Đối chiếu kết quả quan sát với đặc điểm hình thái của cây kế đồng [Cirsium arvense (L.) Scop.] (phụ lục 1)
Thông thường, số lượng cá thể nghiên cứu phải đảm bảo là 30 (n=30). Trong trường hợp số lượng cá thể ít hơn hoặc chỉ phát hiện duy nhất một cây trưởng thành có các đặc điểm nhận dạng như trên có thể cho phép kết luận là loài cây kế đồng [Cirsium arvense (L.) Scop.] [chỉ áp dụng đối với các đơn vị đã từng giám định được cây kế đồng [Cirsium arvense (L.) Scop.]
III. THẨM ĐỊNH KẾT QUẢ GIÁM ĐỊNH VÀ BÁO CÁO
Sau khi khẳng định kết quả giám định là cây kế đồng [Cirsium arvense (L.) Scop.] thuộc danh mục dịch hại KDTV nhóm I của Việt Nam, đơn vị giám định phải gửi báo cáo về Cục Bảo vệ thực vật kèm theo phiếu kết quả giám định (phụ lục 2).
Tất cả các đơn vị thuộc hệ thống Bảo vệ và KDTV phải lưu giữ, quản lý và khai thác dữ liệu về kết quả điều tra, báo cáo và giám định cây kế đồng.
Đối với đơn vị lần đầu tiên giám định và phát hiện được cây kế đồng phải gửi mẫu hoặc tiêu bản về Trung tâm Giám định kiểm dịch thực vật để thẩm định và báo cáo Cục Bảo vệ thực vật trước khi công bố và xử lý dịch theo quy định của pháp luật hiện hành.
Đơn vị giám định phải lưu mẫu theo Quy chuẩn kỹ thuật hiện hành về lưu giữ và bảo quản mẫu để giải quyết khiếu nại về kết quả giám định (nếu có).
IV. TỔ CHỨC THỰC HIỆN
Cục Bảo vệ thực vật có trách nhiệm phổ biến; tổ chức, hướng dẫn và kiểm tra việc thực hiện Quy chuẩn này trong hệ thống tổ chức chuyên ngành Bảo vệ và Kiểm dịch thực vật cũng như các tổ chức, cá nhân khác có liên quan;
Các tổ chức, cá nhân có hoạt động liên quan đến điều tra, thu thập mẫu, xử lý và bảo quản mẫu cây kế đồng [Cirsium arvense (L.) Scop.] tại Việt Nam phải tuân theo quy định của quy chuẩn này cũng như các quy định của pháp luật có liên quan hiện hành.
Phụ lục 1.
Thông tin về dịch hại
1. Phân bố
- Phân bố: Châu Âu (Albani, Áo, Belarus, Bỉ, Bungari, Rumani, Croatia, Cộng hòa Séc, Slovakia, Đan Mạch, Estonia, Pháp, Đức, Hungary, Italy, Latvia, Moldova, Hà Lan, Ba Lan, Tây Ban Nha, Bồ Đào Nha, Secbia, Thụy Điển, Thụy Sĩ, Ukraina, Liên bang Nga, Na Uy, Anh, Iceland, Ireland).
Châu Á (Afganistan, Acmenia, Aizecbaizan, Trung Quốc, Georgia, Ấn Độ, Iran, Nhật Bản, Hàn Quốc, Lebanon, Pakistan, Thổ Nhĩ Kỳ, Turkmenistan.)
Châu Phi (Angola, Nam Phi, Sudan, Swaziland, Tunisia, Zimbabwe.
Bắc Mỹ (Canada, Mexico, USA.). Nam Mỹ (Chile).
Châu Đại Dương (Australia, New Zealand).
2. Tên khoa học và vị trí phân loại
|
- Tên khoa học - Tên tiếng Việt - Tên khác |
: Cirsium arvense (L.) Scop. : Cây kế đồng : Cirsium incanum Bieb. Cirsium lanatum Spreng. Cnicus arvensis Hoffm. Cirsium setosum (Willd.) Bieb. |
- Vị trí phân loại:
|
Giới Ngành Lớp Bộ Họ Chi |
: Viridiplantae : Spermatophyta : Dicotyledonae : Asterales : Asteraceae : Cirsium |
3. Phương thức gây hại
- Phương thức gây hại: Loài Cirsium arvense (L.) Scop. cạnh tranh dinh dưỡng với cây trồng do bộ rễ và căn hành rất phát triển, tốc độ sinh trưởng nhanh, khả năng cạnh tranh lấn chiếm lớn làm ảnh hưởng đến năng suất và phẩm chất cây trồng. Lá cây có nhiều gai sắc nhọn gây ảnh hưởng đến đồng cỏ chăn nuôi gia súc.
4. Những cây trồng bị cạnh tranh
- Cây kế đồng cạnh tranh với rất nhiều loài cây trồng; những cây trồng quan trọng gồm: ngô, đậu Hà Lan, đậu tương, bông, lanh, kê, lúa miến, đại mạch, mạch ba góc, yến mạch, kiều mạch, lúa mạch đen, lúa mỳ, đậu, khoai tây, cà rốt...
5. Đặc điểm nhận dạng cây kế đồng [Cirsium arvense (L.) Scop.] - dịch hại kiểm dịch thực vật nhóm I của Việt Nam
- Cây kế đồng có hệ thống rễ sợi phát triển, ăn sâu từ 2 - 5 m. Căn hành (thân bò dài ở dưới mặt đất có nhiều rễ ở các đoạn và có chồi ngọn) màu trắng hoặc màu vàng nhạt bò lan rộng theo chiều ngang đến 5 m hoặc hơn.
- Thân thẳng, mảnh, có rãnh, màu xanh, phân nhánh, cao từ 30 - 150 cm. Khi còn non thân nhẵn hoặc có lông mỏng, càng lớn thân càng nhiều lông và nhiều chồi mọc lên từ căn hành.
- Lá mọc cách, không cuống; Hình dạng và cấu tạo lá cũng rất đa dạng thuôn hoặc hình mác, mép lá có thể nguyên hoặc xẻ thùy không đều và có gai cứng ở mép lá.
- Là cây phân tính, hoa đầu mọc thành cụm dạng ngù ở ngọn, có hoa đực và hoa cái mọc trên đầu riêng rẽ. Hoa rất nhiều, có từ 1-5 hoa trên mỗi nhánh, hoa đực dạng hình cầu, hoa cái dạng cái bình. Tổng bao cao 10-20 mm, có nhiều lá bắc xếp lợp, không có gai. Hoa dạng ống, màu hồng tía đến hồng nhạt hoặc trắng. Hoa cái dài 23 - 26 mm, ống hoa dài 20 - 23 mm, thùy 2 mm, nhụy phát triển, bao phấn tiêu giảm hoặc không có bao phấn. Hoa đực dài 12 - 14 mm, ống dài 7 - 8,5 mm, thùy 3 - 4 mm, có hoặc không có nhụy, bầu tiêu giảm, bao phấn dài 4 mm, hạt phấn có đường kính 42 - 44 mm.
- Quả bế thuôn dẹt, thẳng hoặc hơi cong, nhẵn bóng, có rãnh chạy dọc, ở giữa đỉnh của hạt lồi lên dạng hình chóp. Hạt dài 2,5 - 4 x 1 mm, màu vàng rơm, nâu sáng đến nâu tối. Đỉnh hạt có túm lông màu trắng nhưng đôi khi có màu nâu, dạng lông chim, dài 2 mm, dễ rụng.

Hình 1: Thân, lá, hoa, quả Cirsium arvense
(Nguồn: CABI, Crop Protection Compendium, 2007

Hình 2: Phân loại Cirsium arvense
(1. Rễ; 2. Tổng bao hoa; 3. Hoa; 4. Quả bế; 5. Cây non)
(Nguồn: The world's worst weed, LeRoy G. Holm, 1977)

Hình 3: Quả bế Cirsium arvense (hạt)
(Nguồn: An illustrated taxonomy manual of weed seeds, Richahrd J. Delorit, 1970)
Phụ lục 2.
(quy định)
Mẫu phiếu kết quả giám định
|
Cơ quan Bảo vệ |
CỘNG HÒA XÃ
HỘI CHỦ NGHĨA VIỆT NAM |
|
|
……….. ngày …. tháng …. năm 20….. |
PHIẾU KẾT QUẢ GIÁM ĐỊNH
Cây kế đồng [Cirsium arvense (L.) Scop.] là dịch hại kiểm dịch thực vật của Việt Nam
|
1. Tên hàng hóa |
: |
|
|
2. Nước xuất khẩu |
: |
|
|
3. Xuất xứ |
: |
|
|
4. Phương tiện vận chuyển |
: |
Khối lượng: |
|
5. Địa điểm lấy mẫu |
: |
|
|
6. Ngày lấy mẫu |
: |
|
|
7. Người lấy mẫu |
: |
|
|
8. Tình trạng mẫu |
: |
|
|
9. Ký hiệu mẫu |
: |
|
|
10. Số mẫu lưu |
: |
|
|
11. Người giám định |
: |
|
12. Phương pháp giám định: Theo quy chuẩn kỹ thuật quốc gia QCVN 01 - 163 : 2014/BNNPTNT về "Quy trình giám định Cây kế đồng [Cirsium arvense (L.) Scop.] là dịch hại kiểm dịch thực vật của Việt Nam".
13. Kết quả giám định
|
Tên khoa học Họ Bộ |
: Cirsium arvense (L.) Scop. : Asteraceae : Asterales |
Là dịch hại kiểm dịch thực vật nhóm I thuộc danh mục dịch hại kiểm dịch thực vật của Việt Nam.
|
TRƯỞNG PHÒNG KỸ
THUẬT |
THỦ TRƯỞNG ĐƠN VỊ |
National technical regulation on bio-efficacy against damping-off on cucumber of fungicides
Lời nói đầu
QCVN 01 - 164 : 2014/BNNPTNT do Trung tâm Kiểm định và Khảo nghiệm thuốc bảo vệ thực vật phía Bắc biên soạn, Cục Bảo vệ thực vật trình duyệt, Bộ Nông nghiệp & PTNT ban hành tại Thông tư số 16/TT-BNNPTNT ngày 05 tháng 6 năm 2014.
QUY CHUẨN KỸ THUẬT QUỐC GIA VỀ KHẢO NGHIỆM TRÊN ĐỒNG RUỘNG HIỆU LỰC PHÒNG TRỪ BỆNH CHẾT CÂY CON HẠI DƯA CHUỘT CỦA CÁC THUỐC TRỪ BỆNH
National technical regulation on bio-efficacy against damping-off on cucumber of fungicides
I. QUY ĐỊNH CHUNG
1.1. Phạm vi điều chỉnh
Quy chuẩn này quy định những nguyên tắc, nội dung và phương pháp chủ yếu để đánh giá hiệu lực phòng trừ bệnh chết cây con (Rhizoctonia solani Kuhn, Fusarium solani (Mart) Appel & Wollned-Emened Snyder & Hansen, Pythium spp., Phytophthora spp.) đối với cây dưa chuột của các loại thuốc trừ bệnh trên đồng ruộng.
1.2. Đối tượng áp dụng
Quy chuẩn này áp dụng cho các cơ quan, tổ chức thực hiện khảo nghiệm thuốc bảo vệ thực vật.
1.3. Giải thích từ ngữ
Những thuật ngữ trong quy chuẩn này được hiểu như sau:
1.3.1. Dịch hại
Là bất cứ loài, chủng hoặc biotype của tác nhân gây tổn hại thực vật, động vật hoặc hoặc gây bệnh cho thực vật hoặc sản phẩm thực vật (FAO, 1995; IPPC, 1997).
1.4. Điều kiện khảo nghiệm
Khảo nghiệm phải được tiến hành tại các cơ sở có đủ điều kiện theo quy định hiện hành về khảo nghiệm thuốc bảo vệ thực vật của Bộ Nông nghiệp và Phát triển nông thôn.
Khảo nghiệm được bố trí trên những ruộng dưa chuột thường bị bệnh chết cây con gây hại, tại các thời gian có điều kiện thuận lợi cho bệnh phát triển và ở các địa điểm đại diện cho các vùng sinh thái.
Điều kiện trồng trọt (đất, phân bón, giống cây trồng, mật độ trồng) phải đồng đều trên toàn khu khảo nghiệm và phù hợp với tập quán canh tác tại địa phương.
Các khảo nghiệm trên diện hẹp và diện rộng phải được tiến hành ở ít nhất 2 vùng sản xuất nông nghiệp (phía Bắc và phía Nam) đại diện cho khu vực sản xuất.
Trong thời gian khảo nghiệm không được dùng bất kỳ một loại thuốc trừ bệnh khác trên khu khảo nghiệm (bao gồm cả các công thức và dải phân cách). Nếu khu khảo nghiệm bắt buộc phải sử dụng thuốc để trừ các đối tượng gây hại khác như: sâu, cỏ dại, điều hòa sinh trưởng... thì thuốc được dùng để trừ các đối tượng này phải không làm ảnh hưởng đến thuốc cần khảo nghiệm, không làm ảnh hưởng đến đối tượng khảo nghiệm và phải được phun rải đều trên tất cả các ô khảo nghiệm, kể cả ô đối chứng. Các trường hợp trên (nếu có) phải được ghi chép lại.
Khi xử lý thuốc không để thuốc ở ô khảo nghiệm này tạt sang ô khảo nghiệm khác.
II. QUY ĐỊNH KỸ THUẬT
2.1. Phương pháp khảo nghiệm
2.1.1. Bố trí công thức khảo nghiệm
Khảo nghiệm được bố trí theo phương pháp khối ngẫu nhiên đầy đủ hoặc theo các phương pháp khác đã được quy định trong phương pháp thí nghiệm trên đồng ruộng.
Mỗi khảo nghiệm phải thực hiện theo các công thức sau:
Công thức khảo nghiệm là công thức dùng các loại thuốc khảo nghiệm ở các nồng độ, liều lượng khác nhau hoặc cách dùng khác nhau.
Công thức so sánh là công thức dùng một loại thuốc trừ bệnh chết cây con đã được đăng ký trong danh mục thuốc bảo vệ thực vật được phép sử dụng ở Việt Nam và đang được dùng phổ biến, có hiệu quả ở địa phương để trừ bệnh chết cây con hại dưa chuột.
Công thức đối chứng là công thức không dùng bất kỳ loại thuốc bảo vệ thực vật nào để phòng trừ bệnh chết cây con. Với khảo nghiệm là thuốc phun: công thức đối chứng được phun bằng nước lã.
2.1.2. Diện tích ô khảo nghiệm và số lần nhắc lại
Khảo nghiệm diện hẹp: Diện tích của mỗi ô khảo nghiệm từ 30 m2 - 50 m2, số lần nhắc lại 3 - 4 lần.
Khảo nghiệm diện rộng: Diện tích của mỗi ô khảo nghiệm từ 300 m2 - 500 m2, không nhắc lại.
Các ô khảo nghiệm phải có dạng hình vuông hay hình chữ nhật nhưng chiều dài phải không vượt quá hai lần chiều rộng.
Giữa các công thức khảo nghiệm phải có dải phân cách ít nhất là 1 luống dưa chuột.
2.2. Tiến hành xử lý thuốc
2.2.1. Lượng thuốc và lượng nước thuốc sử dụng
Lượng thuốc dùng được tính bằng kg hoặc lít chế phẩm hoặc gam hoạt chất trên đơn vị diện tích 1 ha.
Với dạng thuốc thương phẩm pha với nước để phun: Lượng nước dùng phải theo hướng dẫn cụ thể đối với từng loại thuốc, phù hợp với từng giai đoạn sinh trưởng của cây dưa chuột cũng như cách thức tác động của từng loại thuốc. Trong trường hợp không có khuyến cáo của các tổ chức cá nhân đăng ký về lượng nước thuốc, lượng nước thuốc thường dùng từ 400 - 500 lít/ha.
2.2.2. Dụng cụ xử lý thuốc
Dụng cụ xử lý thuốc: Bình bơm động cơ, bình bơm tay đeo vai, cốc đong, cân, pipet...
Khi xử lý thuốc, phải dùng các dụng cụ phun, rải thuốc thích hợp đảm bảo yêu cầu của khảo nghiệm, ghi chép đầy đủ tình hình vận hành của dụng cụ phun rải thuốc để đảm bảo yêu cầu kỹ thuật.
2.2.3. Thời điểm và số lần xử lý thuốc
Thời điểm và số lần xử lý thuốc thực hiện đúng theo hướng dẫn sử dụng của nhà sản xuất và đăng ký.
Khi không có khuyến cáo cụ thể thời điểm xử lý thuốc thì tùy theo mục đích khảo nghiệm, các đặc tính hóa học, phương thức tác động của thuốc và đặc điểm sinh trưởng của cây dưa chuột thì số lần xử lý từ 1-2 lần cách nhau 7 ngày. Xử lý lần đầu khi tỷ lệ bệnh khoảng 5%.
2.3. Điều tra và thu thập số liệu
2.3.1. Chỉ tiêu, phương pháp và thời điểm điều tra
2.3.1.1. Chỉ tiêu điều tra
|
Tỷ lệ cây chết (%) = |
Số cây bị chết |
x 100 |
|
Tổng số cây điều tra |
2.3.1.2. Phương pháp điều tra
Mỗi ô chọn 5 điểm nằm trên 2 đường chéo góc (đối với khảo nghiệm diện hẹp) và 10 điểm (đối với khảo nghiệm diện rộng), mỗi điểm điều tra 20 cây các điểm này nằm cách mép ô khảo nghiệm ít nhất 1 hàng dưa chuột.
2.3.1.3. Thời điểm điều tra
Thời điểm và số lần điều tra ngay trước mỗi lần xử lý thuốc và 7, 14 ngày sau xử lý thuốc lần cuối.
2.3.1.4. Xử lý số liệu
Hiệu lực phòng trừ của thuốc trừ bệnh chết cây con hại cây dưa chuột được đánh giá qua tỷ lệ cây bị chết tại các lần điều tra.
Các số liệu của khảo nghiệm diện hẹp phải được xử lý bằng các phương pháp thống kê thích hợp.
2.3.1.5. Đánh giá tác động của thuốc đến cây dưa chuột
Đánh giá mọi ảnh hưởng tốt, xấu của thuốc (nếu có) đến sự sinh trưởng và phát triển của cây dưa chuột theo thang phân cấp (phụ Iục 1).
Phương pháp đánh giá:
Những chỉ tiêu nào đo đếm được phải biểu thị bằng các số liệu cụ thể theo các phương pháp điều tra phù hợp.
Các chỉ tiêu đánh giá được bằng mắt như độ cháy lá, quăn lá, sự thay đổi màu sắc lá ... thì phải được mô tả.
Nếu thuốc làm ảnh hưởng đến sinh trưởng, phát triển cây dưa chuột phải theo dõi và ghi nhận ngày cây phục hồi trở lại.
2.3.1.6. Quan sát và ghi chép về thời tiết
Ghi chép các số liệu về nhiệt độ, ẩm độ, lượng mưa trong suốt thời gian khảo nghiệm theo số liệu thời tiết tại trạm khí tượng gần nhất.
III. QUY ĐỊNH VỀ QUẢN LÝ THỰC HIỆN
3.1. Báo cáo và công bố kết quả
3.1.1. Đánh giá mức độ độc của thuốc đối với cây trồng (Phụ lục 1)
3.1.2. Nội dung báo cáo (Phụ lục 2)
3.2. Tổ chức quản lý, thực hiện
Đơn vị thực hiện khảo nghiệm phải hoàn toàn chịu trách nhiệm về số liệu đưa ra trong báo cáo và có trách nhiệm lưu giữ số liệu thô của khảo nghiệm.
Căn cứ yêu cầu quản lý, Cục Bảo vệ thực vật có trách nhiệm kiến nghị Bộ Nông nghiệp và Phát triển nông thôn sửa đổi, bổ sung quy chuẩn này khi cần thiết.
Phụ lục 1.
Bảng phân cấp mức độ độc của thuốc khảo nghiệm đối với cây trồng
|
Cấp 1 2 3 4 5 6 7 8 9 |
Triệu chứng nhiễm độc Cây chưa có biểu hiện ngộ độc. Ngộ độc nhẹ, sinh trưởng của cây giảm nhẹ. Có triệu chứng ngộ độc nhẹ nhìn thấy bằng mắt. Triệu chứng ngộ độc nhưng chưa ảnh hưởng đến năng suất. Cành lá biến màu hoặc cháy, thuốc gây ảnh hưởng đến năng suất. Thuốc làm giảm năng suất ít. Thuốc gây ảnh hưởng nhiều đến năng suất. Triệu chứng ngộ độc tăng dần tới làm chết cây. Cây bị chết hoàn toàn. |
Nếu cây bị ngộ độc thuốc, cần xác định bao nhiêu ngày sau thì cây phục hồi.
Phụ lục 2.
Nội dung chính báo cáo khảo nghiệm
1. Tên khảo nghiệm.
2. Yêu cầu của khảo nghiệm.
3. Điều kiện khảo nghiệm:
- Đơn vị khảo nghiệm.
- Tên cán bộ tiến hành khảo nghiệm
- Thời gian khảo nghiệm.
- Địa điểm khảo nghiệm.
- Nội dung khảo nghiệm.
- Đặc điểm khảo nghiệm.
- Đặc điểm đất đai, canh tác, giống cây trồng...
- Đặc điểm thời tiết trong quá trình khảo nghiệm.
- Tình hình phát sinh và phát triển của bệnh hại cây trồng trong khu thí nghiệm.
4. Phương pháp khảo nghiệm:
- Công thức khảo nghiệm.
- Phương pháp bố trí khảo nghiệm.
- Số lần nhắc lại.
- Kích thước ô khảo nghiệm.
- Dụng cụ phun, rải thuốc.
- Lượng thuốc dùng nồng độ %, kg, lít thuốc thương phẩm/ha hay g (kg) hoạt chất/ha.
- Lượng nước thuốc dùng (l/ha).
- Ngày xử lý thuốc.
- Phương pháp điều tra và đánh giá hiệu lực của các loại thuốc khảo nghiệm.
5. Kết quả khảo nghiệm:
- Các bảng số liệu.
- Đánh giá hiệu lực của từng loại thuốc.
- Nhận xét tác động của từng loại thuốc đến cây trồng, sinh vật có ích và các ảnh hưởng khác (xem phụ lục).
6. Kết luận: Nhận xét về hiệu lực và ảnh hưởng của thuốc khảo nghiệm đối với cây trồng phải căn cứ vào số liệu thu được.
National technical regulation on Procedure for identification of Witchweeds (Striga genus) - Plant quarantine pests of Vietnam
Lời nói đầu
QCVN 01 - 165 : 2014/BNNPTNT do Trung tâm Kiểm dịch thực vật biên soạn, Cục Bảo vệ thực vật trình duyệt, Bộ Nông nghiệp & PTNT ban hành tại Thông tư số 16/TT-BNNPTNT ngày 05 tháng 6 năm 2014.
QUY CHUẨN KỸ THUẬT QUỐC GIA VỀ QUY TRÌNH GIÁM ĐỊNH CỎ MA KÝ SINH THUỘC CHI STRIGA LÀ DỊCH HẠI KIỂM DỊCH THỰC VẬT CỦA VIỆT NAM
National technical regulation on Procedure for identification of Witchweeds (Striga genus) - Plant quarantine pests of Vietnam
I. QUY ĐỊNH CHUNG
1.1. Phạm vi điều chỉnh
Quy chuẩn này áp dụng thống nhất trên phạm vi toàn quốc cho việc giám định các loài cỏ ma ký sinh thuộc chi Striga là dịch hại kiểm dịch thực vật nhóm I và nhóm II của Việt Nam.
1.2. Đối tượng áp dụng
Quy chuẩn này áp dụng đối với mọi tổ chức, cá nhân của Việt Nam hoặc nước ngoài có hoạt động liên quan đến lĩnh vực bảo vệ và kiểm dịch thực vật (KDTV) tại Việt Nam thực hiện giám định cỏ ma ký sinh thuộc chi Striga là dịch hại KDTV nhóm I và nhóm II thuộc Danh mục dịch hại KDTV của Việt Nam.
1.3. Giải thích từ ngữ
Những thuật ngữ trong quy chuẩn này được hiểu như sau:
1.3.1. Dịch hại kiểm dịch thực vật (plant quarantine pest)
Loài sinh vật gây hại có nguy cơ gây tác hại nghiêm trọng tài nguyên thực vật trong một vùng, mà ở đó loài sinh vật này chưa có mặt hoặc có mặt với phân bố hẹp và được kiểm soát chính thức.
1.3.2. Cỏ dại (weed)
Là những thực vật mọc lẫn với cây trồng, ngoài ý muốn của con người, tranh chấp nước, ánh sáng và các chất dinh dưỡng của cây trồng, ảnh hưởng đến sinh trưởng phát triển của cây, làm xấu đất, tăng chi phí sản xuất. Ngoài ra cỏ dại còn là ký chủ của nhiều côn trùng và bệnh gây hại cho cây trồng.
1.3.3. Thực vật ký sinh (parasitic plant)
Là những thực vật sống phụ thuộc một phần hoặc hoàn toàn vào những thực vật khác.
1.3.4. Thực vật bán ký sinh (semi- parasitic plant)
Là những thực vật chỉ sống ký sinh một phần, có quá trình quang hợp và có khả năng tự tổng hợp chất diệp lục.
1.3.5. Ký chủ (host)
Là những thực vật cung cấp một phần hay toàn bộ chất dinh dưỡng đảm bảo sự tồn tại, sinh trưởng, phát triển của thực vật ký sinh.
1.3.6. Mẫu (sample)
Là khối lượng thực vật, sản phẩm thực vật, tàn dư của sản phẩm thực vật hoặc đất được lấy ra theo một qui tắc nhất định.
1.3.7. Tiêu bản (specimen)
Là mẫu vật điển hình tiêu biểu của dịch hại được xử lý để dùng cho việc định loại, nghiên cứu, giảng dạy, phổ biến kỹ thuật và trưng bày thành các bộ sưu tập.
II. QUY ĐỊNH KỸ THUẬT
2.1. Phương pháp thu thập và bảo quản mẫu
2.1.1. Thu thập mẫu
- Đối với hàng hóa xuất, nhập khẩu, quá cảnh hoặc vận chuyển, bảo quản trong nước: Tiến hành lấy mẫu theo tiêu chuẩn Việt Nam TCVN 4731:891 "Kiểm dịch thực vật - phương pháp lấy mẫu", quy chuẩn kỹ thuật quốc gia QCVN 01-21:2010/BNNPTNT1 "Phương pháp kiểm tra củ, quả xuất nhập khẩu và quá cảnh", QCVN 01-22:2010/BNNPTNT1 "Phương pháp kiểm tra cây xuất nhập khẩu và quá cảnh", QCVN 01-23:2010/BNNPTN1 "Phương pháp kiểm tra các loại hạt xuất nhập khẩu và quá cảnh".
- Đối với cây trồng ngoài đồng ruộng: Lấy mẫu trên những cây trồng là ký chủ của các loài cỏ ma theo phương pháp của Quy chuẩn kỹ thuật quốc gia QCVN 01-38/2010/BNNPTNT1 "Phương pháp điều tra phát hiện dịch hại cây trồng".
2.1.2. Bảo quản mẫu giám định
Mẫu giám định được bảo quản như sau:
- Tiêu bản ngâm: mẫu vật sau khi thu hái được ngâm trong dung dịch ngâm mẫu.
- Tiêu bản khô: Mẫu vật sau khi thu hái được ép, sấy, phơi rồi khâu dính trên giấy bìa.
- Tiêu bản hạt: Mẫu quả và hạt được phơi, sấy ngoài trời hoặc sấy khô trong tủ sấy nhưng tránh phơi trực tiếp dưới ánh sáng mặt trời hoặc sấy ở nhiệt độ quá cao; nhiệt độ thích hợp là duy trì ở 45oC - 60oC cho khô dần đến khi thủy phần hạt nhỏ hơn 13%, sau đó chuyển sang lọ nút mài kín để trong tủ định ôn hoặc phòng có máy hút ẩm.
2.2. Phương pháp làm tiêu bản mẫu giám định
2.2.1. Dụng cụ, hóa chất phục vụ làm tiêu bản và giám định
- Kính lúp soi nổi có độ phóng đại từ 10 - 70 lần.
- Lọ nút mài, đĩa petri, hộp tiêu bản, lọ ngâm mẫu, khung gỗ ép mẫu
- Bìa cứng, xốp, panh, bút lông, dao, kéo
- Hóa chất ngâm mẫu: CuSO4 tinh thể, H2SO4 đậm đặc, Na2SO4 tinh thể, H2SO3 đậm đặc, cồn 90%, cồn 70%, focmol, parafin.
2.2.2. Làm mẫu tiêu bản ngâm
Tiêu bản giám định được thực hiện với các loài cỏ ma (bao gồm toàn bộ cây và các bộ phận của cây như: rễ, thân, lá hoa, quả và hạt) theo phương pháp sau:
Mẫu cây cỏ thu được đem ngâm trong dung dịch CuSO4 10% trong 24 giờ. Sau đó vớt mẫu vật ra, ngâm rửa lại trong chậu nước sạch và ngâm lại vào dung dịch cố định. Gắn kín nắp lọ bằng parafin và cứ 6 tháng thay dung dịch một lần.
Dung dịch cố định: có thể sử dụng 1 trong 2 loại sau
|
Dung dịch 1: |
8 ml H2SO4 1 lít nước cất 10 gram Na2SO4 pha trong 50 ml nước cất |
|
Dung dịch 2: |
85 gram CuSO4 28,4 ml H2SO3 2485 ml nước cất |
2.2.3. Làm mẫu tiêu bản khô
Tiêu bản giám định được thực hiện với các loài cỏ ma (bao gồm toàn bộ cây và các bộ phận của cây như: rễ, thân, lá hoa, quả và hạt) theo phương pháp sau:
- Ép mẫu: Mẫu cây ngay sau khi thu hái phải vuốt phẳng, cố gắng giữ đúng hình dạng tự nhiên đặt vào giữa hai tờ báo trong khung kẹp ép. Các mẫu được ngăn cách bởi một bìa cứng thấm nước. Số lượng mẫu xếp ở mỗi kẹp tiêu bản chỉ vừa đủ để gấp cặp gỗ lại, buộc dây và đưa vào bàn ép. Bàn ép gồm hai mảnh gỗ dày, nặng, diện tích 40 x 60cm, bắt ốc vít ở 4 mép. Ép nặng khoảng 4 - 5 kg. Trong những ngày đầu mới ép phải thường xuyên thay giấy báo để tránh độ ẩm quá cao làm hỏng mẫu.
- Phơi, sấy mẫu: Phơi ngoài trời hoặc sấy khô trong tủ sấy nhưng tránh phơi trực tiếp dưới ánh sáng mặt trời hoặc sấy ở nhiệt độ quá cao; nhiệt độ thích hợp là duy trì ở 45oC - 60oC. Phần quả và hạt phơi sấy riêng
- Khâu mẫu đã phơi, sấy khô vào giấy cứng để phục vụ việc quan sát và giám định. Quả và hạt cho vào túi nilon nhỏ và đính vào bên cạnh mẫu.
2.3. Giám định
Quan sát, đo kích thước mẫu thu thập được và mẫu tiêu bản trên kính lúp soi nổi lần lượt đặc điểm các bộ phận sau:
- Rễ: Hình dạng, cấu tạo
- Thân: Chiều cao, cách phân nhánh, hình dạng, màu sắc.
- Lá: Cách sắp xếp, cách đính lá và hình dạng của lá
- Hoa: Cấu tạo, hình dạng, kích thước, màu sắc
- Quả: Kích thước, hình dạng, màu sắc của quả.
- Hạt: Kích thước, hình dạng, màu sắc của hạt.
2.4. Đối chiếu kết quả quan sát với đặc điểm hình thái của các loài cỏ ma ký sinh thuộc chi Striga là dịch hại kiểm dịch thực vật nhóm I và nhóm II của Việt Nam (phụ lục 1).
Thông thường, số lượng cá thể nghiên cứu phải đảm bảo là 30 (n=30). Trong trường hợp số lượng cá thể ít hơn hoặc chỉ phát hiện duy nhất một cây trưởng thành có các đặc điểm nhận dạng như trên có thể cho phép kết luận là loài cỏ ma ký sinh thuộc chi Striga là dịch hại kiểm dịch thực vật của Việt Nam [chỉ áp dụng đối với các đơn vị đã từng giám định được loài cỏ ma ký sinh thuộc chi Striga là dịch hại kiểm dịch thực vật của Việt Nam].
III. THẨM ĐỊNH KẾT QUẢ GIÁM ĐỊNH VÀ BÁO CÁO
Sau khi khẳng định kết quả giám định là loài cỏ ma ký sinh thuộc chi Striga là dịch hại kiểm dịch thực vật của Việt Nam, đơn vị giám định phải gửi báo cáo về Cục Bảo vệ thực vật kèm theo phiếu kết quả giám định (phụ lục 2).
Tất cả các đơn vị thuộc hệ thống Bảo vệ và KDTV phải lưu giữ, quản lý và khai thác dữ liệu về kết quả điều tra, báo cáo và giám định loài cỏ ma ký sinh thuộc chi Striga là dịch hại kiểm dịch thực vật của Việt Nam.
Đối với đơn vị lần đầu tiên giám định và phát hiện được loài cỏ ma ký sinh thuộc chi Striga là dịch hại kiểm dịch thực vật của Việt Nam phải gửi mẫu hoặc tiêu bản về Trung tâm Giám định kiểm dịch thực vật để thẩm định và báo cáo Cục Bảo vệ thực vật trước khi công bố và xử lý dịch theo quy định của pháp luật hiện hành.
Đơn vị giám định phải lưu mẫu theo Quy chuẩn kỹ thuật hiện hành về thời gian để giải quyết khiếu nại về kết quả giám định (nếu có).
IV. TỔ CHỨC THỰC HIỆN
Cục Bảo vệ thực vật có trách nhiệm phổ biến; tổ chức, hướng dẫn và kiểm tra việc thực hiện Quy chuẩn này trong hệ thống tổ chức chuyên ngành Bảo vệ và Kiểm dịch thực vật cũng như các tổ chức, cá nhân khác có liên quan;
Các tổ chức, cá nhân có hoạt động liên quan đến điều tra, thu thập mẫu, xử lý và bảo quản mẫu loài cỏ ma ký sinh thuộc chi Striga là dịch hại kiểm dịch thực vật của Việt Nam tại Việt Nam phải tuân theo quy định của quy chuẩn này cũng như các quy định của pháp luật có liên quan hiện hành.
Phụ lục 1.
Thông tin về dịch hại
1. Loài Striga hermonthica (Del.) Benth.(1836)
1.1. Phân bố
Châu Á: Cam-pu-chia, Ả rập-xê-út, Syria, Yemen
Châu Phi: Ăng-go-la, Be-nin, Bu-ki-na Fa-so, Burundi, Ca-mơ-run, Cộng hòa Trung Phi, Chad, Công gô, Ai cập, Ethiopia, Gambia, Ghana, Guinea Bissau, Guinea, Kenya, Madagascar, Malawi, Mali, Mauritania, Morocco, Mozambique, Namibia, Niger, Nigeria, Rwanda, Senegal, Nam Phi, Sudan, Swaziland, Tazania, Togo, Uganda, Zambia, Zimbabwe
1.2. Tên khoa học và vị trí phân loại
|
- Tên khoa học - Tên tiếng Việt - Tên khác |
: Striga hermonthica (Del.) Benth. : Cỏ ma ký sinh Ai Cập : Buchnera hermontheca Del. Striga senegalensis Benth. |
- Vị trí phân loại:
|
Giới Ngành Lớp Bộ Họ Chi |
: Viridiplantae : Spermatophyta : Dicotyledonae : Scrophulariales : Scrophulariaceae : Striga |
1.3. Phương thức gây hại
Sau khi nảy mầm, rễ ký sinh hình thành các lông hút để tiếp xúc và xâm nhập vào rễ ký chủ, hình thành các rễ mút (đỉnh rễ) phát triển tiến dần vào tới mô mạch của ký chủ. Cây ký sinh hút đường, nước, các amino axít và muối khoáng từ ký chủ để phát triển thông qua hệ thống rễ. Khi còn ở dưới mặt đất, việc hấp thụ dinh dưỡng của cây ký sinh hoàn toàn phụ thuộc vào cây ký chủ. Khi cây ký sinh mọc lên khỏi mặt đất, có ánh sáng mặt trời, diệp lục được hình thành (lá xanh phát triển), quá trình quang hợp bắt đầu xảy ra, nhưng hiệu quả chỉ bằng khoảng 20%, do đó cây ký sinh vẫn sống dựa vào ký chủ trong suốt quá trình sinh trưởng và phát triển của nó.
1.4. Ký chủ
- Ký chủ gồm các loài: cỏ, kê, mía, ngô, cao lương, lúa miến, kê chân vịt...
1.5. Đặc điểm nhận dạng cỏ ma ký sinh Ai Cập [Striga hermonthica (Del.) Benth.] - dịch hại kiểm dịch thực vật nhóm I của Việt Nam
- Rễ kém phát triển, hình thành các vòi hút, giác bám ăn sâu vào rễ ký chủ.
- Là cây thân thảo, cao từ 15 - 100 cm, phân nhánh, có lông.
- Lá ở dưới mọc đối, lá ở trên mọc cách, hình mác hoặc hình elip, dài 2 - 8 cm, rộng đến 1 cm.
- Hoa mọc ở đầu của nhánh, không cuống. Lá bắc dài 1 - 2 cm, rộng 3 mm. Đài hình ống, dài đến 1 cm, có 5 gân, đài có 5 răng dài 2 - 3 mm. Tràng có 4 thùy, màu hồng với những chấm trắng ở họng. Nhị và nhụy khuất trong ống tràng. Mỗi nhánh có thể sinh ra hàng trăm hoa nhưng chỉ có 6-10 hoa nở cùng lúc.
- Quả nang dài đến 1 cm, chứa hàng trăm hạt rất nhỏ.
- Hạt dài khoảng 0,3 mm, rộng 0,2 mm.

Hình 1: Cây cỏ ma Striga hermonthica gây hại trên lúa miến
(Nguồn: CABI, Crop Protection Compendium, 2007)
Hình 2: Ngọn cỏ ma Striga hermonthica mang hoa
(Nguồn: CABI, Crop Protection Compendium, 2007)
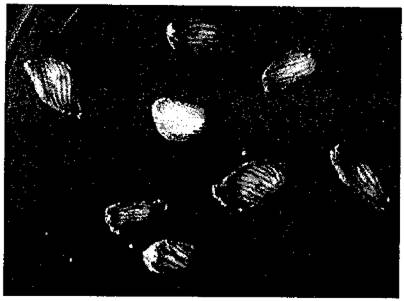
Hình 3: Hạt cỏ ma Striga hermonthica
(Nguồn: CABI, Crop Protection Compendium, 2007)
2. Loài Striga densiflora (Benth.) Benth.
2.1. Phân bố
Châu Phi: Nigieria, South Africa, Zimbabwe
Châu Á: Bangladesh, Trung Quốc, Yunnan, Ấn Độ, Gujarat, Karnataka, Maharashtra, Rajasthan, Tamil Nadu, Uttar Pradesh, Indonesia, Oman, Pakistan
2.2. Tên khoa học và vị trí phân loại
|
- Tên khoa học - Tên tiếng Việt - Tên khác |
: Striga densifiora (Benth.) Benth. : Cỏ ma ký sinh S.d : Buchnera densiflora Benth. |
- Vị trí phân loại:
|
Giới Ngành Lớp Bộ Họ Chi |
: Viridiplantae : Spermatophyta : Dicotyledonae : Scrophulariales : Scrophulariaceae : Striga |
2.3. Phương thức gây hại
Sau khi nảy mầm, rễ ký sinh hình thành các lông hút để tiếp xúc và xâm nhập vào rễ ký chủ, hình thành các rễ mút (đỉnh rễ) phát triển tiến dần vào tới mô mạch của ký chủ. Cây ký sinh hút đường, nước, các amino axít và muối khoáng từ ký chủ để phát triển thông qua hệ thống rễ. Khi còn ở dưới mặt đất, việc hấp thụ dinh dưỡng của cây ký sinh hoàn toàn phụ thuộc vào cây ký chủ. Khi cây ký sinh mọc lên khỏi mặt đất, có ánh sáng mặt trời, diệp lục được hình thành (lá xanh phát triển), quá trình quang hợp bắt đầu xảy ra, nhưng hiệu quả chỉ bằng khoảng 20%, do đó cây ký sinh vẫn sống dựa vào ký chủ trong suốt quá trình sinh trưởng và phát triển của nó.
2.4. Ký chủ
- Ký chủ gồm các loài: cỏ, kê, mía, ngô, lúa miến.
2.5. Đặc điểm nhận dạng cỏ ma ký sinh S.d [Striga densiflora (Benth.) Benth.] - dịch hại kiểm dịch thực vật nhóm I của Việt Nam
- Rễ kém phát triển, hình thành các vòi hút, giác bám ăn sâu vào rễ ký chủ.
- Thân cao khoảng 30 cm, thẳng, ít phân nhánh.
- Lá hẹp (rộng hơn lá của loài S. asiatica), có lông, cong ở phía dưới.
- Hoa tập trung ở đầu nhánh; lá bắc dài hơn đài. Đài dài 5 - 6 cm, có 5 gân; thùy đài dài gần bằng ống đài. Hoa màu trắng hơi xanh, dài khoảng 1 cm. Bao phấn màu xanh đen. Đài dài 6 mm, có 5 gân.
- Quả nang thuôn dài, dài khoảng 5 mm, chứa vài trăm hạt.
- Hạt có kích thước 0,2 x 0,3 mm.

Hình 4: Cây cỏ ma Striga densiflora (Benth.) Benth. (bên trái)
(Nguồn: CABI, Crop Protection Compendium, 2007)

Hình 5 : Phần ngọn cỏ ma Striga densiflora mang hoa
(Nguồn: CABI, Crop Protection Compendium, 2007)
3. Loài Striga angustifolia (Don.) Saldanha
3.1. Phân bố
Châu Á: Bangladesh, Bhutan, Trung Quốc, Ấn Độ, Indonesia, Myanmar, Nepal, Oman, Pakistan, Sri Lanka, Việt Nam.
Châu Phi: Ethiopia, Malawi, Mozambique, Nam Phi, Swaziland, Tazania, Zambia, Zimbabwe.
3.2. Tên khoa học và vị trí phân loại
|
- Tên khoa học - Tên tiếng Việt - Tên khác |
: Striga angustifolia (Don.) Saldanha : Cỏ ma ký sinh S.a : Buchnera angustifolia Benth. Buchnera euphrasioides Benth. Striga euphrasioides (Benth) Benth. |
- Vị trí phân loại:
|
Giới Ngành Lớp Bộ Họ Chi |
: Viridiplantae : Spermatophyta : Dicotyledonae : Scrophulariales : Scrophulariaceae : Striga |
3.3. Phương thức gây hại
Sau khi nảy mầm, rễ ký sinh hình thành các lông hút để tiếp xúc và xâm nhập vào rễ ký chủ, hình thành các rễ mút (đỉnh rễ) phát triển tiến dần vào tới mô mạch của ký chủ. Cây ký sinh hút đường, nước, các amino axít và muối khoáng từ ký chủ để phát triển thông qua hệ thống rễ. Khi còn ở dưới mặt đất, việc hấp thụ dinh dưỡng của cây ký sinh hoàn toàn phụ thuộc vào cây ký chủ. Khi cây ký sinh mọc lên khỏi mặt đất, có ánh sáng mặt trời, diệp lục được hình thành (lá xanh phát triển), quá trình quang hợp bắt đầu xảy ra, nhưng hiệu quả chỉ bằng khoảng 20%, do đó cây ký sinh vẫn sống dựa vào ký chủ trong suốt quá trình sinh trưởng và phát triển của nó.
3.4. Ký chủ
- Ký chủ gồm các loài: lúa gạo, mía, lúa miến.
3.5. Đặc điểm nhận dạng cỏ ma ký sinh S.a [Striga angustifolia (Don.) Saldanha] - dịch hại kiểm dịch thực vật nhóm II của Việt Nam
- Thân thảo, thẳng, gần vuông, có gai (ráp), cao từ 15 - 45 cm, phân nhánh hoặc không phân nhánh ở nửa trên của cây.
- Lá không cuống, mọc đối xứng thẳng, kích thước 1 - 5 cm x 2 - 5 mm. Lá ở dưới nhỏ hơn. Lá hình mác hẹp, ráp, dài đến 4 cm.
- Hoa mọc ở nách lá trong cuống lá bắc, cuống hoa dài khoảng 1 mm, lá bắc tương tự như lá nhưng ngắn hơn; tràng hoa màu trắng, màu kem hoặc màu xanh nhạt. Loài này rất giống với loài S. asiatica nhưng khác ở chỗ đài của nó dài hơn và có 15 gân
- Quả nang mở dài 5 - 6 mm, ngắn hơn đài.
- Hạt dài 0,5 mm (to hơn hạt của loài S. asiatica), có những nét khía.

Hình 6: Phân biệt 03 loài cỏ ma
a. S. asiatica; b. S.angustifolia; c. S.densiflora
(Nguồn: CABI, Crop Protection Compendium, 2007)
4. Loài Striga asiatica (L.) Kuntze
4.1. Phân bố
Châu Á: Căm-pu-chia, Ả rập xê út, Syria, Yemen, Việt Nam
Châu Phi: Angola, Benin, Burkina Faso, Burundi, Cameroon, Cộng hòa Trung Phi, Chad, Công gô, Ai Cập, Ethiopia, Gambia, Ghana, Guinea Bissau, Guinea, Kenya, Madagascar, Malawi, Mali, Mauritania, Morocco, Mozambique, Namibia, Niger, Nigeria, Rwanda, Senegal, Nam Phi, Sudan, Swaziland, Tazania, Togo, Uganda, Zambia, Zimbabwe
4.2. Tên khoa học và vị trí phân loại
|
- Tên khoa học - Tên tiếng Việt - Tên khác |
: Striga asiatica (L.) Kuntze : Cỏ ma ký sinh S.I Striga lutea Lour. Buchnera asiatica L. Striga gracilis MIQ. Striga parvula MIQ. Striga spanopheana MIQ. Buchnera coccinea Benth. Striga coccinea (Benth.) Benth. Striga pusila Hochst. Striga zangebarica Klotsch Buchnera hirsuta Benth. Campuleia coccinea Hook. Striga phoenicea Benth. Striga hirsuta |
- Vị trí phân loại:
|
Giới Ngành Lớp Bộ Họ Chi |
: Viridiplantae : Spermatophyta : Dicotyledonae : Scrophulariales : Scrophulariaceae : Striga |
4.3. Phương thức gây hại
Sau khi nảy mầm, rễ ký sinh hình thành các lông hút để tiếp xúc và xâm nhập vào rễ ký chủ, hình thành các rễ mút (đỉnh rễ) phát triển tiến dần vào tới mô mạch của ký chủ. Cây ký sinh hút đường, nước, các amino axít và muối khoáng từ ký chủ để phát triển thông qua hệ thống rễ. Khi còn ở dưới mặt đất, việc hấp thụ dinh dưỡng của cây ký sinh hoàn toàn phụ thuộc vào cây ký chủ. Khi cây ký sinh mọc lên khỏi mặt đất, có ánh sáng mặt trời, diệp lục được hình thành (lá xanh phát triển), quá trình quang hợp bắt đầu xảy ra, nhưng hiệu quả chỉ bằng khoảng 20%, do đó cây ký sinh vẫn sống dựa vào ký chủ trong suốt quá trình sinh trưởng và phát triển của nó.
4.4. Ký chủ
- Ký chủ gồm các loài: lúa gạo, ngô, mía, lúa miến, kê chân vịt, kê, cỏ họ Poaceae
4.5. Đặc điểm nhận dạng cỏ ma ký sinh S.I [Striga asiatica (L.) Kuntze] - dịch hại kiểm dịch thực vật nhóm II của Việt Nam
- Rễ kém phát triển, hình thành các vòi hút, giác bám ăn sâu vào rễ ký chủ.
- Chiều cao của cây rất đa dạng, có thể vài cen-ti-mét cho đến 30 - 40 cm Thân ở dưới đất hình tròn, ở phía trên hình vuông, có nhiều lông cứng. Với những cây phát triển mạnh, thân cây có thể phân nhiều nhánh, nhưng với những cây nhỏ hoặc những kiểu sinh thái khác cây có thể không phân nhánh.
- Lá thẳng, không cuống, màu xanh, hình mác hẹp, kích thước 10-40 x 1-4 mm, phủ lông dạng vảy; những lá ở phía dưới mọc đối xứng, những lá ở phía trên mọc cách.
- Hoa tự thẳng, mọc ở tận cùng của nhánh; phần nhánh mang hoa dài 10-15 cm. Hoa không cuống hoặc cuống ngắn, phủ bởi lông vảy, ở cuống mỗi hoa có 1 lá bắc nhỏ và 2 lá bắc rất nhỏ. Đài hình ống, dài đến 6 mm, có 10 gân và cũng có thể có 11-14 gân nhưng không bao giờ có đến 15 gân như loài S. angustifolia. Tràng hình ống, uốn cong, dài khoảng gấp 2 lần chiều dài của đài, rộng 5 - 10 mm. Màu sắc của hoa có nhiều biến đổi: màu đỏ, màu vàng, màu trắng, màu hồng hoặc màu đỏ tía.
- Quả nang mở dài khoảng 5 mm, màu đen, hình elip chứa hàng trăm hạt.
- Hạt nhỏ, màu nâu kích thước 0,2 - 0,3 mm; trọng lượng hạt khoảng 5 mg.
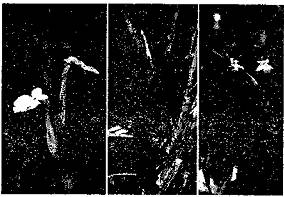
Hình 7: Cây cỏ ma Striga asiatica với các màu hoa khác nhau
(Nguồn: CABI, Crop Protection Compendium, 2007)
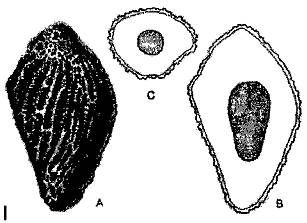
Hình 8: Hạt cỏ Striga asiatica
(A. Hạt; B. Vị trí của phôi; C. Tiết diện ngang của hạt)
(Nguồn: Identification of Disseminules Listed in the Federal Noxious Weed Act, 1988)
Phụ lục 2.
(quy định)
Mẫu phiếu kết quả giám định
|
Cơ quan Bảo vệ |
CỘNG HÒA XÃ
HỘI CHỦ NGHĨA VIỆT NAM |
|
|
……….. ngày …. tháng …. năm 20….. |
PHIẾU KẾT QUẢ GIÁM ĐỊNH
Cỏ ma ký sinh thuộc chi Striga là dịch hại kiểm dịch thực vật của Việt Nam
|
1. Tên hàng hóa |
: |
|
|
2. Nước xuất khẩu |
: |
|
|
3. Xuất xứ |
: |
|
|
4. Phương tiện vận chuyển |
: |
Khối lượng: |
|
5. Địa điểm lấy mẫu |
: |
|
|
6. Ngày lấy mẫu |
: |
|
|
7. Người lấy mẫu |
: |
|
|
8. Tình trạng mẫu |
: |
|
|
9. Ký hiệu mẫu |
: |
|
|
10. Số mẫu lưu |
: |
|
|
11. Người giám định |
: |
|
12. Phương pháp giám định: Theo quy chuẩn kỹ thuật quốc gia QCVN 01 - 165 : 2014/BNNPTNT về "Quy trình giám định cỏ ma ký sinh thuộc chi Striga là dịch hại kiểm dịch thực vật của Việt Nam".
|
13. Kết quả giám định Tên khoa học Họ Bộ |
: : : Scrophulariaceae : Scrophulariales |
Là dịch hại kiểm dịch thực vật thuộc danh mục dịch hại kiểm dịch thực vật của Việt Nam.
|
TRƯỞNG PHÒNG KỸ
THUẬT |
THỦ TRƯỞNG ĐƠN VỊ |
QUY CHUẨN KỸ THUẬT QUỐC GIA VỀ PHƯƠNG PHÁP ĐIỀU TRA PHÁT HIỆN DỊCH HẠI LÚA
National technical regulation on surveillance method of Rice pests
Lời nói đầu
QCVN 01 - 166 : 2014/BNNPTNT do Phòng Bảo vệ thực vật biên soạn, Cục Bảo vệ thực vật trình duyệt, Bộ Nông nghiệp & PTNT ban hành tại Thông tư số 16/TT-BNNPTNT ngày 05 tháng 6 năm 2014.
QUY CHUẨN KỸ THUẬT QUỐC GIA VỀ PHƯƠNG PHÁP ĐIỀU TRA PHÁT HIỆN DỊCH HẠI LÚA
National technical regulation on surveillance method of Rice pests
I. QUY ĐỊNH CHUNG
1.1. Phạm vi điều chỉnh
Quy chuẩn này quy định nguyên tắc, nội dung, phương pháp áp dụng trong công tác điều tra phát hiện dịch hại chủ yếu và sinh vật có ích trong từng giai đoạn sinh trưởng, phát triển của cây lúa, phục vụ cho dự tính dự báo và phòng trừ dịch hại hiệu quả, an toàn.
1.2. Đối tượng áp dụng
Quy chuẩn này bắt buộc áp dụng trong Hệ thống tổ chức chuyên ngành Bảo vệ và Kiểm dịch thực vật; tổ chức, cá nhân có hoạt động điều tra, phát hiện dịch hại cây lúa tại Việt Nam.
1.3. Giải thích từ ngữ
Trong quy chuẩn này, các từ ngữ dưới đây được hiểu như sau:
1.3.1. Dịch hại cây lúa (còn gọi là sinh vật gây hại cây lúa)
Là loài, chủng hoặc dạng sinh học của thực vật, động vật hoặc vi sinh vật gây hại cho lúa; bao gồm: Côn trùng, nhện hại, nấm bệnh, tuyến trùng, vi khuẩn, virus, phytoplasma, cỏ dại, chuột và các sinh vật gây hại khác.
1.3.2. Dịch hại chính
Là những sinh vật thường xuyên xuất hiện phổ biến và hại nặng hàng vụ, hàng năm ở địa phương.
1.3.3. Dịch hại chủ yếu
Là những dịch hại chính, mà tại thời điểm điều tra có mức độ gây hại cao hoặc khả năng lây lan nhanh, phân bố rộng trong điều kiện ngoại cảnh thuận lợi.
1.3.4. Yếu tố điều tra chính
Là các yếu tố đại diện có liên quan đến dịch hại, bao gồm yếu tố giống, thời vụ, địa hình (chân đất), giai đoạn sinh trưởng, phát triển của cây lúa và tập quán canh tác.
1.3.5. Khu vực điều tra
Là khu đồng đại diện cho các yếu tố điều tra và được chọn cố định để điều tra ngay từ đầu vụ.
1.3.6. Tuyến điều tra
Là tuyến được xác định theo một lịch trình đã định sẵn, theo đường chéo góc của khu vực điều tra và thỏa mãn các yếu tố điều tra chính của khu vực điều tra.
1.3.7. Mẫu điều tra
Là số lượng thân, lá, rễ, hạt, bông lúa trên đơn vị điểm điều tra.
1.3.8. Điểm điều tra
Là điểm được bố trí tương đối ngẫu nhiên và đồng đều trên tuyến điều tra.
1.3.9. Mật độ dịch hại hoặc thiên địch bắt mồi
Là số lượng cá thể dịch hại hoặc thiên địch bắt mồi trên một đơn vị diện tích hoặc một đơn vị đối tượng khảo sát.
1.3.10. Tỷ lệ bệnh hoặc tỷ lệ hại
Là số lượng mẫu điều tra bị bệnh hoặc bị hại tính theo phần trăm (%) so với tổng số mẫu điều tra.
1.3.11. Chỉ số bệnh hoặc chỉ số hại
Là đại lượng đặc trưng cho mức độ bị bệnh hoặc bị hại của cây trồng được biểu thị bằng phần trăm (%).
1.3.12. Sinh vật có ích (thiên địch)
Bao gồm vi rút, vi khuẩn, tuyến trùng, nấm, côn trùng, động vật và các sinh vật khác có tác dụng hạn chế tác hại của dịch hại lúa.
1.3.13. Điều tra định kỳ
Là hoạt động điều tra thường xuyên của cán bộ bảo vệ thực vật trong khoảng thời gian định trước trên tuyến điều tra thuộc khu vực điều tra nhằm nắm được diễn biến của dịch hại cây lúa và thiên địch của chúng.
1.3.14. Điều tra bổ sung
Là mở rộng tuyến điều tra hoặc tăng số lần điều tra vào các thời kỳ xung yếu của cây lúa và dịch hại đặc thù của vùng sinh thái hoặc trong vùng dịch, vùng đệm, vùng bị dịch uy hiếp, nhằm xác định thời gian phát sinh, diện phân bố và mức độ gây hại của dịch hại chủ yếu trên cây lúa ở địa phương, cũng như sự lây lan hoặc tái phát dịch.
II. QUY ĐỊNH KỸ THUẬT
2.1. Yêu cầu kỹ thuật
Theo Quy chuẩn kỹ thuật quốc gia (QCVN 01-38:2010/BNNPTNT) về phương pháp điều tra phát hiện dịch hại cây trồng.
2.2. Thiết bị và dụng cụ điều tra
Theo Quy chuẩn kỹ thuật quốc gia (QCVN 01-38:2010/BNNPTNT) về phương pháp điều tra phát hiện dịch hại cây trồng.
2.3. Thời gian điều tra
- Điều tra định kỳ: 7 ngày/lần ở tuyến điều tra với các yếu tố điều tra trong khu vực điều tra cố định ngay từ đầu vụ vào các ngày thứ 2, thứ 3 hàng tuần.
- Điều tra bổ sung: Tiến hành trước, trong và sau cao điểm xuất hiện dịch hại.
2.4. Yếu tố điều tra chính
Chọn đại diện theo giống, thời vụ, địa hình (chân đất), giai đoạn sinh trưởng, phát triển của cây lúa và tập quán canh tác.
2.5. Khu vực điều tra
- Vùng trọng điểm lúa: Chọn khu vực trồng lúa có diện tích trên 20 ha đại diện cho các yếu tố điều tra chính.
- Vùng không trọng điểm lúa: Chọn khu vực trồng lúa có diện tích trên 2 ha đại diện cho các yếu tố điều tra chính.
2.6. Điểm điều tra
Mỗi yếu tố điều tra 10 điểm tương đối ngẫu nhiên và đồng đều trên tuyến điều tra. Điểm điều tra phải cách bờ ít nhất 2 mét.
2.7. Phương pháp điều tra
2.7.1. Phương pháp điều tra phát hiện nhóm sâu hại thân lúa (sâu đục thân, sâu năn, ruồi đục nõn,...) và thiên địch
2.7.1.1. Số mẫu điều tra của 1 điểm
- Đối với mạ và lúa gieo thẳng: 1 khung (40 x 50 cm)/điểm;
- Đối với lúa cấy: 10 khóm/điểm.
2.7.1.2. Cách điều tra
- Ngoài đồng
- Điều tra phát dục, mật độ đối với sâu đục thân
Điều tra dảnh héo, bông bạc: Đếm tổng số dảnh lúa (mạ), bông lúa và tổng dảnh héo, bông bạc có trong điểm điều tra; lấy toàn bộ dảnh bị hại đem về phòng để đếm sâu, phân tuổi.
Điều tra ổ trứng: Diện tích điều tra tối thiểu 4 m2/điểm (hoặc điều tra theo hàng, băng tương đương với 4 m2 trở lên); quan sát trực tiếp hoặc dùng thước gạt lúa, sau đó đếm và quy ra số lượng ổ trứng/m2.
Điều tra trưởng thành: Diện tích điều tra tối thiểu 4 m2/điểm; quan sát từ xa đến gần, sau đó đếm trực tiếp; hoặc dùng thước điều tra gạt lúa theo băng (chiều rộng 1 mét chiều dài tùy theo kích thước ruộng điều tra nhưng tối thiểu 10 mét); hoặc dùng vợt điều tra, mỗi điểm vợt 3 vợt/điểm, sau đó đếm và quy ra số trưởng thành/m2.
* Điều tra tỷ lệ dảnh bị hại đối với sâu năn, ruồi đục nõn:
Đếm tổng số dảnh lúa (mạ) có trong điểm điều tra;
Đếm số dảnh bị hại có trong điểm điều tra; lấy toàn bộ dảnh bị hại đem về phòng để đếm sâu, phân tuổi.
* Cách điều tra sinh vật có ích (bắt mồi ăn thịt) tương tự như điều tra sâu hại.
- Trong phòng
Chẻ từng dảnh bị hại đã lấy ngoài đồng để đếm sâu và phân tuổi.
Để theo dõi ký sinh sâu đục thân: Thu ít nhất một lần vào cao điểm rộ tối thiểu 30 ổ trứng hoặc 30 cá thể sâu non.
2.7.1.3. Các chỉ tiêu cần theo dõi
- Mật độ sâu (con/m2); mật độ trứng (ổ trứng/m2); mật độ trưởng thành (con/m2);
- Tỷ lệ hại (%);
- Tỷ lệ pha phát dục của sâu (%);
- Tỷ lệ tuổi sâu (%);
- Tuổi sâu phổ biến;
- Mật độ các loại thiên địch bắt mồi (con/m2);
- Tỷ lệ ký sinh (%);
- Diện tích bị nhiễm sâu (ha);
- Diện tích đã xử lý: Thuốc bảo vệ thực vật và các biện pháp khác (ha).
2.7.1.4. Công thức tính
|
Mật độ sâu, ổ trứng; thiên địch bắt mồi (con/m2; ổ trứng/m2) |
= |
Tổng số sâu, ổ trứng, thiên địch điều tra |
|
|
|
Tổng số m2 điều tra |
||||
|
Tỷ lệ hại (%) |
= |
Tổng số dảnh héo, cọng hành, bông bạc |
x 100 |
|
|
Tổng số dảnh điều tra |
||||
|
Tỷ lệ pha phát dục (%) |
= |
Tổng số sâu sống ở từng pha |
x 100 |
|
|
Tổng số sâu điều tra |
||||
|
Tỷ lệ tuổi sâu (%) |
= |
Tổng số sâu sống ở từng tuổi |
x 100 |
|
|
Tổng số sâu điều tra |
||||
|
Tỷ lệ ký sinh (%) |
= |
Tổng số cá thể bị ký sinh |
x 100 |
|
|
Tổng số cá thể điều tra |
||||
|
Diện tích nhiễm dịch hại Xi (ha) |
= |
(N1 x S1) + ….. + (Nn x Sn) |
|
|
|
10 |
||||
|
Trong đó: |
Xi (ha): Diện tích nhiễm dịch hại ở mức i; N1: Số điểm nhiễm dịch hại của yếu tố thứ 1; S1: Diện tích gieo cấy lúa của yếu tố thứ 1; Nn: Số điểm nhiễm dịch hại của yếu tố thứ n; Sn: Diện tích gieo cấy lúa của yếu tố thứ n; 10: Số điểm điều tra của 1 yếu tố; Mức i: Nhiễm nhẹ, trung bình, nặng |
|||
2.7.1.5. Các căn cứ để tính diện tích nhiễm
- Yếu tố điều tra chính (giống, thời vụ, giai đoạn sinh trưởng, địa hình);
- Diện tích gieo cấy của từng yếu tố liên quan;
- Số liệu điều tra của từng yếu tố liên quan
- Quy định mật độ ổ trứng sâu đục thân, tỷ lệ hại để thống kê diện tích nhiễm;
|
Mức độ nhiễm |
Sâu đục thân |
Sâu năn (% dảnh) |
Ruồi đục nõn (% dảnh) |
|||
|
Giai đoạn mạ, đẻ nhánh |
Giai đoạn đòng trỗ |
|||||
|
% dảnh héo |
Ổ trứng/m2 |
% bông bạc |
Ổ trứng/m2 |
|||
|
Nhiễm nhẹ |
5 - 10 |
0,25 - 0,5 |
2,5 - 5 |
0,15 - 0,3 |
5 - 10 |
10 - 20 |
|
Nhiễm tr.bình |
> 10 - 20 |
>0,5 - 1,0 |
> 5 - 10 |
0,3 - 0,6 |
> 10 - 20 |
> 20 - 40 |
|
Nhiễm nặng |
> 20 |
> 1,0 |
> 10 |
> 0,6 |
> 20 |
> 40 |
|
Mất trắng |
Giảm trên 70% năng suất (dùng để thống kê cuối các đợt dịch hoặc cuối vụ sản xuất). |
|||||
2.7.2. Phương pháp điều tra phát hiện nhóm sâu hại lá, bông lúa (sâu cuốn lá nhỏ, sâu cắn gié, sâu phao, sâu keo, sâu gai, châu chấu, ...) và thiên địch
2.7.2.1. Số mẫu điều tra của 1 điểm
- Đối với mạ và lúa gieo thẳng: 1 khung (40 x 50 cm)/điểm;
- Đối với lúa cấy: 10 khóm/điểm;
2.7.2.2. Cách điều tra
- Ngoài đồng
* Điều tra phát dục, mật độ
Quan sát từ xa đến gần, sau đó đếm trực tiếp số lượng các pha phát dục có trên từng khóm (dảnh) lúa trong điểm điều tra; phân tuổi của pha sâu non.
Điều tra sâu cắn gié tuổi 1-2: dùng khay (20 x 20 x 5 cm), đáy khay tráng 1 lớp dầu hoặc chất bám dính, cầm từng bông lúa rung nhẹ để sâu rơi vào khay, đếm và phân tuổi số sâu có trong khay.
Điều tra mật độ trứng và sâu non tuổi 1 của sâu cuốn lá nhỏ: Lấy tối thiểu 3 khóm lúa ngẫu nhiên/điểm mang về phòng để làm tất cả các chỉ tiêu trên.
Trong thời gian trườởg thành rộ, dùng thước điều tra để gạt lúa theo băng có chiều rộng 1 mét chiều dài tùy theo kích thước ruộng điều tra (tối thiểu 10 mét), đếm toàn bộ số trưởng thành có trong băng đó; hoặc dùng vợt điều tra, mỗi điểm 3 vợt, rồi tính ra số trưởng thành/m2.
* Điều tra đánh giá tỷ lệ, chỉ số lá bị hại
Đếm tổng số dảnh lúa (mạ) có trong điểm điều tra; đếm số lá của 5 dảnh ngẫu nhiên, tính số lá bình quân/dảnh, từ đó tính số lá/m2;
Đếm toàn bộ số lá bị hại, phân cấp hại theo thang 9 cấp:
+ Cấp 1: < 1% diện tích lá bị hại;
+ Cấp 3: từ 1 - 5% diện tích lá bị hại;
+ Cấp 5: > 5 - 25% diện tích lá bị hại;
+ Cấp 7: > 25 - 50% diện tích lá bị hại;
+ Cấp 9: > 50% diện tích lá bị hại.
* Cách điều tra sinh vật có ích (bắt mồi ăn thịt) tương tự như điều tra sâu hại.
- Trong phòng
Để theo dõi ký sinh: Thu ít nhất một lần vào cao điểm trứng rộ, ít nhất 50 trứng đẻ rời hoặc 30 ổ trứng; cao điểm sâu non, nhộng hoặc trưởng thành rộ, ít nhất mỗi pha phát dục 30 cá thể.
2.7.2.3. Các chỉ tiêu cần theo dõi
- Mật độ sâu (con/m2); mật độ trứng (quả trứng hoặc ổ trứng/m2); mật độ trưởng thành (con/m2);
- Tỷ lệ lá bị hại (%);
- Tỷ lệ pha phát dục của sâu (%);
- Tỷ lệ tuổi sâu (%);
- Tuổi sâu phổ biến;
- Mật độ các loại thiên địch bắt mồi (con/m2);
- Tỷ lệ ký sinh (%);
- Diện tích bị nhiễm sâu (ha);
- Diện tích đã xử lý: Thuốc bảo vệ thực vật và các biện pháp khác (ha).
2.7.2.4. Công thức tính
|
Mật độ sâu, trứng; thiên địch bắt mồi (con/m2) |
= |
Tổng số sâu, trứng, thiên địch điều tra |
|
|
Tổng số m2 điều tra |
|||
|
Tỷ lệ lá bị hại (%) |
= |
Tổng số lá bị hại |
x 100 |
|
Tổng số lá điều tra |
|||
|
Chỉ số lá hại (%) |
= |
(N1 x 1) + … + (Nn x n) |
x 100 |
|
N x 9 |
|||
|
Trong đó: |
N1: là số lá bị hại ở cấp 1; Nn: là số lá bị hại ở cấp n; N: là tổng số lá điều tra; 9: là cấp hại cao nhất của thang phân cấp. |
||
|
Tỷ lệ pha phát dục (%) |
= |
Tổng số sâu ở từng pha |
x 100 |
|
Tổng số sâu điều tra |
|||
|
Tỷ lệ tuổi sâu (%) |
= |
Tổng số sâu sống ở từng tuổi |
x 100 |
|
Tổng số sâu điều tra |
|||
|
Tỷ lệ ký sinh (%) |
= |
Tổng số cá thể bị ký sinh |
x 100 |
|
Tổng số cá thể điều tra |
|||
|
Diện tích nhiễm dịch hại Xi (ha) |
= |
(N1 x S1) + ….. + (Nn x Sn) |
|
|
10 |
|||
|
Trong đó: |
Xi (ha): Diện tích nhiễm dịch hại ở mức i; N1: Số điểm nhiễm dịch hại của yếu tố thứ 1; S1: Diện tích gieo cấy lúa của yếu tố thứ 1; Nn: Số điểm nhiễm dịch hại của yếu tố thứ n; Sn: Diện tích gieo cấy lúa của yếu tố thứ n; 10: Số điểm điều tra của 1 yếu tố; Mức i: Nhiễm nhẹ, trung bình, nặng |
||
2.7.2.5. Các căn cứ để tính diện tích nhiễm
- Số yếu tố điều tra chính (giống, thời vụ, giai đoạn sinh trưởng, địa hình);
- Diện tích gieo cấy của từng yếu tố liên quan;
- Số liệu điều tra của từng yếu tố liên quan;
- Quy định mật độ sâu để thống kê diện tích nhiễm
|
Mức độ nhiễm |
Sâu cuốn lá nhỏ |
Sâu cắn gié (con/m2) |
Sâu keo, sâu phao, châu chấu (con/m2) |
Sâu gai (con/m2) |
|
|
đẻ nhánh (con/m2) |
đòng trỗ (con/m2) |
||||
|
Nhiễm nhẹ |
25 - 50 |
10 - 20 |
2,5 - 5 |
10 - 20 |
10 - 20 trưởng thành hoặc 100 - 200 sâu non |
|
Nhiễm tr.bình |
> 50 - 100 |
> 20 - 40 |
> 5 - 10 |
> 20 - 40 |
> 20 - 40 trưởng thành hoặc > 200 - 400 sâu non |
|
Nhiễm nặng |
> 100 |
> 40 |
> 10 |
> 40 |
> 40 TT hoặc |
|
Mất trắng |
Giảm trên 70% năng suất (dùng để thống kê cuối các đợt dịch hoặc cuối vụ sản xuất). |
||||
2.7.3. Phương pháp điều tra phát hiện nhóm rầy hại thân lúa (rầy nâu, rầy lưng trắng, rầy nâu nhỏ, ...) và thiên địch
2.7.3.1. Số mẫu điều tra của 1 điểm
- Đối với mạ và lúa gieo thẳng: 1 khung (40 x 50 cm)/điểm;
- Đối với lúa cấy: 10 khóm/điểm.
2.7.3.2. Cách điều tra
- Ngoài đồng
* Điều tra rầy (non, trưởng thành):
+ Đối với lúa cấy: Dùng khay (20cm x 20 cm x 5 cm), đáy khay tráng một lớp dầu nhờn hoặc chất bám dính; đặt khay từng khóm lúa và nghiêng với gốc lúa 1 góc 45o, đập 2 đập rồi đếm và phân tuổi số rầy vào khay, số rầy bị ký sinh.
+ Đối với mạ và lúa gieo thẳng: Đếm trực tiếp số rầy có trong khung (40 x 50 cm), phân tuổi; tính số rầy bị ký sinh.
* Điều tra trứng:
Đối với lúa cấy, lấy tối thiểu 3 khóm lúa ngẫu nhiên/điểm, nếu lượng trứng nhiều chọn ngẫu nhiên 3 - 5 dảnh/khóm lúa; đối với lúa sạ, lấy tối thiểu 40 dảnh lúa ngẫu nhiên/điểm, nếu lượng trứng nhiều chọn ngẫu nhiên 10 - 15 dảnh lúa. Tách toàn bộ bẹ, gân lá của các dảnh đếm số ổ trứng rầy; phân loại trứng rầy ký sinh, trứng rầy ung, trứng rầy nở và trứng rầy chưa nở.
- Trong phòng
Để theo dõi ký sinh: Thu ít nhất một lần vào cao điểm rộ tối thiểu 30 ổ trứng hoặc 30 cá thể rầy non hoặc trưởng thành.
2.7.3.3. Các chỉ tiêu cần theo dõi
- Mật độ rầy (con/m2); mật độ ổ trứng (ổ trứng/m2);
- Mật độ các loại thiên địch bắt mồi (con/m2);
- Tỷ lệ pha phát dục của rầy (%);
- Tỷ lệ tuổi rầy (%);
- Tuổi rầy phổ biến;
- Tỷ lệ rầy trưởng thành cánh ngắn (%);
- Tỷ lệ ký sinh (%);
- Diện tích bị nhiễm rầy (ha);
- Diện tích đã xử lý: Thuốc bảo vệ thực vật và các biện pháp khác (ha).
2.7.3.4. Công thức tính
* Mạ, lúa gieo thẳng đếm trực tiếp:
|
Mật độ rầy, ổ trứng; thiên địch bắt mồi (con/m2; ổ trứng/m2) |
= |
Tổng số rầy, ổ trứng (thiên địch) điều tra |
|
|
Tổng số m2 điều tra |
* Lúa cấy (điều tra bằng khay):
|
Mật độ rầy, thiên địch bắt mồi (con/m2) |
= |
Tổng số rầy (thiên địch) điều tra |
x 2 |
|
Tổng số m2 điều tra |
|||
|
Tỷ lệ pha phát dục (%) |
= |
Tổng số rầy ở từng pha |
x 100 |
|
Tổng số rầy điều tra |
|||
|
Tỷ lệ tuổi rầy (%) |
= |
Tổng số rầy sống ở từng tuổi |
x 100 |
|
Tổng số rầy điều tra |
|||
|
Tỷ lệ rầy trưởng thành cánh ngắn (%) |
= |
Tổng số rầy trưởng thành cánh ngắn |
x 100 |
|
Tổng số rầy điều tra |
|||
|
Tỷ lệ ký sinh (%) |
= |
Tổng số cá thể bị ký sinh ở từng pha |
x 100 |
|
Tổng số cá thể điều tra ở từng pha |
|||
|
Diện tích nhiễm dịch hại Xi (ha) |
= |
(N1 x S1) + ….. + (Nn x Sn) |
|
|
10 |
|||
|
Trong đó: |
Xi (ha): Diện tích nhiễm dịch hại ở mức i; N1: Số điểm nhiễm dịch hại của yếu tố thứ 1; S1: Diện tích gieo cấy lúa của yếu tố thứ 1; Nn: Số điểm nhiễm dịch hại của yếu tố thứ n; Sn: Diện tích gieo cấy lúa của yếu tố thứ n; 10: Số điểm điều tra của 1 yếu tố; Mức i: Nhiễm nhẹ, trung bình, nặng |
||
2.7.3.5. Các căn cứ để tính diện tích nhiễm
- Yếu tố điều tra chính: giống, thời vụ, giai đoạn sinh trưởng, địa hình;
- Diện tích gieo cấy của từng yếu tố liên quan;
- Số liệu điều tra của từng yếu tố liên quan;
- Quy định mật độ rầy để thống kê diện tích nhiễm
|
Mức độ nhiễm |
Rầy (con/m2) |
Ổ trứng rầy (ổ/m2) |
|
Nhiễm nhẹ |
750 - 1500 |
250 - 500 |
|
Nhiễm trung bình |
> 1500 - 3000 |
> 500 - 1.000 |
|
Nhiễm nặng |
> 3000 |
> 1.000 |
|
Mất trắng |
Giảm trên 70% năng suất (dùng để thống kê cuối các đợt dịch hoặc cuối mỗi vụ sản xuất). |
|
* Cách điều tra sinh vật có ích (bắt mồi ăn thịt) tương tự như điều tra sâu hại.
2.7.4. Phương pháp điều tra phát hiện bọ xít hại lúa (bọ xít đen, bọ xít xanh, bọ xít dài,...) và thiên địch
2.7.4.1. Số mẫu điều tra của 1 điểm
- Đối với mạ và lúa gieo thẳng: 1 khung (40 x 50 cm)/điểm;
- Đối với lúa cấy: 10 khóm/điểm.
2.7.4.2. Cách điều tra
- Ngoài đồng
Quan sát từ xa đến gần, sau đó đếm trực tiếp số lượng và phân từng pha phát dục có trên từng khóm trong điểm điều tra.
* Cách điều tra sinh vật có ích (bắt mồi ăn thịt) tương tự như điều tra sâu hại.
- Trong phòng
Khi cần thiết, thu ít nhất 30 ổ trứng, cá thể sâu non hoặc trưởng thành về phòng để theo dõi.
2.7.4.3. Các chỉ tiêu cần theo dõi
- Mật độ bọ xít non, trưởng thành (con/m2);
- Tỷ lệ pha phát dục của bọ xít (%);
- Tỷ lệ tuổi sâu (%);
- Tuổi bọ xít phổ biến;
- Mật độ các loại thiên địch bắt mồi (con/m2);
- Tỷ lệ ký sinh (%);
- Diện tích bị nhiễm bọ xít (ha);
- Diện tích đã xử lý: Thuốc bảo vệ thực vật và các biện pháp khác (ha).
2.7.4.4. Công thức tính
|
Mật độ bọ xít, thiên địch bắt mồi (con/m2) |
= |
Tổng số bọ xít (thiên địch) điều tra |
|
|
Tổng số m2 điều tra |
|||
|
Tỷ lệ pha phát dục (%) |
= |
Tổng số dịch hại sống ở từng pha |
x 100 |
|
Tổng số sâu điều tra |
|||
|
Tỷ lệ tuổi sâu (%) |
= |
Tổng số sâu sống ở từng tuổi |
x 100 |
|
Tổng số sâu điều tra |
|||
|
Tỷ lệ ký sinh (%) |
= |
Tổng số cá thể bị ký sinh ở từng pha |
x 100 |
|
Tổng số cá thể điều tra ở từng pha |
|||
|
Diện tích nhiễm dịch hại Xi (ha) |
= |
(N1 x S1) + ….. + (Nn x Sn) |
|
|
10 |
|||
|
Trong đó: |
Xi (ha): Diện tích nhiễm dịch hại ở mức i; N1: Số điểm nhiễm dịch hại của yếu tố thứ 1; S1: Diện tích gieo cấy lúa của yếu tố thứ 1; Nn: Số điểm nhiễm dịch hại của yếu tố thứ n; Sn: Diện tích gieo cấy lúa của yếu tố thứ n; 10: Số điểm điều tra của 1 yếu tố; Mức i: Nhiễm nhẹ, trung bình, nặng |
||
2.7.4.5. Các căn cứ để tính diện tích nhiễm
- Số yếu tố điều tra chính giống, thời vụ, giai đoạn sinh trưởng, địa hình (chân đất);
- Diện tích gieo cấy của từng yếu tố liên quan;
- Số liệu điều tra của từng yếu tố liên quan;
- Quy định mật độ sâu để thống kê diện tích nhiễm
|
Mức độ nhiễm |
Bọ xít dài |
Bọ xít đen,
bọ xít xanh |
|
Nhiễm nhẹ |
3 - 6 |
10 - 20 |
|
Nhiễm trung bình |
> 6 - 12 |
> 20 - 40 |
|
Nhiễm nặng |
> 12 |
> 40 |
|
Mất trắng |
Giảm trên 70% năng suất (dùng để thống kê cuối các đợt dịch hoặc cuối vụ sản xuất). |
|
2.7.5. Phương pháp điều tra phát hiện nhóm chích hút khác hại lúa (Nhện gié, bọ trĩ, bọ phấn, rệp,...) và thiên địch
2.7.5.1. Số mẫu điều tra của 1 điểm
Mỗi điểm điều tra 5 dảnh ngẫu nhiên của 5 khóm (lúa cấy)/điểm hoặc dảnh ngẫu nhiên (mạ, lúa sạ)/điểm.
2.7.5.2. Cách điều tra
- Ngoài đồng
* Đối với sâu (bọ trĩ, bọ phấn, rệp):
Đếm trực tiếp số lượng các pha phát dục có trong điểm điều tra; ghi nhận pha phát dục phổ biến;
Đếm tổng số dảnh lúa (mạ) có trong điểm điều tra;
Đếm tổng số dảnh lúa (mạ) có bọ trĩ, bọ phấn, rệp.
* Đối với nhện gié:
Đếm tổng số dảnh lúa có trong điểm điều tra;
Đếm tổng số dảnh lúa có nhện;
* Cách điều tra sinh vật có ích (bắt mồi ăn thịt) tương tự như điều tra sâu hại.
- Trong phòng
Khi cần thiết, thu ít nhất 30 cá thể sâu non (bọ trĩ, bọ phấn, rệp non,...) hoặc trưởng thành về phòng để theo dõi.
2.7.5.3. Các chỉ tiêu cần theo dõi
- Mật độ sâu (bọ trĩ, bọ phấn, rệp), nhện (con/m2);
- Mật độ các loại thiên địch bắt mồi (con/m2);
- Tỷ lệ dảnh bị hại (%);
- Diện tích bị nhiễm (ha);
- Diện tích đã xử lý: Thuốc bảo vệ thực vật và các biện pháp khác (ha).
2.7.5.4. Công thức tính
|
Mật độ sâu, nhện, thiên địch bắt mồi (con/m2) |
= |
Tổng số sâu, nhện, thiên địch điều tra |
|
|
Tổng số m2 điều tra |
|||
|
Tỷ lệ dảnh bị hại (%) |
= |
Tổng số dảnh bị hại |
x 100 |
|
Tổng số dảnh điều tra |
|||
|
Tỷ lệ ký sinh (%) |
= |
Tổng số cá thể bị ký sinh ở từng pha |
x 100 |
|
Tổng số cá thể điều tra ở từng pha |
|||
|
Diện tích nhiễm dịch hại Xi (ha) |
= |
(N1 x S1) + ….. + (Nn x Sn) |
|
|
10 |
|||
|
Trong đó: |
Xi (ha): Diện tích nhiễm dịch hại ở mức i; N1: Số điểm nhiễm dịch hại của yếu tố thứ 1; S1: Diện tích gieo cấy lúa của yếu tố thứ 1; Nn: Số điểm nhiễm dịch hại của yếu tố thứ n; Sn: Diện tích gieo cấy lúa của yếu tố thứ n; 10: Số điểm điều tra của 1 yếu tố; Mức i: Nhiễm nhẹ, trung bình, nặng |
||
2.7.5.5. Các căn cứ để tính diện tích nhiễm
- Yếu tố điều tra chính (giống, thời vụ, giai đoạn sinh trưởng, địa hình);
- Diện tích gieo cấy của từng yếu tố liên quan;
- Số liệu điều tra của từng yếu tố liên quan;
- Quy định mật độ, tỷ lệ hại để thống kê diện tích nhiễm
|
Mức độ nhiễm |
Mật độ hoặc tỷ lệ nhiễm |
|
Nhiễm nhẹ |
2.500 - 5.000 con/m2 hoặc 15 - 30% số dảnh bị nhiễm |
|
Nhiễm trung bình |
> 5.000 - 10.000 con/m2 hoặc > 30 - 60% số dảnh bị nhiễm |
|
Nhiễm nặng |
> 10.000 con/m2 hoặc > 60% số dảnh bị nhiễm |
|
Mất trắng |
Giảm trên 70% năng suất (dùng để thống kê cuối các đợt dịch hoặc cuối vụ sản xuất). |
2.7.6. Phương pháp điều tra phát hiện nhóm bệnh hại lá lúa (đạo ôn lá, bạc lá, đốm sọc,...)
2.7.6.1. Số mẫu điều tra của 1 điểm
Toàn bộ số lá của 10 dảnh của 10 khóm lúa ngẫu nhiên/điểm hoặc toàn bộ số lá của 10 dảnh ngẫu nhiên (đối với lúa sạ).
2.7.6.2. Cách điều tra
- Ngoài đồng
Đếm toàn bộ số lá và số lá bị bệnh có trong điểm điều tra; phân cấp lá bị bệnh theo thang 9 cấp:
+ Cấp 1: < 1 % diện tích lá bị bệnh;
+ Cấp 3: từ 1 - 5% diện tích lá bị bệnh;
+ Cấp 5: > 5 - 25% diện tích lá bị bệnh;
+ Cấp 7: > 25 - 50% diện tích lá bị bệnh;
+ Cấp 9: > 50 % diện tích lá bị bệnh.
- Trong phòng
Khi cần thiết, thu mẫu về phòng để theo dõi.
2.7.6.3. Các chỉ tiêu cần theo dõi
- Tỷ lệ, chỉ số bệnh (%);
- Cấp bệnh phổ biến;
- Diện tích bị nhiễm bệnh (ha);
- Diện tích đã xử lý: Thuốc bảo vệ thực vật và các biện pháp khác (ha).
2.7.6.4. Công thức tính
|
Tỷ lệ bệnh (%) |
= |
Tổng số lá bị bệnh |
x 100 |
|
Tổng số lá điều tra |
|||
|
Chỉ số bệnh (%) |
= |
(N1 x 1) + ….. + (Nn x n) |
x 100 |
|
N x 9 |
|||
|
Trong đó: |
N1: là số lá bị bệnh ở cấp 1; Nn: là số lá bị bệnh ở cấp n; N: là tổng số lá điều tra; 9: là cấp bệnh cao nhất của thang phân cấp |
||
|
Diện tích nhiễm dịch hại Xi (ha) |
= |
(N1 x S1) + ….. + (Nn x Sn) |
|
|
10 |
|||
|
Trong đó: |
Xi (ha): Diện tích nhiễm dịch hại ở mức i; N1: Số điểm nhiễm dịch hại của yếu tố thứ 1; S1: Diện tích gieo cấy lúa của yếu tố thứ 1; Nn: Số điểm nhiễm dịch hại của yếu tố thứ n; Sn: Diện tích gieo cấy lúa của yếu tố thứ n; 10: Số điểm điều tra của 1 yếu tố; Mức i: Nhiễm nhẹ, trung bình, nặng |
||
2.7.6.5. Các căn cứ để tính diện tích nhiễm
- Yếu tố điều tra chính (giống, thời vụ, giai đoạn sinh trưởng, địa hình);
- Diện tích gieo cấy của từng yếu tố liên quan;
- Số liệu điều tra của từng yếu tố liên quan;
- Quy định tỷ lệ bệnh để thống kê diện tích nhiễm
|
Mức độ nhiễm |
Bệnh đạo ôn (% lá) |
Bệnh bạc lá, đốm sọc vi khuẩn (% lá) |
|
Nhiễm nhẹ |
5 - 10 |
10 - 20 |
|
Nhiễm trung bình |
> 10 - 20 |
> 20 - 40 |
|
Nhiễm nặng |
> 20 |
> 40 |
|
Mất trắng |
Giảm trên 70% năng suất (dùng để thống kê cuối các đợt dịch hoặc cuối vụ sản xuất). |
|
2.7.7. Phương pháp điều tra phát hiện nhóm bệnh hại toàn thân lúa (bệnh khô vằn, bệnh thối thân, bệnh vàng lùn, lùn xoắn lá, lùn sọc đen, ...)
2.7.7.1. Số mẫu điều tra của 1 điểm
- Đối với bệnh khô vằn: Điều tra 10 dảnh của 10 khóm lúa ngẫu nhiên/điểm.
- Đối với bệnh thối thân, vàng lùn, lùn xoắn lá, lùn sọc đen:
+ Lúa cấy: Điều tra toàn bộ số dảnh của tối thiểu 10 khóm lúa ngẫu nhiên/điểm; nếu trước giai đoạn đẻ nhánh rộ, điều tra toàn bộ số dảnh có trong 20 khóm để có số dảnh tương đương 100 dảnh.
+ Mạ, lúa sạ: Điều tra 100 dảnh liên tiếp ngẫu nhiên/điểm;
2.7.7.2. Cách điều tra
- Ngoài đồng
* Đối với bệnh khô vằn: Mỗi khóm chọn 1 dảnh ngẫu nhiên (lúa cấy) hoặc 10 dảnh ngẫu nhiên (lúa sạ), phân cấp dảnh bị bệnh theo thang 9 cấp:
+ Cấp 1: < 1/4 diện tích bẹ lá bị bệnh;
+ Cấp 3: Từ 1/4 - 1/2 diện tích bẹ lá bị bệnh;
+ Cấp 5: Từ 1/4 - 1/2 diện tích bẹ lá, cộng lá thứ 3, 4 bị bệnh nhẹ;
+ Cấp 7: > 1/2 - 3/4 diện tích bẹ lá và lá phía trên bị bệnh;
+ Cấp 9: Vết bệnh leo tới đỉnh cây lúa, các lá nhiễm nặng, một số cây chết.
* Đối với bệnh thối thân, vàng lùn, lùn xoắn lá: Đếm toàn bộ số dảnh và số dảnh bị bệnh có trong điểm điều tra.
* Phân cấp bệnh thối thân
+ Cấp 1: Ở mặt ngoài của bẹ lúa xuất hiện các đốm bất dạng, nhỏ, màu đen, <1/4 diện tích của lóng thân bị thối, vết thối bao phủ một lớp nấm màu trắng hồng nhạt, các lá vẫn còn xanh, cây lúa không bị đổ
+ Cấp 2: Từ 1/4-1/2 diện tích của lóng thân bị thối, vết thối bao phủ một lớp nấm màu trắng hồng nhạt, vết thối xuất hiện ở 2-3 lóng/thân, một vài lá bị chết, một vài dảnh hoặc khóm bị đổ ngã;
+ Cấp 3: Toàn bộ các lóng thân bị bệnh, cây lúa đổ ngã và khô chết, cây lúa không trỗ bông được hoặc có bông nhưng bông bị khô và lép hoàn toàn.
* Phân cấp bệnh vàng lùn theo thang 3 cấp:
+ Cấp 1: Lá vàng nhạt, có khuynh hướng xòe ngang, rễ vẫn phát triển bình thường; hoặc lúa đẻ nhánh nhiều.
+ Cấp 2: Lá màu vàng cam, hẹp, cứng, cây thấp lùn, mọc nhiều chồi, ít rễ mới.
+ Cấp 3: Lá màu vàng khô, trỗ không thoát, hạt lép nhiều; cả bụi lúa hoặc ruộng lúa khô lụi dần, chết.
* Phân cấp bệnh lùn xoắn lá theo thang 3 cấp:
+ Cấp 1: Lá xanh đậm, cứng hơn bình thường, có biểu hiện nhăn nhẹ, cây chưa thấp lùn.
+ Cấp 2: Cây thấp lùn, lá xoăn màu xanh đậm, rìa lá có thể bị rách và gợn sóng, lá bắt đầu xoăn.
+ Cấp 3: Cây thấp lùn, lá xoăn màu xanh đậm, chóp lá bị biến dạng xoăn tít, mép lá xoăn nhiều, gân lá sưng phồng; trỗ không thoát, hạt lép nhiều; cả bụi lúa hoặc ruộng lúa khô lụi dần, chết.
* Đối với bệnh lùn sọc đen, phân cấp bệnh theo thang 3 cấp:
+ Cấp 1: Lá có biểu hiện nhăn nhẹ, lá màu xanh đậm hơn bình thường, cây chưa thấp lùn.
+ Cấp 2: Cây thấp lùn, lá xoăn màu xanh đậm, phiến lá dày và giòn.
+ Cấp 3: Cây thấp lùn, lá xoăn màu xanh đậm, phiến lá dày và giòn, mặt sau phiến lá và đốt thân có u sáp cổ lá xếp xít nhau; lúa trỗ nghẹn đòng, hạt bị đen lép.
- Trong phòng
Khi cần thiết, thu mẫu về phòng để theo dõi.
2.7.7.3. Các chỉ tiêu cần theo dõi
- Tỷ lệ, chỉ số bệnh (%);
- Cấp bệnh phổ biến;
- Diện tích bị nhiễm bệnh (ha);
- Diện tích đã xử lý: Thuốc bảo vệ thực vật và các biện pháp khác (ha).
2.7.7.4. Công thức tính
|
Tỷ lệ bệnh (%) |
= |
Tổng số dảnh bị bệnh |
x 100 |
|
Tổng số dảnh điều tra |
|||
|
Chỉ số bệnh (%) |
= |
[(N1 x 1) + ….. + (Nn x n)] |
x 100 |
|
N x 9 |
|||
|
Trong đó: |
N1: là số dảnh bị bệnh ở cấp 1; Nn: là số dảnh bị bệnh ở cấp n; N: là tổng số dảnh điều tra; 9: là cấp bệnh cao nhất của thang phân cấp |
||
|
Diện tích nhiễm dịch hại Xi (ha) |
= |
(N1 x S1) + ….. + (Nn x Sn) |
|
|
10 |
|||
|
Trong đó: |
Xi (ha): Diện tích nhiễm dịch hại ở mức i; N1: Số điểm nhiễm dịch hại của yếu tố thứ 1; S1: Diện tích gieo cấy lúa của yếu tố thứ 1; Nn: Số điểm nhiễm dịch hại của yếu tố thứ n; Sn: Diện tích gieo cấy lúa của yếu tố thứ n; 10: Số điểm điều tra của 1 yếu tố; Mức i: Nhiễm nhẹ, trung bình, nặng |
||
2.7.7.5. Các căn cứ để tính diện tích nhiễm
- Yếu tố điều tra chính (giống, thời vụ, địa hình, giai đoạn sinh trưởng, phát triển);
- Diện tích gieo cấy của từng yếu tố liên quan;
- Số liệu điều tra của từng yếu tố liên quan;
- Quy định tỷ lệ bệnh để thống kê diện tích nhiễm
|
Mức độ nhiễm |
Bệnh khô vằn (% cây) |
Bệnh thối thân (% cây) |
Bệnh vàng lùn, lùn xoắn lá, lùn sọc đen |
|
|
Giai đoạn đẻ nhánh (% cây) |
Giai đoạn đòng trở đi (% cây) |
|||
|
Nhiễm nhẹ |
10 - 20 |
5 - 10 |
2,5 - 5 |
5 - 10 |
|
Nhiễm trung bình |
> 20 - 40 |
> 10 - 20 |
> 5 - 10 |
> 10 - 20 |
|
Nhiễm nặng |
> 40 |
> 20 |
> 10 |
> 20 |
|
Mất trắng |
Năng suất giảm trên 70% (dùng để thống kê cuối các đợt dịch hoặc cuối vụ sản xuất). |
|||
2.7.8. Phương pháp điều tra phát hiện nhóm bệnh hại bông và hại lúa (bệnh đạo ôn cổ bông, bệnh hoa cúc, bệnh than đen, bệnh thối hạt vi khuẩn, lem lép hạt, ...)
2.7.8.1. Số mẫu điều tra của 1 điểm
- Đối với bệnh hoa cúc, bệnh than đen, bệnh đạo ôn cổ bông:
+ Lúa cấy: điều tra toàn bộ số bông của 10 khóm lúa ngẫu nhiên/điểm;
+ Lúa sạ: điều tra 100 dảnh ngẫu nhiên liên tiếp/điểm;
- Đối với bệnh thối hạt vi khuẩn, lem lép hạt: Đối với lúa cấy, điều tra 10 bông lúa ngẫu nhiên, đối với lúa sạ chọn 10 bông ngẫu nhiên/điểm.
2.7.8.2. Cách điều tra
- Ngoài đồng
* Điều tra tỷ lệ bông bị bệnh (bệnh hoa cúc, bệnh than đen, bệnh đạo ôn cổ bông, bệnh thối hạt vi khuẩn, lem lép hạt)
+ Lúa cấy: Đếm toàn bộ số bông có trong 10 khóm lúa, đếm số bông bị bệnh.
+ Lúa sạ: Đếm số bông bị bệnh có trong 100 bông điều tra.
* Phân cấp bệnh:
Đối với bệnh hoa cúc, bệnh than đen, bệnh thối hạt vi khuẩn, lem lép hạt: Chọn ngẫu nhiên tối thiểu 3 bông/3 khóm lúa/điểm, đối với lúa sạ chọn ngẫu nhiên tối thiểu 3 bông/điểm, đếm số hạt bị bệnh và phân cấp bông bị bệnh theo thang 9 cấp:
+ Cấp 1: > 0% đến < 1% hạt bị bệnh;
+ Cấp 3: từ 1 - 5% hạt bị bệnh;
+ Cấp 5: > 5 - 25% hạt bị bệnh;
+ Cấp 7: > 25 - 50% hạt bị bệnh;
+ Cấp 9: > 50 % hạt bị bệnh.
- Trong phòng
Khi cần thiết, thu mẫu về phòng để theo dõi.
2.7.8.3. Các chỉ tiêu cần theo dõi
- Tỷ lệ, chỉ số bệnh (%);
- Cấp bệnh phổ biến;
- Diện tích bị nhiễm bệnh (ha);
- Diện tích đã xử lý: Thuốc bảo vệ thực vật và các biện pháp khác (ha).
2.7.8.4. Công thức tính
|
Tỷ lệ bệnh (%) |
= |
Tổng số bông bị bệnh |
x 100 |
|
Tổng số bông điều tra |
|||
|
Chỉ số bệnh (%) |
= |
[(N1 x 1) + ….. + (Nn x n)] |
x 100 |
|
N x 9 |
|||
|
Trong đó: |
N1: là số bông bị bệnh ở cấp 1; Nn: là số bông bị bệnh ở cấp n; N: là tổng số bông điều tra; 9: là cấp bệnh cao nhất của thang phân cấp |
||
|
Diện tích nhiễm dịch hại Xi (ha) |
= |
(N1 x S1) + ….. + (Nn x Sn) |
|
|
10 |
|||
|
Trong đó: |
Xi (ha): Diện tích nhiễm dịch hại ở mức i; N1: Số điểm nhiễm dịch hại của yếu tố thứ 1; S1: Diện tích gieo cấy lúa của yếu tố thứ 1; Nn: Số điểm nhiễm dịch hại của yếu tố thứ n; Sn: Diện tích gieo cấy lúa của yếu tố thứ n; 10: Số điểm điều tra của 1 yếu tố; Mức i: Nhiễm nhẹ, trung bình, nặng |
||
2.7.8.5. Các căn cứ để tính diện tích nhiễm
- Số yếu tố điều tra chính (giống, thời vụ, giai đoạn sinh trưởng, địa hình);
- Diện tích gieo cấy của từng yếu tố liên quan;
- Số liệu điều tra của từng yếu tố liên quan;
- Quy định tỷ lệ bệnh để thống kê diện tích nhiễm
|
Mức độ nhiễm |
Bệnh đạo ôn cổ bông (% bông) |
Bệnh thối hạt vi khuẩn, lem lép hạt (% hạt) |
Bệnh hoa cúc, bệnh than đen (% hạt) |
|
Nhiễm nhẹ |
2,5 - 5 |
5 - 10 |
2,5 - 5 |
|
Nhiễm trung bình |
> 5 - 10 |
> 10 - 20 |
> 5 - 10 |
|
Nhiễm nặng |
> 10 |
> 20 |
> 10 |
|
Mất trắng |
Giảm trên 70% năng suất (dùng để thống kê cuối các đợt dịch hoặc cuối vụ sản xuất). |
||
2.7.9. Phương pháp điều tra phát hiện nhóm chuột, ốc bươu vàng (OBV) hại lúa
2.7.9.1. Số mẫu điều tra của 1 điểm
* Điều tra tỷ lệ dảnh bị hại:
- Mạ, lúa gieo thẳng: 1 khung (40 x 50 cm)/điểm;
- Lúa cấy: Toàn bộ số dảnh của 10 khóm lúa ngẫu nhiên/điểm;
* Điều tra mật độ OBV: 1 m2/điểm.
* Điều tra mật độ trứng OBV: 4 m2/điểm.
2.7.9.2. Cách điều tra
- Ngoài đồng
* Điều tra dảnh bị hại: Đếm toàn bộ số dảnh (bông) có trong khung hoặc 10 khóm lúa và đếm số dảnh, bông bị hại.
* Điều tra mật độ ổ trứng, OBV: Đếm toàn bộ số ốc và số ổ trứng có trong điểm điều tra.
- Trong phòng:
Khi cần thiết, thu mẫu về phòng để theo dõi.
2.7.9.3. Các chỉ tiêu cần theo dõi
- Mật độ OBV (con/m2); mật độ ổ trứng (ổ trứng/m2);
- Tỷ lệ hại (%);
- Diện tích bị nhiễm (ha);
- Diện tích đã xử lý: Thuốc bảo vệ thực vật và các biện pháp khác (ha).
2.7.9.4. Công thức tính
|
Mật độ ổ trứng, OBV/m2 |
= |
Tổng số ổ trứng, OBV điều tra |
|
|
Tổng số m2 điều tra |
|||
|
Tỷ lệ hại (%) |
= |
Tổng số dảnh (bông) bị hại |
x 100 |
|
Tổng số dảnh (bông) điều tra |
|||
|
Diện tích nhiễm dịch hại Xi (ha) |
= |
(N1 x S1) + ….. + (Nn x Sn) |
|
|
10 |
|||
|
Trong đó: |
Xi (ha): Diện tích nhiễm dịch hại ở mức i; N1: Số điểm nhiễm dịch hại của yếu tố thứ 1; S1: Diện tích gieo cấy lúa của yếu tố thứ 1; Nn: Số điểm nhiễm dịch hại của yếu tố thứ n; Sn: Diện tích gieo cấy lúa của yếu tố thứ n; 10: Số điểm điều tra của 1 yếu tố; Mức i: Nhiễm nhẹ, trung bình, nặng |
||
2.7.9.5. Các căn cứ để tính diện tích nhiễm
- Số yếu tố điều tra chính (giống, thời vụ, giai đoạn sinh trưởng, địa hình);
- Diện tích gieo cấy của từng yếu tố liên quan;
- Số liệu điều tra của từng yếu tố liên quan;
- Quy định tỷ lệ hại, mật độ OBV, mật độ trứng để thống kê diện tích nhiễm:
|
Mức độ nhiễm |
Chuột (% dảnh, bông) |
Ốc bươu vàng giai đoạn mạ - đẻ nhánh (ổ trứng, con/m2) |
|
|
Giai đoạn mạ - đẻ nhánh |
Giai đoạn đòng - chín |
||
|
Nhiễm nhẹ |
5 - 10 |
2,5 - 5 |
0,25 - 0,5 ổ trứng/m2 hoặc 1,5 - 3 con/m2 hoặc 5 - 10% dảnh bị hại |
|
Nhiễm tr.bình |
> 10 - 20 |
> 5 - 10 |
> 0,5 - 1 ổ trứng/m2 hoặc > 3 - 6 con/m2 hoặc > 10 - 20% dảnh bị hại |
|
Nhiễm nặng |
> 20 |
> 10 |
> 1 ổ trứng/m2 hoặc > 6 con/m2 hoặc > 20% dảnh bị hại |
|
Mất trắng |
Diện tích phải gieo, cấy lại hoặc giảm trên 70% năng suất (dùng để thống kê cuối các đợt dịch hoặc cuối vụ sản xuất). |
||
2.7.10. Phương pháp điều tra gián tiếp một số dịch hại
2.7.10.1. Sử dụng bẫy đèn
- Đối tượng theo dõi: Theo dõi trưởng thành có tính hướng quang như sâu đục thân, sâu cuốn lá, sâu năn, rầy các loại,...
- Thời gian và địa điểm đặt bẫy:
Liên tục trước và trong vụ lúa và đốt đèn từ 18 hoặc 19 giờ hàng ngày hôm trước đến 5 hoặc 6 giờ ngày hôm sau (tùy theo mùa trong năm).
Địa phương vùng trọng điểm lúa, trọng điểm dịch hại; vị trí đặt bẫy đèn cách nguồn sáng ít nhất 200 m và không bị che khuất.
- Chỉ tiêu theo dõi: Trưởng thành (từng loại sâu)/đèn/đêm; theo dõi thời tiết như nhiệt độ, mưa, trời sáng tối, gió có liên quan đến trưởng thành vào đèn; kết quả điều tra các ruộng đặt bẫy đèn.
2.7.10.2. Sử dụng bẫy chua ngọt
- Đối tượng theo dõi: Theo dõi trưởng thành có tính ăn thêm, ưa thích mùi chua ngọt như sâu cắn gié, sâu keo,...
- Thời gian: Trước và trong những cao điểm xuất hiện trưởng thành trong năm.
- Địa điểm đặt bẫy: Tại một số địa phương vùng trọng điểm lúa, trọng điểm dịch hại.
- Chỉ tiêu theo dõi: Trưởng thành (từng loại sâu)/bẫy/đêm; theo dõi thời tiết như nhiệt độ, mưa, trời sáng tối, gió có liên quan đến trưởng thành vào bẫy; kết quả điều tra các ruộng dưới chân bẫy.
2.7.10.3. Bẫy pheromone và bẫy khác
- Đối tượng theo dõi: Theo dõi trưởng thành có xu tính thích pheromone hoặc các loại bẫy khác.
- Thời gian và địa điểm đặt bẫy:
Trước và trong những cao điểm xuất hiện trưởng thành trong năm.
Tại một số địa phương vùng trọng điểm lúa, trọng điểm dịch hại.
- Chỉ tiêu theo dõi: Trưởng thành (từng loại sâu)/bẫy/đêm; theo dõi thời tiết như nhiệt độ, mưa, trời sáng tối, gió có liên quan đến trưởng thành vào đèn; kết quả điều tra các ruộng dưới chân đèn.
2.7.10.4. Sử dụng bẫy bào tử nấm
- Đối tượng theo dõi: Bệnh đạo ôn hại lúa,...
- Thời gian và địa điểm đặt bẫy:
Trước và trong những cao điểm xuất hiện bệnh; trước mỗi vụ sản xuất và trong giai đoạn cây lúa mẫn cảm với bệnh.
Tại một số địa phương vùng trọng điểm lúa, trọng điểm dịch hại.
- Chỉ tiêu theo dõi: Số bào tử/lam/24 h; theo dõi thời tiết như nhiệt độ, mưa, trời sáng tối, gió có liên quan đến việc thu bào tử.
2.7.10.5. Thu thập và giám định môi giới mang mầm bệnh
- Đối tượng thu thập và giám định: Rầy nâu truyền bệnh vàng lùn, lùn xoắn lá; rầy lưng trắng, rầy nâu nhỏ truyền bệnh lùn sọc đen; rầy xanh đuôi đen truyền bệnh vàng lá di động, tungro,...
- Thời gian: Trước vụ sản xuất, trong giai đoạn lúa còn non và sau các đợt bão.
- Số lượng và địa điểm thu mẫu: Tối thiểu 30 mẫu/đợt; tối thiểu 10 cá thể/mẫu ở tuổi 3, 4, 5, trưởng thành. Địa điểm tại một số địa phương vùng trọng điểm lúa, trọng điểm dịch hại.
- Chỉ tiêu theo dõi: Số mẫu mang mầm bệnh/số mẫu giám định; tỷ lệ mẫu mang mầm bệnh (%). Số mẫu mang mầm bệnh của từng loại bệnh/số mẫu giám định; tỷ lệ mẫu mang mầm bệnh của từng loại bệnh (%).
2.8. Thu thập số liệu, tài liệu và thông báo kết quả
2.8.1. Sổ theo dõi và các tài liệu khác
- Sổ theo dõi:
Sổ theo dõi sinh vật hại, sinh vật có ích vào bẫy;
Sổ ghi chép số liệu điều tra sâu bệnh định kỳ, bổ sung;
Sổ theo dõi diện tích nhiễm thường kỳ, hàng vụ, hàng năm;
Sổ theo dõi thời tiết.
- Tài liệu khác
Cơ sở dữ liệu và phần mềm có liên quan;
Ảnh và các mẫu vật, tiêu bản có liên quan.
2.8.2. Thông báo kết quả điều tra
Theo quy định của Quy chuẩn kỹ thuật quốc gia (QCVN 01-38:2010/BNNPTNT).
2.9. Báo cáo
Theo quy định của Quy chuẩn kỹ thuật quốc gia (QCVN 01-38:2010/BNNPTNT).
2.10. Lưu trữ và khai thác dữ liệu
Tất cả các đơn vị thuộc hệ thống Bảo vệ thực vật phải lưu trữ, hệ thống, quản lý và khai thác dữ liệu điều tra, báo cáo bằng các phương pháp truyền thống kết hợp phát huy lợi thế của công nghệ thông tin.
III. TRÁCH NHIỆM CỦA TỔ CHỨC, CÁ NHÂN
Thực hiện điều tra, kiểm tra và tổng hợp tình hình dịch hại và gửi thông báo định kỳ; Thông báo tháng; thông báo, điện báo đột xuất và các văn bản chỉ đạo; báo cáo diễn biến và kết quả phòng trừ các đợt dịch; báo cáo tổng kết vụ; báo cáo năm, dự báo vụ,... Theo quy định của Quy chuẩn kỹ thuật quốc gia QCVN 01-38:2010/BNNPTNT.
IV. TỔ CHỨC THỰC HIỆN
Cục Bảo vệ thực vật có trách nhiệm tổ chức hướng dẫn và kiểm tra việc thực hiện Quy chuẩn này đối với Hệ thống tổ chức chuyên ngành Bảo vệ và Kiểm dịch thực vật; các tổ chức, cá nhân có hoạt động liên quan đến điều tra phát hiện dịch hại lúa tại Việt Nam./.
Phụ lục 1.
Hướng dẫn điều tra rầy hại thân lúa khi mật độ cao
Khi mật độ rầy nâu, rầy lưng trắng, rầy xám khoảng trên 3.000 con/m2, số mẫu điều tra của một điểm giảm, cụ thể:
- Đối với lúa cấy: dùng khay (20 x 20 x 5 cm) để điều tra từng khóm một như quy định; chia khay làm 4 phần; đếm, phân tuổi số rầy vào khay, số rầy bị ký sinh trong diện tích 1/4 khay đó.
+ Đối với lúa sạ và mạ: dùng khung 40 x 50 cm để điều tra. Đếm trực tiếp số rầy, phân tuổi; số rầy bị ký sinh có trong 1/4 khung.
Phụ lục 2.
Phương pháp theo dõi ký sinh trứng sâu đục thân
Cắt đoạn lá lúa có 1 ổ trứng, một đầu phía trên của lá được kẹp vào miếng bông thấm nước ẩm dùng để nút miệng ống tuýp. Hàng ngày kiểm tra từng ổ trứng riêng biệt vào thời gian nhất định, ghi số sâu non nở và số ong ký sinh nở. Khi không thấy sâu và ong ký sinh nở nữa, nhẹ nhàng gắp ổ trứng đem ngâm vào dung dịch NaOH (KOH) 10% trong thời gian ít nhất là 1 giờ. Nhờ dung dịch NaOH (KOH) 10%, lớp màng keo phía ngoài của ổ trứng sẽ tan ra, dùng kim khêu côn trùng nhẹ nhàng khêu để đếm từng quả trứng chưa nở dưới kính lúp soi nổi côn trùng hoặc kính lúp cầm tay phóng đại 20 lần.
Để có thể tính được tỷ lệ sâu nở, tỷ lệ quả trứng bị ký sinh, tỷ lệ trứng ung không nở: cứ mỗi con ong nở ra được coi là một quả trứng bị ký sinh; mỗi quả trứng không nở được coi là một quả trứng ung.
QUY CHUẨN KỸ THUẬT QUỐC GIA VỀ PHƯƠNG PHÁP ĐIỀU TRA PHÁT HIỆN DỊCH HẠI CÂY NGÔ
National technical regulation on surveillance method of Maize pests
Lời nói đầu
QCVN 01 - 167 : 2014/BNNPTNT do Phòng Bảo vệ thực vật biên soạn, Cục Bảo vệ thực vật trình duyệt, Bộ Nông nghiệp & PTNT ban hành tại Thông tư số 16/TT-BNNPTNT ngày 05 tháng 6 năm 2014.
QUY CHUẨN KỸ THUẬT QUỐC GIA VỀ PHƯƠNG PHÁP ĐIỀU TRA PHÁT HIỆN DỊCH HẠI CÂY NGÔ
National technical regulation on surveillance method of Maize pests
I. QUY ĐỊNH CHUNG
1.1. Phạm vi điều chỉnh
Quy chuẩn này quy định nguyên tắc, nội dung, phương pháp áp dụng trong công tác điều tra phát hiện dịch hại chính và sinh vật có ích trong từng giai đoạn sinh trưởng, phát triển của cây ngô.
1.2. Đối tượng áp dụng
Quy chuẩn này bắt buộc áp dụng trong hệ thống tổ chức chuyên ngành Bảo vệ và Kiểm dịch thực vật; tổ chức, cá nhân có hoạt động điều tra, phát hiện dịch hại cây ngô tại Việt Nam.
1.3. Giải thích từ ngữ
Trong quy chuẩn này các từ ngữ dưới đây được hiểu như sau:
1.3.1. Dịch hại cây ngô (còn gọi là sinh vật gây hại cây ngô)
Là loài, chủng hoặc dạng sinh học thực vật, động vật hoặc vi sinh vật nào gây hại cho cây ngô bao gồm: Côn trùng, nấm bệnh, tuyến trùng, vi khuẩn, virus, phytoplasma, cỏ dại, chuột và các sinh vật khác.
1.3.2. Dịch hại chính
Là những dịch hại thường xuyên xuất hiện phổ biến và hại nặng hàng vụ, hàng năm ở địa phương.
1.3.3. Dịch hại chủ yếu
Là những dịch hại chính, mà tại thời điểm điều tra có mức độ gây hại cao hoặc khả năng lây lan nhanh, phân bố rộng trong điều kiện ngoại cảnh thuận lợi.
1.3.4. Yếu tố điều tra chính
Là các yếu tố đại diện có liên quan đến dịch hại, bao gồm: yếu tố giống, thời vụ, địa hình, giai đoạn sinh trưởng, phát triển của cây ngô và tập quán canh tác.
1.3.5. Khu vực điều tra
Là khu vực trồng ngô đại diện cho các yếu tố điều tra và được chọn cố định để điều tra ngay từ đầu vụ.
1.3.6. Tuyến điều tra
Là tuyến được xác định theo một lịch trình đã định sẵn, theo đường chéo góc của khu vực điều tra và thỏa mãn các yếu tố điều tra chính của khu vực điều tra.
1.3.7. Mẫu điều tra
Là số lượng cây, bộ phận của cây ngô trên đơn vị điểm điều tra.
1.3.8. Điểm điều tra
Là điểm được bố trí tương đối ngẫu nhiên và đồng đều trên tuyến điều tra.
1.3.9. Mật độ dịch hại hoặc mật độ thiên địch bắt mồi ăn thịt
Là số lượng cá thể dịch hại hoặc thiên địch bắt mồi trên một đơn vị diện tích hoặc một đơn vị đối tượng khảo sát.
1.3.10. Tỷ lệ bệnh hoặc tỷ lệ hại
Là số lượng cá thể bị bệnh hoặc bị hại tính theo phần trăm (%) so với tổng số các cá thể điều tra trong quần thể.
1.3.11. Chỉ số bệnh hoặc chỉ số hại
Là đại lượng đặc trưng cho mức độ bị bệnh hoặc bị hại của cây trồng được biểu thị bằng phần trăm (%).
1.3.12. Sinh vật có ích (thiên địch)
Bao gồm vi rút, vi khuẩn, tuyến trùng, nấm, côn trùng, động vật và các sinh vật khác có tác dụng hạn chế tác hại của dịch hại cây ngô.
1.3.13. Điều tra định kỳ
Là hoạt động điều tra thường xuyên của cán bộ bảo vệ thực vật theo một thời gian định trước trên tuyến điều tra thuộc khu vực điều tra nhằm nắm được diễn biến của dịch hại cây ngô và thiên địch của chúng.
1.3.14. Điều tra bổ sung
Là mở rộng tuyến điều tra hoặc tăng số lần điều tra vào các thời kỳ xung yếu của cây ngô và dịch hại đặc thù của vùng sinh thái hoặc trong vùng dịch, vùng đệm, vùng bị dịch uy hiếp, nhằm xác định thời gian phát sinh, diện phân bố và mức độ gây hại của dịch hại chủ yếu trên cây ngô ở địa phương, cũng như sự lây lan hoặc tái phát dịch.
II. QUY ĐỊNH KỸ THUẬT
2.1. Yêu cầu kỹ thuật
Theo Quy chuẩn kỹ thuật quốc gia (QCVN 01-38:2010/BNNPTNT) về phương pháp điều tra phát hiện dịch hại cây trồng.
2.2. Thiết bị và dụng cụ điều tra
Theo Quy chuẩn kỹ thuật quốc gia (QCVN 01-38:2010/BNNPTNT) về phương pháp điều tra phát hiện dịch hại cây trồng.
2.3. Thời gian điều tra
- Điều tra định kỳ: 7 ngày/lần vào các ngày thứ hai và thứ ba hàng tuần trong khu vực điều tra cố định ngay từ đầu vụ.
- Điều tra bổ sung: Tiến hành trước, trong và sau cao điểm xuất hiện gây hại của từng loài dịch hại cây ngô.
2.4. Yếu tố điều tra
Chọn đại diện theo giống, thời vụ, địa hình, giai đoạn sinh trưởng, phát triển của cây ngô và tập quán canh tác.
2.5. Khu vực điều tra
- Vùng trọng điểm: Chọn khu ruộng có diện tích từ 10 ha trở lên đại diện cho các yếu tố điều tra.
- Vùng không trọng điểm: Chọn khu ruộng có diện tích từ 2 ha trở lên đại diện cho các yếu tố điều tra.
2.6. Điểm điều tra
Mỗi yếu tố điều tra 10 điểm ngẫu nhiên hoặc phân bố ngẫu nhiên trên đường chéo của khu vực điều tra. Điểm điều tra phải cách bờ ít nhất 2 mét.
2.7. Phương pháp điều tra
2.7.1. Phương pháp điều tra phát hiện nhóm sâu hại thân, bắp (sâu đục thân, sâu xám) và thiên địch của sâu
2.7.1.1. Số mẫu điều tra của 1 điểm: Tối thiểu 30 cây/điểm.
2.7.1.2. Phương pháp điều tra
- Ngoài đồng:
Đối với sâu đục thân, đếm toàn bộ số cây, bắp ngẫu nhiên và số cây, bắp bị hại có trong điểm điều tra; Trong trường hợp cần thiết, lấy một số cây, bắp bị hại về phòng để tìm sâu phân tuổi phát dục để dự báo thời gian phát sinh và số lượng của lứa sau.
Đối với sâu xám, đếm toàn bộ số cây ngẫu nhiên và số cây bị hại có trong điểm điều tra. Bới đất xung quanh các cây ngô và những cây, lá mới bị sâu kéo xuống đất để tìm sâu. Sau đó đếm trực tiếp số lượng và phân loại từng pha phát dục của sâu.
Cách điều tra sinh vật có ích (thiên địch bắt mồi ăn thịt) tương tự như điều tra sâu hại.
- Trong phòng: Chẻ các cây, bắp bị hại đã lấy ngoài đồng, đếm sâu và phân tuổi, tính tỷ lệ từng độ tuổi (%) và tính mật độ (con/m2).
Khi cần thiết, thu mẫu về phòng để theo dõi ký sinh: Thu ít nhất một lần vào cao điểm rộ của trứng (ít nhất 30 ổ), sâu non, nhộng hoặc trưởng thành (mỗi pha ít nhất 30 cá thể).
2.7.1.3. Các chỉ tiêu cần theo dõi
- Tỷ lệ cây, bắp bị hại (%);
- Mật độ sâu (con/m2);
- Mật độ các loại thiên địch bắt mồi (con/m2);
- Tỷ lệ pha phát dục của sâu (%);
- Tỷ lệ tuổi sâu (%);
- Tỷ lệ ký sinh (%);
- Diện tích bị nhiễm sâu (ha);
- Diện tích đã xử lý: Thuốc bảo vệ thực vật và các biện pháp khác (ha).
2.7.1.4. Công thức tính
|
Mật độ sâu, thiên địch (con/m2) |
= |
Tổng số sâu, thiên địch điều tra |
x 100 |
|
Tổng số m2 điều tra |
|||
|
Tỷ lệ hại (%) |
= |
Tổng số cây, bắp bị hại |
x 100 |
|
Tổng số cây, bắp điều tra |
|||
|
Tỷ lệ pha phát dục (%) |
= |
Tổng số sâu ở từng pha |
x 100 |
|
Tổng số sâu điều tra |
|||
|
Tỷ lệ tuổi sâu (%) |
= |
Tổng số sâu sống ở từng tuổi |
x 100 |
|
Tổng số sâu điều tra |
|||
|
Tỷ lệ ký sinh (%) |
= |
Tổng số ký sinh ở từng pha |
x 100 |
|
Tổng số sâu điều tra ở từng pha |
|||
|
Diện tích nhiễm dịch hại Xi (ha) |
= |
(N1 x S1) + ….. + (Nn x Sn) |
|
|
10 |
|||
|
Trong đó: |
Xi (ha): Diện tích nhiễm dịch hại ở mức i; N1: Số điểm nhiễm dịch hại của yếu tố thứ 1; S1: Diện tích trồng ngô của yếu tố thứ 1; Nn: Số điểm nhiễm dịch hại của yếu tố thứ n; Sn: Diện tích trồng ngô của yếu tố thứ n; 10: Số điểm điều tra của 1 yếu tố; Mức i: Nhiễm nhẹ, trung bình, nặng |
||
2.7.1.5. Các căn cứ để tính diện tích nhiễm
- Cơ cấu giống, thời vụ
- Số liệu điều tra của từng yếu tố liên quan
- Tỷ lệ hại, mật độ sâu quy định để thống kê diện tích nhiễm
|
Mức độ nhiễm |
Sâu đục thân, bắp |
Sâu xám |
|
Nhiễm nhẹ |
10 - 20 % cây, bắp |
5 - 10 % cây bị hại; hoặc 1 - 2 (con/m2) |
|
Nhiễm trung bình |
> 20 - 40 % cây, bắp |
> 10 - 20 % cây bị hại; hoặc > 2 - 4 (con/m2) |
|
Nhiễm nặng |
> 40 % cây, bắp |
> 20 % cây bị hại; hoặc > 4 (con/m2) |
|
Mất trắng |
Diện tích gieo trồng lại hoặc giảm trên 70% năng suất (dùng để thống kê cuối các đợt dịch hoặc cuối vụ sản xuất). |
|
2.7.2. Phương pháp điều tra phát hiện nhóm sâu hại lá ngô (sâu cắn lá, sâu gai) và thiên địch
2.7.2.1. Số mẫu điều tra của 1 điểm: 01 m2/điểm
2.7.2.2. Phương pháp điều tra
- Ngoài đồng:
Đếm toàn bộ số sâu có trong điểm điều tra (lưu ý lá loa kèn), phân phát dục của sâu.
Riêng đối với sâu cắn lá ngô: Trong trường hợp cần thiết, lấy một số cây, bắp có vết hại và bới lớp đất sâu khoảng 2 cm để tìm nhộng để dự đoán thời gian phát sinh và số lượng sâu đợt sau.
Cách điều tra sinh vật có ích (thiên địch bắt mồi ăn thịt) tương tự như điều tra sâu hại.
- Trong phòng:
Khi cần thiết, thu mẫu về phòng để theo dõi ký sinh: Thu ít nhất một lần vào cao điểm rộ của trứng tối thiểu 50 quả; cao điểm sâu non, nhộng hoặc trưởng thành (mỗi pha ít nhất 30 cá thể).
2.7.2.3. Các chỉ tiêu cần theo dõi
- Mật độ sâu (con/m2);
- Mật độ các loại thiên địch bắt mồi ăn thịt (con/m2);
- Tỷ lệ pha phát dục của sâu (%);
- Tỷ lệ tuổi sâu (%);
- Tỷ lệ ký sinh (%);
- Diện tích bị nhiễm sâu (ha);
- Diện tích đã xử lý: Thuốc bảo vệ thực vật và các biện pháp khác (ha).
2.7.2.4. Công thức tính
|
Mật độ sâu, thiên địch (con/m2) |
= |
Tổng số sâu, thiên địch điều tra |
x 100 |
|
Tổng số m2 điều tra |
|||
|
Tỷ lệ pha phát dục (%) |
= |
Tổng số sâu ở từng pha |
x 100 |
|
Tổng số sâu điều tra |
|||
|
Tỷ lệ tuổi sâu (%) |
= |
Tổng số sâu sống ở từng tuổi |
x 100 |
|
Tổng số sâu điều tra |
|||
|
Tỷ lệ ký sinh (%) |
= |
Tổng số ký sinh ở từng pha |
x 100 |
|
Tổng số sâu điều tra ở từng pha |
|||
|
Diện tích nhiễm dịch hại Xi (ha) |
= |
(N1 x S1) + ….. + (Nn x Sn) |
|
|
10 |
|||
|
Trong đó: |
Xi (ha): Diện tích nhiễm dịch hại ở mức i; N1: Số điểm nhiễm dịch hại của yếu tố thứ 1; S1: Diện tích trồng ngô của yếu tố thứ 1; Nn: Số điểm nhiễm dịch hại của yếu tố thứ n; Sn: Diện tích trồng ngô của yếu tố thứ n; 10: Số điểm điều tra của 1 yếu tố; Mức i: Nhiễm nhẹ, trung bình, nặng |
||
2.7.2.5. Các căn cứ để tính diện tích nhiễm
- Cơ cấu giống, thời vụ
- Số liệu điều tra của từng yếu tố liên quan
- Mật độ sâu, trưởng thành quy định để thống kê diện tích nhiễm:
|
Mức độ nhiễm |
Sâu gai (con/m2) |
Sâu cắn lá (con/m2) |
|
|
Giai đoạn loa kèn |
Giai đoạn trỗ cờ - phun râu |
||
|
Nhiễm nhẹ |
5 - 10 sâu trưởng thành; hoặc 50 - 100 sâu non |
10 - 20 sâu trưởng thành; hoặc 100 - 200 sâu non |
2,5 - 5 |
|
Nhiễm tr.bình |
> 10 - 20 sâu trưởng thành; hoặc > 100 - 200 sâu non |
> 20 - 40 sâu trưởng thành; hoặc > 200 - 400 sâu non |
> 5 - 10 |
|
Nhiễm nặng |
> 20 sâu trưởng thành; hoặc > 200 sâu non |
> 40 sâu trưởng thành; hoặc > 400 sâu non |
> 20 |
|
Mất trắng |
Giảm trên 70% năng suất (dùng để thống kê cuối các đợt dịch hoặc cuối vụ sản xuất). |
||
2.7.3. Phương pháp điều tra phát hiện rệp cờ
2.7.3.1. Số mẫu điều tra của 1 điểm: 01 m2/điểm
2.7.3.2. Cách điều tra
- Ngoài đồng:
Đếm toàn bộ cây và số cây có rệp cờ có trong điểm điều tra.
Phân các cây bị nhiễm rệp theo 3 cấp:
+ Cấp 1 (nhẹ): rệp xuất hiện rải rác;
+ Cấp 2 (trung bình): rệp phân bố dưới 1/3 cờ;
+ Cấp 3 (nặng): rệp phân bố từ 1/3 cờ.
Cách điều tra sinh vật có ích (thiên địch bắt mồi ăn thịt) tương tự như điều tra sâu hại.
- Trong phòng:
Khi cần thiết, thu mẫu về phòng theo dõi (mỗi pha ít nhất 30 cá thể).
2.7.3.3. Các chỉ tiêu cần theo dõi
- Tỷ lệ cây bị hại (%);
- Chỉ số cây bị hại (%);
- Diện tích nhiễm (ha);
- Mật độ thiên địch;
- Diện tích đã xử lý (ha): Thuốc bảo vệ thực vật và các biện pháp khác.
2.7.3.4. Công thức tính
|
Mật độ thiên địch (con/m2) |
= |
Tổng số thiên địch điều tra |
|
|
Tổng số m2 điều tra |
|||
|
Tỷ lệ cây bị hại (%) |
= |
Tổng số cây bị hại |
x 100 |
|
Tổng số cây điều tra |
|||
|
Chỉ số hại (%) |
= |
(N1 x 1) + (N2 x 2) + (N3 x 3) |
x 100 |
|
N x 3 |
- Số liệu điều tra của từng yếu tố liên quan
- Mật độ sâu, trưởng thành quy định để thống kê diện tích nhiễm:
|
Mức độ nhiễm |
Sâu gai (con/m2) |
Sâu cắn lá (con/m2) |
|
|
Giai đoạn loa kèn |
Giai đoạn trỗ cờ - phun râu |
||
|
Nhiễm nhẹ |
5 - 10 sâu trưởng thành; hoặc 50 - 100 sâu non |
10 - 20 sâu trưởng thành; hoặc 100 - 200 sâu non |
2,5 - 5 |
|
Nhiễm tr.bình |
> 10 - 20 sâu trưởng thành; hoặc > 100 - 200 sâu non |
> 20 - 40 sâu trưởng thành; hoặc > 200 - 400 sâu non |
> 5 - 10 |
|
Nhiễm nặng |
> 20 sâu trưởng thành; hoặc > 200 sâu non |
> 40 sâu trưởng thành; hoặc > 400 sâu non |
> 20 |
|
Mất trắng |
Giảm trên 70% năng suất (dùng để thống kê cuối các đợt dịch hoặc cuối vụ sản xuất). |
||
2.7.3. Phương pháp điều tra phát hiện rệp cờ
2.7.3.1. Số mẫu điều tra của 1 điểm: 01 m2/điểm
2.7.3.2. Cách điều tra
- Ngoài đồng:
Đếm toàn bộ cây và số cây có rệp cờ có trong điểm điều tra.
Phân các cây bị nhiễm rệp theo 3 cấp:
+ Cấp 1 (nhẹ): rệp xuất hiện rải rác;
+ Cấp 2 (trung bình): rệp phân bố dưới 1/3 cờ;
+ Cấp 3 (nặng): rệp phân bố từ 1/3 cờ.
Cách điều tra sinh vật có ích (thiên địch bắt mồi ăn thịt) tương tự như điều tra sâu hại.
- Trong phòng:
Khi cần thiết, thu mẫu về phòng theo dõi (mỗi pha ít nhất 30 cá thể).
2.7.3.3. Các chỉ tiêu cần theo dõi
- Tỷ lệ cây bị hại (%);
- Chỉ số cây bị hại (%);
- Diện tích nhiễm (ha);
- Mật độ thiên địch;
- Diện tích đã xử lý (ha): Thuốc bảo vệ thực vật và các biện pháp khác.
2.7.3.4. Công thức tính
|
Mật độ thiên địch (con/m2) |
= |
Tổng số thiên địch điều tra |
|
|
Tổng số m2 điều tra |
|||
|
Tỷ lệ cây bị hại (%) |
= |
Tổng số cây bị hại |
x 100 |
|
Tổng số cây điều tra |
|||
|
Chỉ số hại (%) |
= |
(N1 x 1) + (N2 x 2) + (N3 x 3) |
x 100 |
|
N x 3 |
|||
|
Trong đó: |
N1 là số cây bị rệp ở cấp 1; N2 là số cây bị rệp ở cấp 2; N3 là số cây bị rệp ở cấp 3; N: là tổng số cây điều tra 3: là cấp bệnh cao nhất trong thang phân cấp. |
||
|
Diện tích nhiễm dịch hại Xi (ha) |
= |
(N1 x S1) + ….. + (Nn x Sn) |
|
|
10 |
|||
|
Trong đó: |
Xi (ha): Diện tích nhiễm dịch hại ở mức i; N1: Số điểm nhiễm dịch hại của yếu tố thứ 1; S1: Diện tích trồng ngô của yếu tố thứ 1; Nn: Số điểm nhiễm dịch hại của yếu tố thứ n; Sn: Diện tích trồng ngô của yếu tố thứ n; 10: Số điểm điều tra của 1 yếu tố; Mức i: Nhiễm nhẹ, trung bình, nặng |
||
2.7.3.5. Các căn cứ để tính diện tích nhiễm
- Cơ cấu giống, thời vụ
- Số liệu điều tra của từng yếu tố liên quan
- Quy định tỷ lệ cây bị hại để thống kê diện tích nhiễm:
+ Diện tích nhiễm nhẹ là diện tích có tỷ lệ hại từ 15 - 30% số cây;
+ Diện tích nhiễm trung bình là diện tích có tỷ lệ hại từ trên 30 - 60% số cây;
+ Diện tích nhiễm nặng là diện tích có tỷ lệ hại từ trên 60% cây;
+ Diện tích mất trắng là tổng số diện tích cộng dồn do rệp làm giảm trên 70% năng suất (thống kê cuối các đợt dịch hoặc cuối vụ sản xuất).
2.7.4. Phương pháp điều tra phát hiện nhóm bệnh hại lá ngô (bệnh gỉ sắt, bệnh đốm lá lớn, bệnh đốm lá nhỏ)
2.7.4.1. Số mẫu điều tra của 1 điểm: Điều tra 10 lá ngẫu nhiên/điểm.
2.7.4.2. Cách điều tra
- Ngoài đồng:
Mỗi điểm chọn 10 lá ngẫu nhiên (lá non, lá bánh tẻ, lá già), đếm số lá bị bệnh và phân cấp lá bị bệnh theo thang 9 cấp:
Cấp 1: < 1 diện tích lá bị bệnh;
Cấp 3: từ 1 - 5 diện tích lá bị bệnh;
Cấp 5: > 5 - 25 diện tích lá bị bệnh;
Cấp 7: > 25 - 50 diện tích lá bị bệnh;
Cấp 9: > 50 diện tích lá bị bệnh
- Trong phòng: Khi cần thiết, thu mẫu về phòng để theo dõi.
2.7.4.3. Các chỉ tiêu cần theo dõi
- Tỷ lệ, chỉ số bệnh (%);
- Cấp bệnh phổ biến;
- Diện tích bị nhiễm bệnh (ha);
- Diện tích đã xử lý: Thuốc bảo vệ thực vật và các biện pháp khác (ha).
2.7.4.4. Công thức tính
|
Tỷ lệ bệnh (%) |
= |
Tổng số lá bị bệnh |
x 100 |
|
Tổng số lá điều tra |
|||
|
Chỉ số bệnh (%) |
= |
(N1 x 1) + (N2 x 2) + (N3 x 3) |
x 100 |
|
N x 9 |
|||
|
Trong đó: |
N1 là số cây bị bệnh ở cấp 1; N2 là số cây bị bệnh ở cấp 2; N3 là số cây bị bệnh ở cấp 3; N: là tổng số cây điều tra 9: là cấp bệnh cao nhất trong thang phân cấp. |
||
|
Diện tích nhiễm dịch hại Xi (ha) |
= |
(N1 x S1) + ….. + (Nn x Sn) |
|
|
10 |
|||
|
Trong đó: |
Xi (ha): Diện tích nhiễm dịch hại ở mức i; N1: Số điểm nhiễm dịch hại của yếu tố thứ 1; S1: Diện tích trồng ngô của yếu tố thứ 1; Nn: Số điểm nhiễm dịch hại của yếu tố thứ n; Sn: Diện tích trồng ngô của yếu tố thứ n; 10: Số điểm điều tra của 1 yếu tố; Mức i: Nhiễm nhẹ, trung bình, nặng |
||
2.7.4.5. Các căn cứ để tính diện tích nhiễm
- Cơ cấu giống, thời vụ
- Số liệu điều tra của từng yếu tố liên quan
- Tỷ lệ bệnh quy định để thống kê diện tích nhiễm:
+ Diện tích nhiễm nhẹ là diện tích có tỷ lệ bệnh từ 15 - 30% số lá;
+ Diện tích nhiễm trung bình là diện tích có tỷ lệ bệnh từ trên 30 - 60% số lá;
+ Diện tích nhiễm nặng là diện tích có tỷ lệ bệnh trên 60% số lá;
+ Diện tích mất trắng: Là tổng số diện tích cộng dồn do bệnh làm giảm trên 70% năng suất (dùng để thống kê cuối các đợt dịch hoặc cuối mỗi vụ sản xuất).
2.7.5. Phương pháp điều tra phát hiện bệnh khô vằn, phấn đen và bệnh hại toàn thân ngô (bệnh héo vi khuẩn, bệnh bạch tạng,...)
2.7.5.1. Số mẫu điều tra của 1 điểm: Điều tra 30 cây ngẫu nhiên/điểm hoặc số bắp của 30 cây/điểm.
2.7.5.2. Cách điều tra
- Ngoài đồng:
Đếm số cây hoặc bắp bị bệnh có trong điểm điều tra.
Phân cấp bệnh khô vằn theo thang 9 cấp:
Cấp 1: < ![]() diện tích bẹ lá bị bệnh;
diện tích bẹ lá bị bệnh;
Cấp 3: từ ![]() -
- ![]() diện tích bẹ
lá bị bệnh;
diện tích bẹ
lá bị bệnh;
Cấp 5: từ ![]() -
- ![]() diện tích bẹ lá
bị bệnh và lá thứ 3, 4 bị bệnh nhẹ;
diện tích bẹ lá
bị bệnh và lá thứ 3, 4 bị bệnh nhẹ;
Cấp 7: > ![]() -
- ![]() diện tích bẹ
lá bị bệnh và lá phía trên bị bệnh;
diện tích bẹ
lá bị bệnh và lá phía trên bị bệnh;
Cấp 9: Vết bệnh leo tới đỉnh cây, các lá nhiễm nặng, một số cây chết
- Trong phòng: Khi cần thiết, thu mẫu về phòng để theo dõi.
2.7.5.3. Các chỉ tiêu cần theo dõi
- Tỷ lệ, chỉ số bệnh (%);
- Cấp bệnh phổ biến;
- Diện tích bị nhiễm bệnh: (ha);
- Diện tích đã xử lý: Thuốc bảo vệ thực vật và các biện pháp khác (ha).
2.7.5.4. Công thức tính
|
Tỷ lệ bệnh (%) |
= |
Tổng số cây, bắp bị bệnh |
x 100 |
|
Tổng số cây, bắp điều tra |
|||
|
Chỉ số bệnh (%) |
= |
(N1 x 1) + (N2 x 2) + (N3 x 3) |
x 100 |
|
N x 9 |
|||
|
Trong đó: |
N1 là số cây bị bệnh ở cấp 1; N2 là số cây bị bệnh ở cấp 2; N3 là số cây bị bệnh ở cấp 3; N: là tổng số cây điều tra 9: là cấp bệnh cao nhất trong thang phân cấp. |
||
2.7.5.5. Các căn cứ để tính diện tích nhiễm
- Cơ cấu giống, thời vụ
- Số liệu điều tra của từng yếu tố liên quan
- Tỷ lệ bệnh quy định để thống kê diện tích nhiễm:
|
Mức độ nhiễm |
Bệnh khô vằn (% cây) |
Bệnh héo vi khuẩn (% cây) |
Bệnh bạch tạng (% cây) |
Bệnh phấn đen (% bắp) |
|
Nhiễm nhẹ |
10 - 20 |
5 - 10 |
5 - 10 |
2,5 - 5 |
|
Nhiễm trung bình |
> 20 - 40 |
> 10 - 20 |
> 10 - 20 |
> 5 - 10 |
|
Nhiễm nặng |
> 40 |
> 20 |
> 20 |
> 10 |
|
Mất trắng |
Giảm trên 70% năng suất (dùng để thống kê cuối các đợt dịch hoặc cuối mỗi vụ sản xuất). |
|||
2.7.6. Phương pháp điều tra phát hiện bệnh nhóm bệnh virut hại ngô (bệnh khảm lá ngô, bệnh khảm lùn cây ngô, bệnh lùn nhám cây ngô, bệnh lùn sọc đen).
2.7.6.1. Số mẫu điều tra của 1 điểm
Điều tra tối thiểu 30 cây hoặc 30 lá ngẫu nhiên/điểm.
2.7.6.2. Phương pháp điều tra
- Ngoài đồng: Đếm số cây và số cây bị bệnh để tính tỷ lệ bệnh, chỉ số bệnh.
- Trong phòng: Khi cần thiết thu thập mẫu bệnh để kiểm tra.
2.7.6.3. Các chỉ tiêu cần theo dõi
- Tỷ lệ bệnh, chỉ số bệnh (%);
- Cấp bệnh phổ biến;
- Diện tích bị nhiễm bệnh (ha);
- Diện tích đã xử lý: Thuốc bảo vệ thực vật và các biện pháp khác (ha).
2.7.6.4. Công thức tính
|
Tỷ lệ bệnh (%) |
= |
Số cây hoặc lá bệnh |
x 100 |
|
Tổng số cây hoặc lá điều tra |
|||
|
Chỉ số bệnh (%) |
= |
(N1 x 1) + (N2 x 2) + (N3 x 3) |
x 100 |
|
N x 3 |
|||
|
Trong đó: |
N1: là số lá bị bệnh ở cấp 1; N2: là số lá bị bệnh ở cấp 2; N3: là số lá bị bệnh ở cấp 3; N: là tổng số lá điều tra 3: là cấp bệnh cao nhất trong thang phân cấp. |
||
|
Diện tích nhiễm dịch hại Xi (ha) |
= |
(N1 x S1) + ….. + (Nn x Sn) |
|
|
10 |
|||
|
Trong đó: |
Xi (ha): Diện tích nhiễm dịch hại ở mức i; N1: Số điểm nhiễm dịch hại của yếu tố thứ 1; S1: Diện tích trồng ngô của yếu tố thứ 1; Nn: Số điểm nhiễm dịch hại của yếu tố thứ n; Sn: Diện tích trồng ngô của yếu tố thứ n; 10: Số điểm điều tra của 1 yếu tố; Mức i: Nhiễm nhẹ, trung bình, nặng |
||
2.7.6.5. Các căn cứ để tính diện tích nhiễm
- Cơ cấu giống, thời vụ;
- Số liệu điều tra của từng yếu tố liên quan;
- Tỷ lệ bệnh quy định để thống kê diện tích nhiễm:
|
Mức độ nhiễm |
Lùn sọc đen (% cây) |
Lùn nhám |
Khảm lùn |
Khảm lá (% lá) |
|
|
3 - 6 lá |
Xoắy nõn |
||||
|
Nhiễm nhẹ |
2,5 - 5 |
5 - 10 |
2,5 - 5 |
5 - 10 |
10 - 20 |
|
Nhiễm tr.bình |
> 5 - 10 |
> 10 - 20 |
> 5 - 10 |
10 - 20 |
> 20 - 40 |
|
Nhiễm nặng |
> 10 |
> 20 |
> 10 |
> 20 |
> 40 |
|
Mất trắng |
Giảm trên 70% năng suất (dừng để thống kê cuối các đợt dịch hoặc cuối mỗi vụ sản xuất). |
||||
Quy định phân cấp cây bị bệnh theo thang 3 cấp:
* Đối với bệnh lùn sọc đen (% cây)
+ Cấp 1: Lá có biểu hiện nhăn nhẹ, cây chưa thấp lùn.
+ Cấp 2: Cây thấp lùn, lá xoăn màu xanh đậm, phiến lá dày và giòn.
+ Cấp 3: Cây thấp lùn, lá xoăn màu xanh đậm, phiến lá dày và giòn, mặt sau phiến lá và đốt thân có u sáp cổ lá xếp xít nhau.
* Đối với bệnh lùn nhám cây ngô (% cây)
Đếm toàn bộ số cây, bắp điều tra và số cây, bắp bị bệnh có trong điểm điều tra
+ Cấp 1: Gân lá vàng và dày;
+ Cấp 2: Gân lá vàng, dày và nhăn;
+ Cấp 3: Các lá non cuộn tròn lên mọc thành chùm, cây còi cọc
* Đối với bệnh khảm lùn cây ngô (% cây)
+ Cấp 1: có hiện tượng khảm ở lá non và lá bánh tẻ;
+ Cấp 2: có triệu chứng khảm rõ ràng, lá co ngắn;
+ Cấp 3: có triệu chứng khảm rõ ràng, lá co ngắn, cây thấp.
* Đối với bệnh khảm lá (% lá)
+ Cấp 1: Lá có đốm màu vàng;
+ Cấp 2: Lá có đốm màu vàng và có sọc trên lá cây;
+ Cấp 3: Lá có đốm màu vàng, có sọc trên lá cây, cây còi cọc.
2.7.7. Phương pháp điều tra phát hiện chuột hại ngô
2.7.7.1. Số mẫu điều tra của 1 điểm: Tối thiểu 30 cây ngẫu nhiên/điểm.
2.7.7.2. Cách điều tra ngoài đồng
Đếm toàn bộ số cây, bắp và số cây, bắp bị chuột gây hại có trong điểm điều tra.
2.7.7.3. Các chỉ tiêu cần theo dõi
- Tỷ lệ hại (%);
- Diện tích bị nhiễm (ha);
- Diện tích đã xử lý thuốc bảo vệ thực vật và các biện pháp khác (ha).
2.7.7.4. Công thức tính
|
Tỷ lệ hại (%) |
= |
Tổng số cây, bắp bị hại |
x 100 |
|
Tổng số cây, bắp điều tra |
2.7.7.5. Các căn cứ để tính diện tích nhiễm
- Số yếu tố điều tra chính (giống, thời vụ, giai đoạn sinh trưởng, chân đất);
- Diện tích gieo cấy của từng yếu tố liên quan;
- Số liệu điều tra của từng yếu tố liên quan;
- Quy định tỷ lệ hại để thống kê diện tích nhiễm:
|
Mức độ nhiễm |
Giai đoạn cây con (% cây) |
Giai đoạn trỗ cờ, Phun râu (% cây, bắp) |
|
Nhiễm nhẹ |
5 - 10 |
2,5 - 5 |
|
Nhiễm trung bình |
> 10 - 20 |
> 5 - 10 |
|
Nhiễm nặng |
> 20 |
> 10 |
|
Mất trắng |
Giảm trên 70% năng suất (dùng để thống kê cuối các đợt dịch hoặc cuối mỗi vụ sản xuất). |
|
2.8. Thu thập số liệu, tài liệu và thông báo kết quả
2.8.1. Sổ theo dõi và các tài liệu khác
- Sổ theo dõi:
Sổ theo dõi dịch hại và sinh vật có ích vào bẫy, bả;
Sổ ghi chép số liệu điều tra sâu bệnh định kỳ, bổ sung;
Sổ theo dõi diện tích nhiễm thường kỳ, hàng vụ, hàng năm;
Sổ theo dõi thời tiết.
- Tài liệu khác
Cơ sở dữ liệu và phần mềm có liên quan;
Ảnh và các mẫu vật, tiêu bản có liên quan.
2.8.2. Thông báo kết quả điều tra
Theo quy định của Quy chuẩn kỹ thuật quốc gia về phương pháp điều tra phát hiện dịch hại cây trồng (QCVN 01-38:2010/BNNPTNT).
2.9. Báo cáo
Theo quy định của Quy chuẩn kỹ thuật quốc gia về phương pháp điều tra phát hiện dịch hại cây trồng (QCVN 01-38:2010/BNNPTNT).
2.10. Lưu giữ và khai thác dữ liệu
Tất cả các đơn vị thuộc hệ thống Bảo vệ thực vật phải lưu giữ, hệ thống, quản lý và khai thác dữ liệu điều tra, báo cáo bằng các phương pháp truyền thống kết hợp phát huy lợi thế của công nghệ thông tin.
III. TRÁCH NHIỆM CỦA TỔ CHỨC
Thực hiện điều tra, kiểm tra và tổng hợp tình hình dịch hại và gửi thông báo định kỳ; Thông báo tháng; thông báo, điện báo đột xuất và các văn bản chỉ đạo; báo cáo diễn biến và kết quả phòng trừ các đợt dịch; báo cáo tổng kết vụ; dự báo vụ, năm... Theo quy định trong Quy chuẩn Kỹ thuật quốc gia (QCVN 01-38:2010/BNNPTNT) về phương pháp điều tra phát hiện dịch hại cây trồng.
IV. TỔ CHỨC THỰC HIỆN
Cục Bảo vệ thực vật có trách nhiệm tổ chức hướng dẫn và kiểm tra việc thực hiện Quy chuẩn này đối với Hệ thống tổ chức chuyên ngành Bảo vệ và Kiểm dịch thực vật; các tổ chức, cá nhân có hoạt động liên quan đến điều tra phát hiện dịch hại cây ngô tại Việt Nam./.
QUY CHUẨN KỸ THUẬT QUỐC GIA VỀ PHƯƠNG PHÁP ĐIỀU TRA PHÁT HIỆN DỊCH HẠI TRÊN CÂY LẠC, ĐẬU TƯƠNG
National technical regulation on surveillance method of Peanut and Soybean pests
Lời nói đầu
QCVN 01 - 168 : 2014/BNNPTNT do Phòng Bảo vệ thực vật biên soạn, Cục Bảo vệ thực vật trình duyệt, Bộ Nông nghiệp & PTNT ban hành tại Thông tư số 16/TT-BNNPTNT ngày 05 tháng 6 năm 2014.
QUY CHUẨN KỸ THUẬT QUỐC GIA VỀ PHƯƠNG PHÁP ĐIỀU TRA PHÁT HIỆN DỊCH HẠI TRÊN CÂY LẠC, ĐẬU TƯƠNG
National technical regulation on surveillance method of Peanut and Soybean pests
I. QUY ĐỊNH CHUNG
1.1. Phạm vi điều chỉnh
Quy chuẩn này quy định nguyên tắc, nội dung, phương pháp áp dụng trong công tác điều tra phát hiện dịch hại chủ yếu và sinh vật có ích trong từng giai đoạn sinh trưởng, phát triển của cây lạc, đậu tương, phục vụ cho dự tính dự báo và phòng trừ dịch hại hiệu quả, an toàn.
1.2. Đối tượng áp dụng
Quy chuẩn này bắt buộc áp dụng trong Hệ thống tổ chức chuyên ngành Bảo vệ và Kiểm dịch thực vật; tổ chức, cá nhân có hoạt động điều tra, phát hiện dịch hại cây lạc, đậu tương tại Việt Nam.
1.3. Giải thích từ ngữ
Trong quy chuẩn này, các thuật ngữ dưới đây được hiểu như sau:
1.3.1. Dịch hại lạc, đậu tương (còn gọi là sinh vật gây hại lạc, đậu tương)
Là bất cứ loài, chủng hoặc dạng sinh học thực vật, động vật hoặc vi sinh vật gây hại cho cây lạc, đậu tương; bao gồm: côn trùng, nhện, nấm bệnh, tuyến trùng, vi khuẩn, virus, phytoplasma, cỏ dại, chuột và các sinh vật khác.
1.3.2. Dịch hại chính
Là những dịch hại thường xuyên xuất hiện phổ biến và hại nặng hàng vụ, hàng năm ở địa phương.
1.3.3. Dịch hại chủ yếu
Là những dịch hại chính, mà tại thời điểm điều tra có mức độ gây hại cao hoặc khả năng lây lan nhanh, phân bố rộng trong điều kiện ngoại cảnh thuận lợi.
1.3.4. Yếu tố điều tra chính
Là các yếu tố đại diện có liên quan đến dịch hại, bao gồm yếu tố giống, thời vụ, địa hình (chân đất), giai đoạn sinh trưởng, phát triển của cây lạc, đậu tương và tập quán canh tác.
1.3.5. Khu vực điều tra
Là khu đồng, ruộng đại diện cho các yếu tố điều tra và được chọn cố định để điều tra ngay từ đầu vụ.
1.3.6. Tuyến điều tra
Là tuyến được xác định theo một lịch trình đã định sẵn, theo đường chéo góc của khu vực điều tra và thỏa mãn các yếu tố điều tra chính của khu vực điều tra.
1.3.7. Mẫu điều tra
Là số lượng cây hoặc bộ phận của cây lạc, đậu tương (lá, thân, cành, củ, quả, rễ,...) trên đơn vị điểm điều tra.
1.3.8. Điểm điều tra
Là điểm được bố trí tương đối ngẫu nhiên và đồng đều trên tuyến điều tra.
1.3.9. Mật độ dịch hại hoặc thiên địch bắt mồi
Là số lượng cá thể dịch hại hoặc thiên địch bắt mồi trên một đơn vị diện tích hoặc một đơn vị đối tượng khảo sát.
1.3.10. Tỷ lệ bệnh hoặc tỷ lệ hại
Là số lượng mẫu điều tra bị bệnh hoặc bị hại, tính theo phần trăm (%) so với tổng số mẫu điều tra.
1.3.11. Chỉ số bệnh hoặc chỉ số hại
Là đại lượng đặc trưng cho mức độ bị bệnh hoặc bị hại của cây trồng được biểu thị bằng phần trăm (%).
1.3.12. Sinh vật có ích (thiên địch)
Bao gồm virus, vi khuẩn, tuyến trùng, nấm, côn trùng, động vật và các sinh vật khác có tác dụng hạn chế tác hại của dịch hại đối với cây lạc, đậu tương.
1.3.13. Điều tra định kỳ
Là hoạt động điều tra thường xuyên của cán bộ bảo vệ thực vật trong khoảng thời gian định trước trên tuyến điều tra thuộc khu vực điều tra nhằm nắm được diễn biến của dịch hại cây lạc, đậu tương và thiên địch của chúng.
1.3.14. Điều tra bổ sung
Là mở rộng tuyến điều tra hoặc tăng số lần điều tra vào các thời kỳ xung yếu của cây lạc, đậu tương và dịch hại đặc thù của vùng sinh thái hoặc trong vùng dịch, vùng đệm, vùng bị dịch uy hiếp, nhằm xác định chính xác thời gian phát sinh, diện phân bố và mức độ gây hại của dịch hại chủ yếu trên cây lạc, đậu tương ở địa phương, cũng như sự lây lan, tái phát dịch.
II. QUY ĐỊNH KỸ THUẬT
2.1. Yêu cầu kỹ thuật
Theo Quy chuẩn kỹ thuật Quốc gia (QCVN 01-38:2010/BNNPTNT) về phương pháp điều tra phát hiện dịch hại cây trồng.
2.2. Thiết bị và dụng cụ điều tra
Theo Quy chuẩn kỹ thuật Quốc gia (QCVN 01-38:2010/BNNPTNT) về phương pháp điều tra phát hiện dịch hại cây trồng.
2.3. Thời gian điều tra
2.3.1. Điều tra định kỳ: 7 ngày/lần ở tuyến điều tra với các yếu tố điều tra trong khu vực điều tra cố định ngay từ đầu vụ vào các ngày thứ 2, thứ 3 hàng tuần.
2.3.2. Điều tra bổ sung
Tiến hành trước, trong và sau cao điểm xuất hiện dịch hại.
2.4. Yếu tố điều tra
Chọn đại diện theo giống, thời vụ, địa hình, tập quán sản xuất, giai đoạn sinh trưởng, phát triển của cây lạc, đậu tương.
2.5. Khu vực điều tra
Chọn khu ruộng có diện tích từ 2 ha trở lên.
2.6. Điểm điều tra
Mỗi yếu tố điều tra 10 điểm ngẫu nhiên nằm trên đường chéo của khu vực điều tra. Điểm điều tra phải cách bờ ít nhất 2 m.
2.7. Phương pháp điều tra
2.7.1. Phương pháp điều tra phát hiện nhóm sâu hại lá (sâu khoang, sâu xanh, sâu xanh da láng, sâu cuốn lá,...) và thiên địch
2.7.1.1. Số mẫu điều tra: 1m2/điểm.
2.7.1.2. Cách điều tra
- Ngoài đồng:
+ Điều tra dịch hại: Quan sát từ xa đến gần, đếm trực tiếp số lượng sâu hại và phân loại từng pha phát dục của sâu có trong điểm điều tra.
+ Điều tra sinh vật có ích (bắt mồi ăn thịt): tương tự như điều tra sâu hại.
- Trong phòng:
Để theo dõi ký sinh: Thu ít nhất một lần vào cao điểm rộ tối thiểu 30 ổ trứng hoặc 30 cá thể sâu non, nhộng hoặc trưởng thành.
2.7.1.3. Các chỉ tiêu theo dõi
- Mật độ sâu (con/m2);
- Mật độ thiên địch (con/m2);
- Tỷ lệ pha phát dục của sâu (%);
- Tỷ lệ tuổi sâu (%);
- Tuổi sâu phổ biến;
- Tỷ lệ ký sinh (%);
- Tỷ lệ cây bị hại (%);
- Diện tích bị nhiễm sâu (ha);
- Diện tích đã xử lý thuốc bảo vệ thực vật và các biện pháp khác (ha).
2.7.1.4. Công thức tính
|
Mật độ sâu, thiên địch (con/m2) |
= |
Tổng số sâu, thiên địch điều tra |
|
|
Tổng số m2 điều tra |
|||
|
Tỷ lệ pha phát dục (%) |
= |
Tổng số sâu ở từng pha |
x 100 |
|
Tổng số sâu điều tra |
|||
|
Tỷ lệ tuổi sâu (%) |
= |
Tổng số sâu ở từng tuổi |
x 100 |
|
Tổng số sâu điều tra |
|||
|
Tỷ lệ ký sinh (%) |
= |
Số cá thể bị ký sinh |
x 100 |
|
Tổng số cá thể theo dõi |
|||
|
Tỷ lệ cây bị hại (%) |
= |
Tổng số cây bị hại |
x 100 |
|
Tổng số cây điều tra |
|||
|
Diện tích nhiễm dịch hại Xi (ha) |
= |
(N1 x S1) + ….. + (Nn x Sn) |
|
|
10 |
|||
|
Trong đó: |
Xi (ha): Diện tích nhiễm dịch hại ở mức i; N1: Số điểm nhiễm dịch hại của yếu tố thứ 1; S1: Diện tích trồng lạc, đậu tương của yếu tố thứ 1; Nn: Số điểm nhiễm dịch hại của yếu tố thứ n; Sn: Diện tích trồng lạc, đậu tương của yếu tố thứ n; 10: Số điểm điều tra của 1 yếu tố; Mức i: Nhiễm nhẹ, trung bình, nặng |
||
2.7.1.5. Diện tích nhiễm dịch hại (ha)
- Căn cứ để thống kê diện tích nhiễm dịch hại: Số liệu điều tra của từng yếu tố liên quan, cơ cấu giống, thời vụ, địa hình, giai đoạn sinh trưởng, phát triển,...
- Quy định mật độ sâu, tỷ lệ hại để thống kê diện tích nhiễm
|
Mức độ nhiễm |
Sâu khoang |
Sâu cuốn lá (con/m2) |
Sâu xanh da láng (con/m2) |
|
Nhiễm nhẹ |
10 - 20 |
15 - 30 |
10 - 20 |
|
Nhiễm trung bình |
> 20 - 40 |
> 30 - 60 |
> 20 - 40 |
|
Nhiễm nặng |
> 40 |
> 60 |
> 40 |
|
Mất trắng |
Thiệt hại trên 70% năng suất (dùng để thống kê cuối các đợt dịch hoặc cuối vụ sản xuất). |
||
2.7.2. Phương pháp điều tra phát hiện nhóm chích hút (nhện, rệp, bọ trĩ, rầy xanh,…) và thiên địch
2.7.2.1. Số mẫu điều tra
- Đối với rệp, bọ trĩ, nhện: Điều tra 10 cây/điểm.
- Đối với rầy xanh: Điều tra 1 khung/điểm.
2.7.2.2. Cách điều tra
- Điều tra dịch hại:
+ Đối với nhện, rệp, bọ trĩ: quan sát từ xa đến gần, sau đó đếm trực tiếp số lượng cây bị hại và phân cấp hại.
Phân cấp cây bị hại theo 3 cấp sau:
Cấp 1: nhẹ (rệp, nhện, bọ trĩ phân bố rải rác trên cây).
Cấp 2: trung bình (rệp, nhện, bọ trĩ phân bố dưới 1/3 diện tích của cây).
Cấp 3: nặng (rệp, nhện, bọ trĩ phân bố từ 1/3 diện tích của cây).
+ Đối với rầy xanh: quan sát, đếm trực tiếp số lượng rầy có trong điểm điều tra.
- Điều tra sinh vật có ích (bắt mồi ăn thịt): Tương tự như điều tra sâu hại.
2.7.2.3. Các chỉ tiêu theo dõi
- Tỷ lệ cây bị hại (%);
- Chỉ số hại (%);
- Mật độ rầy, thiên địch (con/m2);
- Diện tích nhiễm (ha);
- Diện tích đã xử lý: Thuốc bảo vệ thực vật và các biện pháp khác (ha).
2.7.2.4. Công thức tính
|
Tỷ lệ cây bị hại (%) |
= |
Tổng số cây bị hại |
x 100 |
|
Tổng số cây điều tra |
|||
|
Mật độ rầy, thiên địch (con/m2) |
= |
Tổng số rầy, thiên địch điều tra |
|
|
Tổng số m2 điều tra |
|||
|
Chỉ số hại (%) |
= |
(N1 x 1) + (N2 x 2) + (N3 x 3) |
x 100 |
|
N x 3 |
|||
|
Trong đó: |
N1 là số cây bị rệp ở cấp 1; N2 là số cây bị rệp ở cấp 2; N3 là số cây bị rệp ở cấp 3; 3 là cấp hại cao nhất trong thang phân cấp. |
||
|
Diện tích nhiễm dịch hại Xi (ha) |
= |
(N1 x S1) + ….. + (Nn x Sn) |
|
|
10 |
|||
|
Trong đó: |
Xi (ha): Diện tích nhiễm dịch hại ở mức i; N1: Số điểm nhiễm dịch hại của yếu tố thứ 1; S1: Diện tích trồng lạc, đậu tương của yếu tố thứ 1; Nn: Số điểm nhiễm dịch hại của yếu tố thứ n; Sn: Diện tích trồng lạc, đậu tương của yếu tố thứ n; 10: Số điểm điều tra của 1 yếu tố; Mức i: Nhiễm nhẹ, trung bình, nặng |
||
2.7.2.5. Diện tích nhiễm dịch hại
- Căn cứ để thống kê diện tích nhiễm dịch hại: Số liệu điều tra của từng yếu tố liên quan, cơ cấu giống, thời vụ, địa hình, giai đoạn sinh trưởng, phát triển,...
- Quy định tỷ lệ cây bị hại để thống kê diện tích nhiễm
|
Mức độ nhiễm |
Rệp, bọ trĩ (% cây) |
Nhện (% cây) |
Rầy xanh (con/m2) |
|
Nhiễm nhẹ |
15 - 30 |
10 - 20 |
500 - 1.000 |
|
Nhiễm trung bình |
> 30 - 60 |
> 20 - 40 |
> 1.000 - 2.000 |
|
Nhiễm nặng |
> 60 |
> 40 |
> 2.000 |
|
Mất trắng |
Thiệt hại trên 70% năng suất (dùng để thống kê cuối các đợt dịch hoặc cuối vụ sản xuất). |
||
2.7.3. Phương pháp điều tra phát hiện nhóm sâu hại thân, gốc (ruồi đục thân, sâu xám,…) và thiên địch
2.7.3.1. Số mẫu điều tra: 30 cây/điểm.
2.7.3.2. Cách điều tra
- Ngoài đồng:
+ Điều tra sâu hại:
Tỷ lệ cây bị hại: Đếm số cây và số cây bị hại có trong điểm điều tra.
Điều tra mật độ sâu xám: Quan sát, đếm toàn bộ cây và số cây bị hại có trong điểm điều tra. Bới đất xung quanh những cây, lá mới bị sâu kéo xuống đất để tìm sâu. Sau đó đếm trực tiếp số lượng và phân loại từng pha phát dục của sâu.
+ Điều tra sinh vật có ích (bắt mồi ăn thịt): Tương tự như điều tra sâu hại.
- Trong phòng: Khi cần thiết, thu ít nhất 30 cá thể sâu non hoặc trưởng thành về phòng để theo dõi.
2.7.3.3. Các chỉ tiêu theo dõi
- Tỷ lệ cây bị hại (%);
- Mật độ sâu (con/m2);
- Tỷ lệ pha phát dục của sâu (%);
- Tỷ lệ tuổi sâu (%);
- Tuổi sâu phổ biến;
- Mật độ thiên địch (con/m2);
- Tỷ lệ ký sinh (%);
- Diện tích nhiễm (ha);
- Diện tích đã xử lý: Thuốc bảo vệ thực vật và các biện pháp khác (ha).
2.7.3.4. Công thức tính
|
Mật độ sâu, thiên địch (con/m2) |
= |
Tổng số sâu, thiên địch điều tra |
|
|
Tổng số m2 điều tra |
|||
|
Tỷ lệ pha phát dục (%) |
= |
Tổng số sâu từng pha |
x 100 |
|
Tổng số sâu điều tra |
|||
|
Tỷ lệ tuổi sâu (%) |
= |
Tổng số sâu sống ở từng tuổi |
x 100 |
|
Tổng số sâu điều tra |
|||
|
Tỷ lệ ký sinh (%) |
= |
Số cá thể bị ký sinh |
x 100 |
|
Tổng số cá thể theo dõi |
|||
|
Tỷ lệ cây bị hại (%) |
= |
Tổng số cây bị hại |
x 100 |
|
Tổng số cây điều tra |
|||
|
Diện tích nhiễm dịch hại Xi (ha) |
= |
(N1 x S1) + ….. + (Nn x Sn) |
|
|
10 |
|||
|
Trong đó: |
Xi (ha): Diện tích nhiễm dịch hại ở mức i; N1: Số điểm nhiễm dịch hại của yếu tố thứ 1; S1: Diện tích trồng lạc, đậu tương của yếu tố thứ 1; Nn: Số điểm nhiễm dịch hại của yếu tố thứ n; Sn: Diện tích trồng lạc, đậu tương của yếu tố thứ n; 10: Số điểm điều tra của 1 yếu tố; Mức i: Nhiễm nhẹ, trung bình, nặng |
||
2.7.3.5. Diện tích nhiễm dịch hại
- Căn cứ để thống kê diện tích nhiễm dịch hại: Số liệu điều tra của từng yếu tố liên quan, cơ cấu giống, thời vụ, địa hình, giai đoạn sinh trưởng, phát triển,...
- Quy định mật độ sâu, tỷ lệ cây bị hại để thống kê diện tích nhiễm
|
Mức độ nhiễm |
Ruồi đục thân (giai đoạn sinh trưởng) (% cây) |
Sâu xám (giai đoạn cây con) |
|
|
(% cây) |
(con/m2) |
||
|
Nhiễm nhẹ |
5 - 10 |
5 - 10 |
2,5 - 5 |
|
Nhiễm trung bình |
> 10 - 20 |
> 10 - 20 |
> 5 - 10 |
|
Nhiễm nặng |
> 20 |
> 20 |
> 10 |
|
Mất trắng |
Diện tích phải gieo lại hoặc thiệt hại trên 70% năng suất (dùng để thống kê cuối đợt dịch hoặc cuối vụ). |
||
2.7.4. Phương pháp điều tra phát hiện sâu hại quả và thiên địch
2.7.4.1. Số mẫu điều tra: 10 cây/điểm. Đếm toàn bộ số quả và số quả bị hại có trong điểm điều tra.
2.7.4.2. Phương pháp điều tra
- Ngoài đồng:
+ Điều tra dịch hại: Quan sát từ xa đến gần, sau đó đếm trực tiếp số lượng quả bị hại có trong điểm điều tra.
+ Điều tra sinh vật có ích (bắt mồi ăn thịt): Tương tự như điều tra sâu hại.
- Trong phòng: Khi cần thiết, thu ít nhất 50 quả trứng hoặc 30 cá thể sâu non hoặc trưởng thành về phòng để theo dõi.
2.7.4.3. Các chỉ tiêu theo dõi
- Tỷ lệ quả bị hại (%);
- Diện tích nhiễm (ha).
- Diện tích đã xử lý: Thuốc bảo vệ thực vật và các biện pháp khác (ha).
2.7.4.4. Công thức tính
|
Tỷ lệ quả bị hại (%) |
= |
Tổng số quả bị hại |
x 100 |
|
Tổng số quả điều tra |
|||
|
Diện tích nhiễm dịch hại Xi (ha) |
= |
(N1 x S1) + ….. + (Nn x Sn) |
|
|
10 |
|||
|
Trong đó: |
Xi (ha): Diện tích nhiễm dịch hại ở mức i; N1: Số điểm nhiễm dịch hại của yếu tố thứ 1; S1: Diện tích trồng lạc, đậu tương của yếu tố thứ 1; Nn: Số điểm nhiễm dịch hại của yếu tố thứ n; Sn: Diện tích trồng lạc, đậu tương của yếu tố thứ n; 10: Số điểm điều tra của 1 yếu tố; Mức i: Nhiễm nhẹ, trung bình, nặng |
||
2.7.4.5. Diện tích nhiễm dịch hại
- Căn cứ để thống kê diện tích nhiễm dịch hại: Số liệu điều tra của từng yếu tố liên quan, cơ cấu giống, thời vụ, địa hình, giai đoạn sinh trưởng, phát triển,...
- Quy định tỷ lệ quả bị hại để thống kê diện tích nhiễm
|
Mức độ nhiễm |
Sâu đục quả |
|
|
Giai đoạn quả mới hình thành (% quả) |
Giai đoạn ra phát triển quả đến chín (% quả) |
|
|
Nhiễm nhẹ |
10 - 20 |
5 - 10 |
|
Nhiễm trung bình |
> 20 - 40 |
> 10 - 20 |
|
Nhiễm nặng |
> 40 |
> 20 |
|
Mất trắng |
Thiệt hại trên 70% năng suất (dùng để thống kê cuối các đợt dịch hoặc cuối vụ sản xuất). |
|
2.7.5. Phương pháp điều tra phát hiện bệnh hại lá (bệnh sương mai, bệnh đốm vòng, bệnh đốm lá, bệnh gỉ sắt,…)
2.7.5.1. Số mẫu điều tra: 10 lá kép/điểm.
2.7.5.2. Cách điều tra
- Ngoài đồng
Lấy 10 lá kép ngẫu nhiên/điểm. Đếm số lá bị bệnh và phân cấp hại các lá đó, ghi nhận cấp bệnh phổ biến.
Phân cấp lá bệnh theo các cấp như sau:
Cấp 1: < 1% diện tích lá bị bệnh;
Cấp 3: từ 1 - 5% diện tích lá bị bệnh;
Cấp 5: > 5 - 25% diện tích của lá bị bệnh;
Cấp 7: > 25 - 50% diện tích của lá bị bệnh;
Cấp 9: > 50% diện tích của lá bị bệnh.
- Trong phòng
Khi cần thiết, thu mẫu về phòng để theo dõi.
2.7.5.3. Các chỉ tiêu theo dõi
- Tỷ lệ lá bị bệnh (%);
- Chỉ số lá bị bệnh (%);
- Cấp bệnh phổ biến;
- Diện tích nhiễm (ha);
- Diện tích đã xử lý: Thuốc bảo vệ thực vật và các biện pháp khác (ha).
2.7.5.4. Công thức tính
|
Tỷ lệ lá bị bệnh (%) |
= |
Tổng số lá bị bệnh |
x 100 |
|
Tổng số lá điều tra |
|||
|
Chỉ số lá bị bệnh (%) |
= |
(N1 x 1) + (N3 x 3) + ...+ (Nn x n) |
x 100 |
|
N x 9 |
|||
|
Trong đó: |
N1 là số lá bị bệnh ở cấp 1; N3 là số lá bị bệnh ở cấp 3; Nn là số lá bị bệnh ở cấp n; N là tổng số lá điều tra. 9 là cấp bệnh cao nhất trong thang phân cấp. |
||
|
Diện tích nhiễm dịch hại Xi (ha) |
= |
(N1 x S1) + ….. + (Nn x Sn) |
|
|
10 |
|||
|
Trong đó: |
Xi (ha): Diện tích nhiễm dịch hại ở mức i; N1: Số điểm nhiễm dịch hại của yếu tố thứ 1; S1: Diện tích trồng lạc, đậu tương của yếu tố thứ 1; Nn: Số điểm nhiễm dịch hại của yếu tố thứ n; Sn: Diện tích trồng lạc, đậu tương của yếu tố thứ n; 10: Số điểm điều tra của 1 yếu tố; Mức i: Nhiễm nhẹ, trung bình, nặng |
||
2.7.5.5. Diện tích nhiễm (ha)
- Căn cứ để thống kê diện tích nhiễm dịch hại: Số liệu điều tra của từng yếu tố liên quan, cơ cấu giống, thời vụ, địa hình, giai đoạn sinh trưởng, phát triển,...
- Quy định tỷ lệ lá bị bệnh để thống kê diện tích nhiễm
|
Mức độ nhiễm |
Bệnh gỉ sắt
|
Bệnh đốm lá
|
Bệnh sương
mai |
|
Nhiễm nhẹ |
15 - 30 |
15 - 30 |
10 - 20 |
|
Nhiễm trung bình |
> 30 - 60 |
> 30 - 60 |
> 20 - 40 |
|
Nhiễm nặng |
> 60 |
> 60 |
> 40 |
|
Mất trắng |
Thiệt hại trên 70% năng suất (dùng để thống kê cuối các đợt dịch hoặc cuối vụ sản xuất). |
||
2.7.6. Phương pháp điều tra phát hiện bệnh hại thân, rễ (bệnh héo vàng, héo rũ gốc mốc trắng, héo xanh vi khuẩn ...)
2.7.6.1. Số mẫu điều tra: Tối thiểu 30 cây ngẫu nhiên/điểm.
2.7.6.2. Cách điều tra
- Ngoài đồng: Đếm số cây bị bệnh.
- Trong phòng: Khi cần thiết thu mẫu về phòng theo dõi.
2.7.6.3. Các chỉ tiêu cần theo dõi và công thức tính
- Tỷ lệ cây bị bệnh (%);
- Diện tích nhiễm bệnh (ha).
- Diện tích đã xử lý: Thuốc bảo vệ thực vật và các biện pháp khác (ha).
|
Tỷ lệ cây bị bệnh (%) |
= |
Tổng số cây bị bệnh |
x 100 |
|
Tổng số cây điều tra |
|||
|
Diện tích nhiễm dịch hại Xi (ha) |
= |
(N1 x S1) + … + (Nn x Sn) |
|
|
10 |
|||
|
Trong đó: |
Xi (ha): Diện tích nhiễm dịch hại ở mức i; N1: Số điểm nhiễm dịch hại của yếu tố thứ 1; S1: Diện tích trồng lạc, đậu tương của yếu tố thứ 1; Nn: Số điểm nhiễm dịch hại của yếu tố thứ n; Sn: Diện tích trồng lạc, đậu tương của yếu tố thứ n; 10: Số điểm điều tra của 1 yếu tố; Mức i: Nhiễm nhẹ, trung bình, nặng |
||
2.7.6.4. Diện tích nhiễm
- Căn cứ để thống kê diện tích nhiễm dịch hại: Số liệu điều tra của từng yếu tố liên quan, cơ cấu giống, thời vụ, địa hình, giai đoạn sinh trưởng, phát triển,...
- Quy định tỷ lệ cây bị bệnh để thống kê diện tích nhiễm
|
Mức độ nhiễm |
Bệnh héo vàng, héo rũ gốc mốc trắng (% cây) |
Bệnh héo xanh vi khuẩn (% cây) |
|
Nhiễm nhẹ |
2,5 - 5 |
2,5 - 5 |
|
Nhiễm trung bình |
> 5 - 10 |
> 5 - 10 |
|
Nhiễm nặng |
> 10 |
> 10 |
|
Mất trắng |
Thiệt hại trên 70% năng suất (dùng để thống kê cuối các đợt dịch hoặc cuối vụ sản xuất). |
|
2.7.7. Phương pháp điều tra phát hiện chuột hại
2.7.7.1. Số mẫu điều tra: 1m2/điểm.
2.7.7.2. Cách điều tra
- Điều tra cây bị hại: Đếm toàn bộ cây và số cây bị hại có trong điểm điều tra, tính tỷ lệ cây bị hại.
- Điều tra quả đậu tương bị hại: Đếm toàn bộ số quả và quả bị hại của 10 cây ngẫu nhiên mang quả có trong điểm điều tra.
2.7.7.3. Các chỉ tiêu theo dõi và công thức tính
- Tỷ lệ cây bị hại (%);
- Tỷ lệ quả bị hại (%);
- Diện tích nhiễm (ha);
- Diện tích đã xử lý: Thuốc bảo vệ thực vật và các biện pháp khác (ha).
|
Tỷ lệ cây bị hại (%) |
= |
Tổng số cây bị hại |
x 100 |
|
Tổng số cây điều tra |
|||
|
Tỷ lệ quả bị hại (%) |
= |
Tổng số quả bị hại |
x 100 |
|
Tổng số quả điều tra |
|||
|
Diện tích nhiễm chuột Xi (ha) |
= |
(N1 x S1) + … + (Nn x Sn) |
|
|
10 |
|||
|
Trong đó: |
Xi (ha): Diện tích nhiễm dịch hại ở mức i; N1: Số điểm nhiễm dịch hại của yếu tố thứ 1; S1: Diện tích trồng lạc, đậu tương của yếu tố thứ 1; Nn: Số điểm nhiễm dịch hại của yếu tố thứ n; Sn: Diện tích trồng lạc, đậu tương của yếu tố thứ n; 10: Số điểm điều tra của 1 yếu tố; Mức i: Nhiễm nhẹ, trung bình, nặng |
||
2.7.7.4. Diện tích nhiễm
- Căn cứ để thống kê diện tích nhiễm dịch hại: Số liệu điều tra của từng yếu tố liên quan, cơ cấu giống, thời vụ, địa hình, giai đoạn sinh trưởng, phát triển,…
- Quy định tỷ lệ cây bị hại để thống kê diện tích nhiễm
|
Mức độ nhiễm |
Cây đậu tương |
Cây lạc (% cây) |
|
|
(% cây) |
(% quả) |
||
|
Nhiễm nhẹ |
5 - 10 |
10 - 20 |
5 - 10 |
|
Nhiễm trung bình |
> 10 - 20 |
> 20 - 40 |
> 10 - 20 |
|
Nhiễm nặng |
> 20 |
> 40 |
> 20 |
|
Mất trắng |
Diện tích phải gieo lại hoặc thiệt hại trên 70% năng suất (dùng để thống kê cuối các đợt dịch hoặc cuối vụ sản xuất). |
||
2.8. Thu thập số liệu, tài liệu và thông báo kết quả
2.8.1. Sổ theo dõi và các tài liệu khác
- Sổ theo dõi:
Sổ theo dõi dịch hại, sinh vật có ích vào bẫy;
Sổ ghi chép số liệu điều tra dịch hại, sinh vật có ích định kỳ, bổ sung;
Sổ theo dõi diện tích nhiễm dịch hại thường kỳ, hàng vụ, hàng năm;
Sổ theo dõi thời tiết.
- Tài liệu khác
Cơ sở dữ liệu và phần mềm có liên quan;
Ảnh và các mẫu vật, tiêu bản có liên quan.
2.8.2. Thông báo kết quả điều tra
Theo Quy chuẩn kỹ thuật quốc gia (QCVN 01-38:2010/BNNPTNT) về phương pháp điều tra phát hiện dịch hại cây trồng.
2.9. Báo cáo
Theo Quy chuẩn kỹ thuật quốc gia (QCVN 01-38:2010/BNNPTNT) về phương pháp điều tra phát hiện dịch hại cây trồng.
2.10. Lưu giữ và khai thác dữ liệu
Tất cả các đơn vị thuộc hệ thống Bảo vệ thực vật phải lưu giữ, hệ thống, quản lý và khai thác dữ liệu điều tra, báo cáo bằng các phương pháp truyền thống kết hợp phát huy lợi thế của công nghệ thông tin.
III. TRÁCH NHIỆM CỦA TỔ CHỨC, CÁ NHÂN
Thực hiện điều tra, kiểm tra và tổng hợp tình hình dịch hại và gửi thông báo định kỳ; thông báo tháng; thông báo quý, điện báo đột xuất và các văn bản chỉ đạo; báo cáo diễn biến và kết quả phòng trừ các đợt dịch; báo cáo tổng kết vụ; dự báo vụ, báo cáo tổng kết năm,... theo Quy chuẩn kỹ thuật Quốc gia (QCVN 01-38:2010/BNNPTNT) về phương pháp điều tra phát hiện dịch hại cây trồng.
IV. TỔ CHỨC THỰC HIỆN
Cục Bảo vệ thực vật có trách nhiệm tổ chức hướng dẫn và kiểm tra việc thực hiện Quy chuẩn này đối với Hệ thống tổ chức chuyên ngành Bảo vệ và Kiểm dịch thực vật; các tổ chức, cá nhân có hoạt động liên quan đến điều tra phát hiện dịch hại cây lạc, đậu tương tại Việt Nam./.
QUY CHUẨN KỸ THUẬT QUỐC GIA VỀ PHƯƠNG PHÁP ĐIỀU TRA PHÁT HIỆN DỊCH HẠI CÂY RAU HỌ HOA THẬP TỰ
National technical regulation on surveillance method of Cruciferous vegetable pests
Lời nói đầu
QCVN 01 - 169 : 2014/BNNPTNT do Phòng Bảo vệ thực vật biên soạn, Cục Bảo vệ thực vật trình duyệt, Bộ Nông nghiệp & PTNT ban hành tại Thông tư số 16/TT-BNNPTNT ngày 05 tháng 6 năm 2014.
QUY CHUẨN KỸ THUẬT QUỐC GIA VỀ PHƯƠNG PHÁP ĐIỀU TRA PHÁT HIỆN DỊCH HẠI CÂY RAU HỌ HOA THẬP TỰ
National technical regulation on surveillance method of Cruciferous vegetable pests
I. QUY ĐỊNH CHUNG
1.1. Phạm vi điều chỉnh
Quy chuẩn này quy định nguyên tắc, nội dung, phương pháp áp dụng trong công tác điều tra phát hiện dịch hại chính và sinh vật có ích trong từng giai đoạn sinh trưởng, phát triển của cây rau họ hoa thập tự.
1.2. Đối tượng áp dụng
Quy chuẩn này bắt buộc áp dụng trong hệ thống tổ chức chuyên ngành Bảo vệ và Kiểm dịch thực vật; tổ chức, cá nhân có hoạt động điều tra, phát hiện dịch hại cây rau họ hoa thập tự tại Việt Nam.
1.3. Giải thích từ ngữ
Trong tiêu chuẩn này các thuật ngữ dưới đây được hiểu như sau:
1.3.1. Cây con rau họ hoa thập tự
Là từ khi gieo/trồng đến giai đoạn đầu thời kỳ phát triển thân lá.
1.3.2. Cây lớn rau họ hoa thập tự
Là từ giai đoạn phát triển thân lá đến khi thu hoạch.
1.3.3. Dịch hại cây rau họ hoa thập tự (còn gọi là sinh vật gây hại cây rau họ hoa thập tự)
Là bất cứ loài, chủng hoặc dạng sinh học thực vật, động vật hoặc vi sinh vật nào gây hại cho rau họ hoa thập tự bao gồm: Côn trùng, nhện hại, nấm bệnh, tuyến trùng, vi khuẩn, virus, phytoplasma, cỏ dại, chuột và các sinh vật gây hại khác.
1.3.4. Dịch hại chính
Là những dịch hại thường xuyên xuất hiện phổ biến và hại nặng hàng vụ, hàng năm ở địa phương.
1.3.5. Dịch hại chủ yếu
Là những dịch hại chính, mà tại thời điểm điều tra có mức độ gây hại cao hoặc khả năng lây lan nhanh, phân bố rộng trong điều kiện ngoại cảnh thuận lợi.
1.3.6. Yếu tố điều tra chính
Là các yếu tố đại diện có liên quan đến dịch hại, bao gồm yếu tố giống, thời vụ, địa hình (chân đất), giai đoạn sinh trưởng, phát triển của cây rau họ hoa thập tự và tập quán canh tác.
1.3.7. Khu vực điều tra
Là khu đồng, vườn đại diện cho các yếu tố điều tra và được chọn cố định để điều tra ngay từ đầu vụ.
1.3.8. Tuyến điều tra
Là tuyến được xác định theo một lịch trình đã định sẵn theo đường chéo góc của khu vực điều tra và nhằm thỏa mãn các yếu tố điều tra chính của khu vực điều tra.
1.3.9. Mẫu điều tra
Là số lượng lá, thân, củ, quả hoặc cây rau trên đơn vị điểm điều tra.
1.3.10. Điểm điều tra
Là điểm được bố trí tương đối ngẫu nhiên và đồng đều trên tuyến điều tra.
1.3.11. Mật độ dịch hại hoặc thiên địch bắt mồi
Là số lượng dịch hại hoặc thiên địch bắt mồi trên một đơn vị diện tích hoặc một đơn vị đối tượng khảo sát.
1.3.12. Tỷ lệ bệnh hoặc tỷ lệ hại
Là số lượng mẫu điều tra bị bệnh hoặc bị hại tính theo phần trăm (%) so với tổng số mẫu điều tra.
1.3.13. Chỉ số bệnh hoặc chỉ số hại
Là đại lượng đặc trưng cho mức độ bị bệnh hoặc bị hại của cây trồng được biểu thị bằng phần trăm (%).
1.3.14. Sinh vật có ích (thiên địch)
Bao gồm virus, vi khuẩn, tuyến trùng, nấm, côn trùng, động vật và các sinh vật khác có tác dụng hạn chế tác hại của dịch hại đối với cây rau họ hoa thập tự.
1.3.15. Điều tra định kỳ
Là hoạt động điều tra thường xuyên của cán bộ bảo vệ thực vật theo một thời gian định trước trên tuyến điều tra thuộc khu vực điều tra nhằm nắm được diễn biến của dịch hại cây rau họ hoa thập tự và thiên địch của chúng.
1.3.1.6. Điều tra bổ sung
Là mở rộng tuyến điều tra hoặc tăng số lần điều tra vào các thời kỳ xung yếu của cây rau họ hoa thập tự và dịch hại đặc thù của vùng sinh thái hoặc trong vùng dịch, nhằm xác định thời gian phát sinh, diện phân bố và mức độ gây hại của dịch hại chủ yếu trên cây rau họ hoa thập tự ở địa phương, cũng như sự lây lan hoặc tái phát dịch.
II. QUY ĐỊNH KỸ THUẬT
2.1. Yêu cầu kỹ thuật
Theo Quy chuẩn kỹ thuật quốc gia (QCVN 01-38:2010/BNNPTNT) về phương pháp điều tra phát hiện dịch hại cây trồng.
2.2. Thiết bị và dụng cụ điều tra
Theo Quy chuẩn kỹ thuật quốc gia (QCVN 01-38:2010/BNNPTNT) về phương pháp điều tra phát hiện dịch hại cây trồng.
2.3. Thời gian điều tra
- Điều tra định kỳ: 7 ngày/lần ở tuyến điều tra với các yếu tố điều tra trong khu vực điều tra cố định ngay từ đầu vụ vào các ngày thứ 2, thứ 3 hàng tuần.
- Điều tra bổ sung: Tiến hành trước, trong và sau cao điểm xuất hiện dịch hại.
2.4. Yếu tố điều tra
Chọn đại diện theo giống, thời vụ, địa hình, giai đoạn sinh trưởng, phát triển của cây rau.
2.5. Khu vực điều tra
- Đối với vùng chuyên canh rau: Chọn khu ruộng có diện tích từ 2 ha trở lên đại diện cho các yếu tố điều tra.
- Đối với vùng không chuyên canh: Chọn khu ruộng có diện tích từ 0,5 ha đại diện cho các yếu tố điều tra.
2.6. Điểm điều tra
Mỗi yếu tố điều tra 10 điểm ngẫu nhiên hoặc phân bố ngẫu nhiên trên đường chéo của khu vực điều tra. Điểm điều tra phải cách bờ ít nhất 2 mét.
2.7. Phương pháp điều tra
2.7.1. Phương pháp điều tra phát hiện nhóm sâu hại lá (sâu xanh bướm trắng, sâu khoang, sâu tơ,...) và thiên địch
2.7.1.1. Số mẫu điều tra của 1 điểm
- Đối với rau gieo, trồng thưa (dưới 50 cây/m2): 1 m2/điểm (đối với sâu tơ mật độ trên 300 con/m2, điểm điều tra 0,2 m2/điểm);
- Đối với rau gieo, trồng dày (trên 50 cây/m2): 1 khung (40 x 50 cm)/điểm (đối với sâu tơ mật độ trên 300 con/m2, điều tra 1/4 khung/điểm).
2.7.1.2. Cách điều tra
- Ngoài đồng
Quan sát từ xa đến gần, sau đó đếm trực tiếp số lượng sâu và phân từng pha phát dục của sâu có trên từng cây trong điểm điều tra.
Cách điều tra sinh vật có ích (thiên địch bắt mồi ăn thịt) tương tự như điều tra sâu hại.
- Trong phòng
Để theo dõi ký sinh: Thu ít nhất một lần vào cao điểm rộ của trứng tối thiểu 50 trứng đẻ rời hoặc 30 ổ trứng hoặc 30 cá thể sâu non, nhộng hoặc trưởng thành.
2.7.1.3. Các chỉ tiêu cần theo dõi
- Mật độ sâu (con/m2);
- Tỷ lệ pha phát dục của sâu (%);
- Tỷ lệ tuổi sâu (%);
- Mật độ các loại thiên địch bắt mồi (con/m2);
- Tỷ lệ ký sinh (%);
- Diện tích bị nhiễm sâu (ha);
- Diện tích đã xử lý: Thuốc bảo vệ thực vật và các biện pháp khác (ha).
2.7.1.4. Công thức tính
|
Mật độ sâu, thiên địch (con/m2) |
= |
Tổng số sâu (thiên địch) điều tra |
|
|
Tổng số m2 điều tra |
|||
|
Tỷ lệ pha phát dục (%) |
= |
Tổng sâu sống ở từng pha |
x 100 |
|
Tổng số sâu sống điều tra |
|||
|
Tỷ lệ tuổi sâu (%) |
= |
Tổng số sâu sống ở từng tuổi |
x 100 |
|
Tổng số sâu điều tra |
|||
|
Tỷ lệ ký sinh (%) |
= |
Tổng số sâu bị ký sinh ở từng pha |
x 100 |
|
Tổng số sâu điều tra ở từng pha |
|||
|
Diện tích nhiễm dịch hại Xi (ha) |
= |
(N1 x S1) + … + (Nn x Sn) |
|
|
10 |
|||
|
Trong đó: |
Xi (ha): Diện tích nhiễm dịch hại ở mức i; N1: Số điểm nhiễm dịch hại của yếu tố thứ 1; S1: Diện tích gieo, trồng rau của yếu tố thứ 1; Nn: Số điểm nhiễm dịch hại của yếu tố thứ n; Sn: Diện tích gieo, trồng rau của yếu tố thứ n; 10: Số điểm điều tra của 1 yếu tố; Mức i: Nhiễm nhẹ, trung bình, nặng |
||
2.7.1.5. Các căn cứ để tính diện tích nhiễm
- Cơ cấu giống, thời vụ, địa hình, giai đoạn sinh trưởng và phát triển của cây rau họ hoa thập tự,...
- Số liệu điều tra của từng yếu tố liên quan.
- Quy định mật độ sâu để thống kê diện tích nhiễm
|
Mức độ nhiễm |
Sâu tơ (con/m2) |
Sâu xanh bướm trắng (con/m2) |
Sâu khoang (con/m2) |
|
|
Cây con |
Cây lớn |
|||
|
Nhiễm nhẹ |
10 - 20 |
15 - 30 |
3 - 6 |
3 - 6 |
|
Nhiễm trung bình |
> 20 - 40 |
> 30 - 60 |
> 6 - 12 |
> 6 - 12 |
|
Nhiễm nặng |
> 40 |
> 60 |
> 12 |
> 12 |
|
Mất trắng |
Giảm trên 70% năng suất (dùng để thống kê cuối các đợt dịch hoặc cuối vụ sản xuất). |
|||
2.7.2. Phương pháp điều tra phát hiện nhóm chích hút (rệp, nhện, bọ trĩ), bọ nhảy và thiên địch
2.7.2.1. Số mẫu điều tra của 1 điểm: 10 cây/điểm hoặc 1 khung (40 x 50 cm)/điểm (đối với rau gieo, trồng dày trên 50 cây/m2).
2.7.2.2. Cách điều tra
- Ngoài đồng
Điều tra cây bị hại: Đếm số lượng cây và số cây bị hại có trong điểm điều tra. Phân cấp hại các cây đó.
Phân cấp cây bị hại theo 3 cấp như sau:
|
Cấp hại |
Đối với rệp, nhện, bọ trĩ |
Đối với bọ nhảy |
|
Cấp 1 (nhẹ) |
Phân bố rải rác trên cây |
Dưới 1/3 diện tích lá cây có vết hại |
|
Cấp 2 (trung bình) |
Phân bố dưới 1/3 diện tích của cây |
Từ 1/3 - 1/2 diện tích lá cây có vết hại |
|
Cấp 3 (nặng) |
Phân bố trên 1/3 diện tích của cây |
Trên 1/2 diện tích lá cây có vết hại |
Ghi chú: Coi diện tích toàn bộ thân, lá của cây là 100% (gọi chung là diện tích của cây).
Điều tra mật độ bọ nhảy: Quan sát từ xa đến gần, sau đó đếm trực tiếp số lượng bọ nhảy có trong điểm điều tra, pha phát dục phổ biến.
Cách điều tra sinh vật có ích (thiên địch bắt mồi ăn thịt) tương tự như điều tra sâu hại.
- Trong phòng
Để theo dõi ký sinh: Thu ít nhất một lần vào cao điểm rộ tối thiểu 30 cá thể của sâu non hoặc trưởng thành.
2.7.2.3. Các chỉ tiêu cần theo dõi
- Tỷ lệ, chỉ số cây bị hại (%);
- Mật độ bọ nhảy (con/m2);
- Mật độ các loại thiên địch bắt mồi (con/m2);
- Tỷ lệ ký sinh (%);
- Diện tích bị nhiễm (ha);
- Diện tích đã xử lý: Thuốc bảo vệ thực vật và các biện pháp khác (ha).
2.7.2.4. Công thức tính
|
Tỷ lệ cây bị hại (%) |
= |
Tổng số cây bị hại |
x 100 |
|
Tổng số cây điều tra |
|||
|
Chỉ số cây bị hại (%) |
= |
(N1 x 1) + (N2 x 2) + (N3 x 3) |
x 100 |
|
N x 3 |
|||
|
Trong đó: |
N1: số cây bị hại ở cấp 1; N2: số cây bị hại ở cấp 2; N3: số cây bị hại ở cấp 3; N: Tổng số cây điều tra 3: cấp hại cao nhất trong thang phân cấp. |
||
|
Mật độ thiên địch (con/m2) |
= |
Tổng số thiên địch điều tra |
|
|
Tổng số m2 điều tra |
|||
|
Diện tích nhiễm dịch hại Xi (ha) |
= |
(N1 x S1) + … + (Nn x Sn) |
|
|
10 |
|||
|
Trong đó: |
Xi (ha): Diện tích nhiễm dịch hại ở mức i; N1: Số điểm nhiễm dịch hại của yếu tố thứ 1; S1: Diện tích gieo, trồng rau của yếu tố thứ 1; Nn: Số điểm nhiễm dịch hại của yếu tố thứ n; Sn: Diện tích gieo, trồng rau của yếu tố thứ n; 10: Số điểm điều tra của 1 yếu tố; Mức i: Nhiễm nhẹ, trung bình, nặng |
||
2.7.2.5. Các căn cứ để tính diện tích nhiễm
- Cơ cấu giống, thời vụ, địa hình, giai đoạn sinh trưởng và phát triển của cây rau họ hoa thập tự,...
- Số liệu điều tra của từng yếu tố liên quan.
- Quy định tỷ lệ cây bị hại để thống kê diện tích nhiễm
|
Cấp hại |
Bọ trĩ, rệp (% cây) |
Nhện hại (% cây) |
Bọ nhảy (tính % cây hoặc con/m2) |
|
|
(% cây) |
(con/m2) |
|||
|
Nhiễm nhẹ |
15 - 30 |
10 - 20 |
15 - 30 |
10 - 20 |
|
Nhiễm tr.bình |
> 30 - 60 |
> 20 - 40 |
> 30 - 60 |
> 20 - 40 |
|
Nhiễm nặng |
> 60 |
> 40 |
> 60 |
> 40 |
|
Mất trắng |
Giảm trên 70% năng suất (dùng để thống kê cuối các đợt dịch hoặc cuối vụ sản xuất). |
|||
2.7.3. Phương pháp điều tra phát hiện bệnh hại lá (bệnh sương mai, thối nhũn, đốm vòng,...)
2.7.3.1. Số mẫu điều tra của 1 điểm: Tối thiểu 30 cây/điểm hoặc 30 lá (đối với bệnh đốm vòng).
2.7.3.2. Cách điều tra
- Ngoài đồng
Đếm số cây và số cây, lá bị bệnh; phân cấp hại, cấp bệnh phổ biến.
- Phân cấp cây bị bệnh theo thang 9 cấp như sau
+ Cấp 1: < 1 % diện tích của cây hoặc lá bị bệnh.
+ Cấp 3: Từ 1 đến 5% diện tích của cây hoặc lá bị bệnh.
+ Cấp 5: > 5% đến 25% diện tích của cây hoặc lá bị bệnh.
+ Cấp 7: > 25% đến 50% diện tích của cây hoặc lá bị bệnh.
+ Cấp 9: > 50% diện tích của cây hoặc lá bị bệnh.
- Trong phòng
Khi cần thiết, thu mẫu về phòng để theo dõi
2.7.3.3. Các chỉ tiêu cần theo dõi
- Tỷ lệ, chỉ số cây bị bệnh (%);
- Cấp bệnh phổ biến;
- Diện tích nhiễm bệnh (ha);
- Diện tích đã xử lý: Thuốc bảo vệ thực vật và các biện pháp khác (ha).
2.7.3.4. Công thức tính
|
Tỷ lệ bệnh (%) |
= |
Tổng số cây, lá bị bệnh |
x 100 |
|
Tổng số cây, lá điều tra |
|||
|
Chỉ số bệnh (%) |
= |
(N1 x 1) + …. + (Nn x n) |
x 100 |
|
N x 9 |
|||
|
Trong đó: |
N1: số cây bị bệnh ở cấp 1; Nn: số cây bị bệnh ở cấp n trong kỳ điều tra N: tổng số cây điều tra 9: cấp hại cao nhất trong thang phân cấp. |
||
|
Diện tích nhiễm dịch hại Xi (ha) |
= |
(N1 x S1) + ….. + (Nn x Sn) |
|
|
10 |
|||
|
Trong đó: |
Xi (ha): Diện tích nhiễm dịch hại ở mức i; N1: Số điểm nhiễm dịch hại của yếu tố thứ 1; S1: Diện tích gieo, trồng rau của yếu tố thứ 1; Nn: Số điểm nhiễm dịch hại của yếu tố thứ n; Sn: Diện tích gieo, trồng rau của yếu tố thứ n; 10: Số điểm điều tra của 1 yếu tố; Mức i: Nhiễm nhẹ, trung bình, nặng |
||
2.7.3.5. Các căn cứ để tính diện tích nhiễm
- Cơ cấu giống, thời vụ, địa hình, giai đoạn sinh trưởng và phát triển của cây rau họ hoa thập tự,...
- Số liệu điều tra của từng yếu tố liên quan.
- Quy định tỷ lệ cây bị bệnh để thống kê diện tích nhiễm
|
Mức độ nhiễm |
Bệnh sương
mai |
Bệnh thối
nhũn |
Bệnh đốm
vòng |
|
Nhiễm nhẹ |
5 - 10 |
5 - 10 |
15 - 30 |
|
Nhiễm trung bình |
> 10 - 20 |
> 10 - 20 |
> 30 - 60 |
|
Nhiễm nặng |
> 20 |
> 20 |
> 60 |
|
Mất trắng |
Giảm trên 70% năng suất (dùng để thống kê cuối các đợt dịch hoặc cuối vụ sản xuất). |
||
2.7.4. Phương pháp điều tra phát hiện bệnh hại thân, rễ, củ (bệnh héo xanh, héo vàng,...)
2.7.4.1. Số mẫu điều tra của 1 điểm: Tối thiểu 30 cây hoặc 30 củ/điểm.
2.7.4.2. Cách điều tra
- Ngoài đồng:
Đếm số cây hoặc củ và số cây hoặc củ bị bệnh có trong điểm điều tra.
- Trong phòng
Khi cần thiết, thu mẫu về phòng để theo dõi.
2.7.4.3. Các chỉ tiêu cần theo dõi
- Tỷ lệ cây hoặc củ bị bệnh (%);
- Diện tích nhiễm bệnh (ha);
- Diện tích đã xử lý: Thuốc bảo vệ thực vật và các biện pháp khác (ha).
2.7.4.4. Công thức tính
|
Tỷ lệ bệnh (%) |
= |
Tổng số cây hoặc củ bị bệnh |
x 100 |
|
Tổng số cây hoặc củ bị điều tra |
|||
|
Diện tích nhiễm dịch hại Xi (ha) |
= |
(N1 x S1) + ….. + (Nn x Sn) |
|
|
10 |
|||
|
Trong đó: |
Xi (ha): Diện tích nhiễm dịch hại ở mức i; N1: Số điểm dịch hại của yếu tố thứ 1; S1: Diện tích gieo, trồng rau của yếu tố thứ 1; Nn: Số điểm nhiễm dịch hại của yếu tố thứ n; Sn: Diện tích gieo, trồng rau của yếu tố thứ n; 10: Số điểm điều tra của 1 yếu tố; Mức i: Nhiễm nhẹ, trung bình, nặng |
||
2.7.4.5. Các căn cứ để tính diện tích nhiễm
- Cơ cấu giống, thời vụ, địa hình, giai đoạn sinh trưởng và phát triển của cây rau họ hoa thập tự,...
- Số liệu điều tra của từng yếu tố liên quan
- Quy định tỷ lệ cây bị bệnh để thống kê diện tích nhiễm
|
Mức độ nhiễm |
Bệnh héo xanh (% cây) |
Bệnh héo vàng (% cây) |
Bệnh hại củ (% củ) |
|
Nhiễm nhẹ |
2,5 - 5 |
2,5 - 5 |
5 - 10 |
|
Nhiễm trung bình |
> 5 - 10 |
> 5 - 10 |
> 10 - 20 |
|
Nhiễm nặng |
> 10 |
> 10 |
> 20 |
|
Mất trắng |
Giảm trên 70% năng suất (dùng để thống kê cuối các đợt dịch hoặc cuối vụ sản xuất). |
||
2.7.5. Phương pháp điều tra phát hiện chuột hại
2.7.5.1. Số mẫu điều tra: Tối thiểu 1m2/điểm hoặc 30 cây/điểm (đối với cây trồng thưa).
2.7.5.2. Cách điều tra
Ngoài đồng: Đếm số cây và số cây bị hại có trong điểm điều tra.
2.7.5.3. Các chỉ tiêu theo dõi
- Tỷ lệ cây bị hại (%);
- Diện tích nhiễm (ha);
- Diện tích đã xử lý: Thuốc bảo vệ thực vật và các biện pháp khác (ha).
2.7.5.4. Công thức tính
|
Tỷ lệ cây bị hại (%) |
= |
Tổng số cây bị hại |
x 100 |
|
Tổng số cây điều tra |
|||
|
Diện tích nhiễm chuột Xi (ha) |
= |
(N1 x S1) + ….. + (Nn x Sn) |
|
|
10 |
|||
|
Trong đó: |
Xi (ha): Diện tích nhiễm chuột ở mức i; N1: Số điểm nhiễm chuột của yếu tố thứ 1; S1: Diện tích gieo, trồng rau của yếu tố thứ 1; Nn: Số điểm nhiễm chuột của yếu tố thứ n; Sn: Diện tích gieo, trồng rau của yếu tố thứ n; 10: Số điểm điều tra của 1 yếu tố; Mức i: Nhiễm nhẹ, trung bình, nặng |
||
2.7.5.5. Căn cứ để tính diện tích nhiễm
- Cơ cấu giống, thời vụ, địa hình, giai đoạn sinh trưởng,...
- Số liệu điều tra của từng yếu tố liên quan.
- Quy định tỷ lệ cây bị hại để thống kê diện tích nhiễm.
|
Mức độ nhiễm |
Chuột (% cây hoặc củ) |
|
Nhiễm nhẹ |
5 - 10 |
|
Nhiễm trung bình |
> 10 - 20 |
|
Nhiễm nặng |
> 20 |
|
Mất trắng |
Diện tích gieo trồng lại hoặc giảm trên 70% năng suất (dùng để thống kê cuối các đợt dịch hoặc cuối vụ sản xuất). |
2.8. Thu thập số liệu, tài liệu và thông báo kết quả
2.8.1. Sổ theo dõi và các tài liệu khác
- Sổ theo dõi:
Sổ theo dõi dịch hại, sinh vật có ích vào bẫy;
Sổ ghi chép số liệu điều tra dịch hại, sinh vật có ích định kỳ, bổ sung;
Sổ theo dõi diện tích nhiễm dịch hại thường kỳ, hàng vụ, hàng năm;
Sổ theo dõi thời tiết.
- Tài liệu khác
Cơ sở dữ liệu, phần mềm, ảnh và các mẫu vật, tiêu bản có liên quan;
2.8.2. Thông báo kết quả điều tra
Theo Quy chuẩn kỹ thuật quốc gia (QCVN 01-38:2010/BNNPTNT) về phương pháp điều tra phát hiện dịch hại cây trồng.
2.9. Báo cáo
Theo Quy chuẩn kỹ thuật quốc gia (QCVN 01-38:2010/BNNPTNT) về phương pháp điều tra phát hiện dịch hại cây trồng.
2.10. Lưu giữ và khai thác dữ liệu
Tất cả các đơn vị thuộc hệ thống Bảo vệ thực vật phải lưu trữ, hệ thống, quản lý và khai thác dữ liệu điều tra, báo cáo bằng các phương pháp truyền thống kết hợp phát huy lợi thế trong công nghệ thông tin.
III. TRÁCH NHIỆM CỦA TỔ CHỨC, CÁ NHÂN
Thực hiện điều tra, kiểm tra, tổng hợp tình hình dịch hại và gửi thông báo định kỳ; thông báo tháng; thông báo, điện báo đột xuất và các văn bản chỉ đạo; báo cáo diễn biến và kết quả phòng trừ các đợt địch; báo cáo tổng kết vụ; dự báo vụ, báo cáo tổng kết năm,... Theo Quy chuẩn kỹ thuật quốc gia (QCVN 01-38:2010/BNNPTNT) về phương pháp điều tra phát hiện dịch hại cây trồng.
IV. TỔ CHỨC THỰC HIỆN
Cục Bảo vệ thực vật có trách nhiệm tổ chức hướng dẫn và kiểm tra việc thực hiện Quy chuẩn này đối với Hệ thống tổ chức chuyên ngành Bảo vệ và Kiểm dịch thực vật; các tổ chức, cá nhân có hoạt động liên quan đến điều tra phát hiện dịch hại cây rau họ hoa thập tự tại Việt Nam./.
National technical regulation on bio-efficacy against leaf miner (Liriomyza sativae Blanchard) on chilli of insecticides
Lời nói đầu
QCVN 01 - 170 : 2014/BNNPTNT do Trung tâm Kiểm định và Khảo nghiệm thuốc bảo vệ thực vật biên soạn, Cục Bảo vệ thực vật trình duyệt, Bộ Nông nghiệp & PTNT ban hành tại Thông tư số 16/TT-BNNPTNT ngày 05 tháng 6 năm 2014.
QUY CHUẨN KỸ THUẬT QUỐC GIA VỀ KHẢO NGHIỆM TRÊN ĐỒNG RUỘNG HIỆU LỰC PHÒNG TRỪ DÒI ĐỤC LÁ (LIRIOMYZA SATIVAE BLANCHARD) HẠI ỚT CỦA CÁC THUỐC TRỪ SÂU
National technical regulation on bio-efficacy against leaf miner (Liriomyza sativae Blanchard) on chilli of insecticides
I. QUY ĐỊNH CHUNG
1.1. Phạm vi điều chỉnh
Quy chuẩn này quy định những nguyên tắc, nội dung và phương pháp chủ yếu để đánh giá hiệu lực trừ dòi đục lá (Liriomyza sativae Blanchard) hại cây ớt của các thuốc trừ sâu trên đồng ruộng.
1.2. Đối tượng áp dụng
Quy chuẩn này áp dụng cho các cơ quan, tổ chức thực hiện khảo nghiệm thuốc bảo vệ thực vật.
1.3. Giải thích từ ngữ
Những thuật ngữ trong quy chuẩn này được hiểu như sau:
1.3.1. Dịch hại
Là bất cứ loài, chủng hoặc biotype của tác nhân gây tổn hại thực vật, động vật hoặc hoặc gây bệnh cho thực vật hoặc sản phẩm thực vật (FAO, 1995; IPPC, 1997).
1.4. Điều kiện khảo nghiệm
Khảo nghiệm phải được tiến hành tại các cơ sở có đủ điều kiện theo quy định hiện hành về khảo nghiệm thuốc bảo vệ thực vật của Bộ Nông nghiệp và Phát triển nông thôn.
Khảo nghiệm được bố trí trên những ruộng ớt thường bị dòi đục lá gây hại, tại các thời gian có điều kiện thuận lợi cho dòi đục lá phát triển và ở các địa điểm đại diện cho các vùng sinh thái.
Điều kiện trồng trọt (đất, phân bón, giống cây trồng, mật độ trồng) phải đồng đều trên toàn khu khảo nghiệm và phù hợp với tập quán canh tác tại địa phương.
Các khảo nghiệm trên diện hẹp và diện rộng phải được tiến hành ở ít nhất 2 vùng sản xuất nông nghiệp (phía Bắc và phía Nam) đại diện cho khu vực sản xuất.
Trong thời gian khảo nghiệm không được dùng bất kỳ một loại thuốc trừ sâu nào khác trên khu khảo nghiệm (bao gồm cả các công thức và giải phân cách). Nếu khu khảo nghiệm bắt buộc phải sử dụng thuốc để trừ các đối tượng gây hại khác như: bệnh hại, cỏ dại và thuốc điều hòa sinh trưởng thì thuốc được dùng để trừ đối tượng này phải không làm ảnh hưởng đến thuốc cần khảo nghiệm, không làm ảnh hưởng đến dòi đục lá và phải được phun rải đều trên tất cả các ô khảo nghiệm, kể cả ô đối chứng. Tất cả các trường hợp trên phải được ghi chép lại.
Khi xử lý thuốc không để thuốc ở ô khảo nghiệm này tạt sang ô khảo nghiệm khác.
II. QUY ĐỊNH KỸ THUẬT
2.1. Phương pháp khảo nghiệm
2.1.1. Bố trí công thức khảo nghiệm
Khảo nghiệm được bố trí theo phương pháp khối ngẫu nhiên đầy đủ hoặc theo các phương pháp khác đã được quy định trong phương pháp thí nghiệm trên đồng ruộng. Mỗi khảo nghiệm phải được thực hiện theo các công thức sau:
Công thức khảo nghiệm là công thức dùng các loại thuốc khảo nghiệm ở những nồng độ, liều lượng khác nhau hoặc theo cách dùng khác nhau.
Công thức so sánh là công thức dùng một loại thuốc trừ dòi đục lá đã được đăng ký trong danh mục thuốc bảo vệ thực vật được phép sử dụng ở Việt Nam và đang được dùng phổ biến, có hiệu quả ở địa phương để trừ dòi đục lá hại cây ớt.
Công thức đối chứng là công thức không dùng bất kỳ loại thuốc bảo vệ thực vật nào để phòng trừ dòi đục lá. Với khảo nghiệm là thuốc phun: công thức đối chứng được phun bằng nước lã.
2.1.2. Diện tích ô khảo nghiệm và số lần nhắc lại
Khảo nghiệm diện hẹp: Diện tích của mỗi ô khảo nghiệm từ 30 m2 - 50 m2, số lần nhắc lại 3-4 lần.
Khảo nghiệm diện rộng: Diện tích của mỗi ô khảo nghiệm từ 300 m2 - 500 m2, không nhắc lại.
Các ô khảo nghiệm phải có dạng hình vuông hoặc hình chữ nhật nhưng chiều dài không được quá hai lần chiều rộng.
Giữa các công thức khảo nghiệm phải có dải phân cách ít nhất là 1 luống ớt.
2.2. Tiến hành xử lý thuốc
2.2.1. Lượng thuốc và lượng nước thuốc dùng
Lượng thuốc dùng được tính bằng kg; lít chế phẩm hoặc gam hoạt chất trên đơn vị diện tích 1 ha.
Với dạng thuốc thương phẩm pha với nước để phun: Lượng nước dùng phải theo hướng dẫn cụ thể đối với từng loại thuốc, phù hợp với từng giai đoạn sinh trưởng của cây ớt cũng như cách thức tác động của từng loại thuốc. Trong trường hợp không có khuyến cáo của các tổ chức cá nhân đăng ký về lượng nước thuốc, lượng nước thuốc thường dùng từ 300 - 400 lít/ha.
2.2.2. Dụng cụ xử lý thuốc
Dụng cụ xử lý thuốc: Bình bơm động cơ, bình bơm tay đeo vai, cốc đong, cân, pipet...
Khi xử lý thuốc, phải dùng các dụng cụ phun, rải thuốc thích hợp đảm bảo yêu cầu của khảo nghiệm, ghi chép đầy đủ tình hình vận hành của dụng cụ phun rải thuốc để đảm bảo yêu cầu kỹ thuật.
2.2.3. Thời điểm và số lần xử lý thuốc
Thời điểm và số lần xử lý thuốc thực hiện đúng theo hướng dẫn sử dụng của nhà sản xuất và đăng ký.
Khi không có khuyến cáo cụ thể thời điểm xử lý thuốc thì tùy theo mục đích khảo nghiệm, các đặc tính hóa học, phương thức tác động của thuốc và đặc điểm sinh trưởng của cây trồng thì số lần xử lý thuốc từ 1-2 lần cách nhau 5 ngày. Xử lý lần đầu khi ấu trùng dòi đục lá xuất hiện gây hại.
2.3. Điều tra và thu thập số liệu
2.3.1. Chỉ tiêu, phương pháp và thời điểm điều tra
2.3.1.1. Chỉ tiêu điều tra
Mật độ dòi đục lá (con/cây)
2.3.1.2. Phương pháp điều tra
Mỗi ô chọn 5 điểm cố định nằm trên 2 đường chéo góc (đối với khảo nghiệm diện hẹp) và 10 điểm (đối với khảo nghiệm diện rộng), mỗi điểm điều tra toàn bộ số lá của 4 cây, các điểm này nằm cách mép ô khảo nghiệm ít nhất 1 hàng ớt.
2.3.1.3. Thời điểm điều tra
Thời điểm và số lần điều tra ngay trước mỗi lần xử lý thuốc và 5, 10 ngày sau xử lý thuốc lần cuối.
2.3.1.4. Xử lý số liệu
Hiệu lực phòng trừ của thuốc đối với dòi đục lá được tính bằng công thức Henderson-Tilton dựa trên các số liệu mật độ dòi đục lá tại các lần điều tra theo công thức sau:
|
Hiệu lực (%) = (1 - |
Ta x Cb |
) x 100 |
|
Tb x Ca |
Trong đó:
Ta: Mật độ dòi đục lá sống ở công thức xử lý sau phun
Tb: Mật độ dòi đục lá sống ở công thức xử lý trước phun
Ca: Mật độ dòi đục lá sống ở công thức đối chứng sau phun
Cb: Mật độ dòi đục lá sống ở công thức đối chứng trước phun
Các số liệu của khảo nghiệm diện hẹp phải được xử lý bằng các phương pháp thống kê thích hợp.
2.3.1.5. Đánh giá tác động của thuốc đến cây trồng
Đánh giá mọi ảnh hưởng tốt, xấu của thuốc (nếu có) đến sự sinh trưởng và phát triển của cây trồng theo thang phân cấp (phụ Iục 1).
Phương pháp đánh giá:
Những chỉ tiêu nào đo đếm được phải biểu thị bằng các số liệu cụ thể theo các phương pháp điều tra phù hợp.
Các chỉ tiêu đánh giá được bằng mắt như độ cháy lá, quăn lá, sự thay đổi màu sắc lá... thì phải được mô tả.
Nếu thuốc làm ảnh hưởng đến sinh trưởng, phát triển cây trồng phải theo dõi và ghi nhận ngày cây phục hồi trở lại.
2.3.1.6. Quan sát và ghi chép về thời tiết
Ghi chép các số liệu về nhiệt độ, ẩm độ, lượng mưa trong suốt thời gian khảo nghiệm theo số liệu thời tiết tại trạm khí tượng gần nhất.
III. QUY ĐỊNH VỀ QUẢN LÝ THỰC HIỆN
3.1. Báo cáo và công bố kết quả
3.1.1. Đánh giá mức độ độc của thuốc đối với cây trồng (Phụ lục 1)
3.1.2. Nội dung báo cáo (Phụ lục 2)
3.2. Tổ chức quản lý, thực hiện
Đơn vị thực hiện khảo nghiệm phải hoàn toàn chịu trách nhiệm về số liệu đưa ra trong báo cáo và có trách nhiệm lưu giữ số liệu thô của khảo nghiệm.
Căn cứ yêu cầu quản lý, Cục Bảo vệ thực vật có trách nhiệm kiến nghị Bộ Nông nghiệp và Phát triển nông thôn sửa đổi, bổ sung quy chuẩn này khi cần thiết.
Phụ lục 1.
Bảng phân cấp mức độ độc của thuốc khảo nghiệm đối với cây ớt
|
Cấp 1 2 3 4 5 6 7 8 9 |
Triệu chứng nhiễm độc. Cây chưa có biểu hiện ngộ độc. Ngộ độc nhẹ, sinh trưởng của cây giảm nhẹ. Có triệu chứng ngộ độc nhẹ nhìn thấy bằng mắt. Triệu chứng ngộ độc nhưng chưa ảnh hưởng đến năng suất. Cành lá biến màu hoặc cháy, thuốc gây ảnh hưởng đến năng suất. Thuốc làm giảm năng suất ít. Thuốc gây ảnh hưởng nhiều đến năng suất. Triệu chứng ngộ độc tăng dần tới làm chết cây. Cây bị chết hoàn toàn. |
Nếu cây bị ngộ độc thuốc, cần xác định bao nhiêu ngày sau thì cây phục hồi.
Phụ lục 2.
Nội dung chính báo cáo khảo nghiệm
1. Tên khảo nghiệm.
2. Yêu cầu của khảo nghiệm.
3. Điều kiện khảo nghiệm:
- Đơn vị khảo nghiệm.
- Tên cán bộ tiến hành khảo nghiệm
- Thời gian khảo nghiệm.
- Địa điểm khảo nghiệm.
- Nội dung khảo nghiệm.
- Đặc điểm khảo nghiệm.
- Đặc điểm đất đai, canh tác, giống cây trồng...
- Đặc điểm thời tiết trong quá trình khảo nghiệm.
- Tình hình phát sinh và phát triển của dòi đục lá hại cây ớt trong khu thí nghiệm.
4. Phương pháp khảo nghiệm:
- Công thức khảo nghiệm.
- Phương pháp bố trí khảo nghiệm.
- Số lần nhắc lại.
- Kích thước ô khảo nghiệm.
- Dụng cụ phun, rải thuốc.
- Lượng thuốc dùng nồng độ %, kg, lít thuốc thương phẩm/ha hay g (kg) hoạt chất/ha.
- Lượng nước thuốc dùng (l/ha).
- Ngày xử lý thuốc.
- Phương pháp điều tra và đánh giá hiệu lực của các loại thuốc khảo nghiệm.
5. Kết quả khảo nghiệm:
- Các bảng số liệu.
- Đánh giá hiệu lực của từng loại thuốc.
- Nhận xét tác động của từng loại thuốc đến cây trồng, sinh vật có ích và các ảnh hưởng khác (xem phụ lục).
6. Kết luận: Nhận xét về hiệu lực và ảnh hưởng của thuốc khảo nghiệm đối với cây trồng phải căn cứ vào số liệu thu được.
National technical regulation on bio-efficacy field trials against rust (Puccinia chrysanthemi Roze) on chrysanthemum of fungicides
Lời nói đầu
QCVN 01 - 171 : 2014/BNNPTNT do Trung tâm Kiểm định và Khảo nghiệm thuốc bảo vệ thực vật biên soạn, Cục Bảo vệ thực vật trình duyệt, Bộ Nông nghiệp & PTNT ban hành tại Thông tư số 16/TT-BNNPTNT ngày 05 tháng 6 năm 2014.
QUY CHUẨN KỸ THUẬT QUỐC GIA VỀ KHẢO NGHIỆM TRÊN ĐỒNG RUỘNG HIỆU LỰC PHÒNG TRỪ BỆNH GỈ SẮT (PUCCINIA CHRYSANTHEMI ROZE) HẠI CÂY HOA CÚC CỦA CÁC THUỐC TRỪ BỆNH
National technical regulation on bio-efficacy field trials against rust (Puccinia chrysanthemi Roze) on chrysanthemum of fungicides
I. QUY ĐỊNH CHUNG
1.1. Phạm vi điều chỉnh
Quy chuẩn này quy định những nguyên tắc, nội dung và phương pháp chủ yếu để đánh giá hiệu lực phòng trừ bệnh gỉ sắt (Puccinia chrysanthemi Roze) hại cây hoa cúc của các thuốc trừ bệnh trên đồng ruộng.
1.2. Đối tượng áp dụng
Quy chuẩn này áp dụng cho các cơ quan, tổ chức thực hiện khảo nghiệm thuốc bảo vệ thực vật.
1.3. Giải thích từ ngữ
Những thuật ngữ trong quy chuẩn này được hiểu như sau:
1.3.1. Dịch hại
Là bất cứ loài, chủng hoặc biotype của tác nhân gây tổn hại thực vật, động vật hoặc gây bệnh cho thực vật hoặc sản phẩm thực vật (FAO, 1995; IPPC, 1997).
1.4. Điều kiện khảo nghiệm
Khảo nghiệm phải được tiến hành tại các cơ sở có đủ điều kiện theo quy định hiện hành về khảo nghiệm thuốc bảo vệ thực vật của Bộ Nông nghiệp và Phát triển nông thôn.
Khảo nghiệm được bố trí trên những ruộng sản xuất cây hoa cúc thường bị bệnh gỉ sắt gây hại, tại các thời điểm có điều kiện thuận lợi cho bệnh phát triển và ở các địa điểm đại diện cho các vùng sinh thái.
Điều kiện trồng trọt (đất, phân bón, giống cây trồng, mật độ trồng...) phải đồng đều trên toàn khu khảo nghiệm và phù hợp với tập quán canh tác tại địa phương.
Các khảo nghiệm trên diện hẹp và diện rộng phải được tiến hành ở ít nhất 2 vùng sản xuất nông nghiệp (phía Bắc và phía Nam) đại diện cho khu vực sản xuất cây hoa cúc.
Trong thời gian khảo nghiệm không được sử dụng bất kỳ một loại thuốc trừ bệnh khác trên khu khảo nghiệm (bao gồm cả các công thức và dải phân cách). Nếu khu khảo nghiệm bắt buộc phải sử dụng thuốc để trừ các đối tượng gây hại khác như: sâu, cỏ dại, điều hòa sinh trưởng... thì thuốc được sử dụng để trừ các đối tượng này phải không làm ảnh hưởng đến thuốc cần khảo nghiệm, không làm ảnh hưởng đến đối tượng khảo nghiệm và phải được phun rải đều trên tất cả các ô khảo nghiệm, kể cả ô đối chứng. Các trường hợp trên (nếu có) phải được ghi chép lại.
Khi xử lý thuốc không để thuốc ở ô khảo nghiệm này tạt sang ô khảo nghiệm khác.
II. QUY ĐỊNH KỸ THUẬT
2.1. Phương pháp khảo nghiệm
2.1.1. Bố trí công thức khảo nghiệm
Khảo nghiệm được bố trí theo phương pháp khối ngẫu nhiên đầy đủ hoặc theo các phương pháp khác đã được quy định trong thống kê sinh học.
Mỗi khảo nghiệm phải thực hiện theo các công thức sau:
Công thức khảo nghiệm là công thức sử dụng các loại thuốc định khảo nghiệm ở những liều lượng khác nhau hoặc theo cách sử dụng khác nhau.
Công thức so sánh là công thức sử dụng một loại thuốc trừ bệnh đã được đăng ký trong danh mục thuốc bảo vệ thực vật được phép sử dụng ở Việt Nam và đang được sử dụng phổ biến, có hiệu quả ở địa phương để phòng trừ bệnh gỉ sắt hại cây hoa cúc.
Công thức đối chứng là công thức không sử dụng bất kỳ loại thuốc bảo vệ thực vật nào để phòng trừ bệnh gỉ sắt hại cây hoa cúc. Với khảo nghiệm là thuốc phun: công thức đối chứng được phun bằng nước lã.
2.1.2. Diện tích ô khảo nghiệm và số lần nhắc lại
Khảo nghiệm diện hẹp: Diện tích của mỗi ô khảo nghiệm từ 30 - 50 m2, số lần nhắc lại 3 - 4 lần.
Khảo nghiệm diện rộng: Diện tích của mỗi ô khảo nghiệm từ 300 - 500 m2, không nhắc lại.
Các ô khảo nghiệm nên có hình dạng vuông hay hình chữ nhật nhưng chiều dài không gấp đôi chiều rộng.
Giữa các công thức khảo nghiệm phải có dải phân cách rộng 1 m.
2.2. Tiến hành xử lý thuốc
2.2.1. Lượng thuốc và lượng nước thuốc sử dụng
Lượng thuốc sử dụng được tính bằng kg hoặc lít chế phẩm hoặc gam hoạt chất hoặc nồng độ % trên đơn vị diện tích 1 ha.
Với dạng thuốc thương phẩm pha với nước để phun: Lượng nước sử dụng phải theo hướng dẫn cụ thể đối với từng loại thuốc, phù hợp với giai đoạn sinh trưởng của cây cũng như cách thức tác động của từng loại thuốc. Khi không có khuyến cáo của các tổ chức cá nhân đăng ký về lượng nước thuốc, lượng nước thuốc sử dụng từ 500 - 600 l/ha.
Các số liệu về lượng thuốc thành phẩm và lượng nước sử dụng (l/ha) phải được ghi rõ.
2.2.2. Dụng cụ xử lý thuốc
Dụng cụ xử lý thuốc: Bình bơm động cơ, bình bơm tay đeo vai, cốc đong, cân, pipet...
Khi xử lý thuốc, phải sử dụng các công cụ phun, rải thuốc thích hợp đảm bảo yêu cầu của khảo nghiệm, ghi chép đầy đủ tình hình vận hành của công cụ phun rải thuốc để đảm bảo yêu cầu kỹ thuật.
2.2.3. Thời điểm và số lần xử lý thuốc
Thời điểm và số lần xử lý thuốc phải được thực hiện đúng theo hướng dẫn sử dụng của nhà sản xuất và đăng ký.
Khi không có khuyến cáo cụ thể thời điểm xử lý thuốc thì tùy theo mục đích khảo nghiệm, các đặc tính hóa học, phương thức tác động của thuốc và đặc điểm sinh trưởng của cây trồng thì thuốc được xử lý 1-2 lần cách nhau 7 ngày. Xử lý lần đầu khi tỷ lệ bệnh khoảng 5%.
2.3. Điều tra và thu thập số liệu
2.3.1. Chỉ tiêu, phương pháp và thời điểm điều tra
2.3.1.1. Chỉ tiêu điều tra
|
+ Tỷ lệ bệnh (%) = |
Số lá bị bệnh |
x 100 |
|
Tổng số lá điều tra |
||
|
+ Chỉ số bệnh (%) = |
5n5 + 4n4 + 3n3 + 2n2 + n1 |
x 100 |
|
5 N |
Trong đó:
n1: số lá bị bệnh ở cấp 1 với ≤ 5 % diện tích lá bị bệnh.
n2: số lá bị bệnh ở cấp 2 với > 5 - 15 % diện tích lá bị bệnh.
n3: số lá bị bệnh ở cấp 3 với > 15 - 25% diện tích lá bị bệnh.
n4: số lá bị bệnh ở cấp 4 với > 25 - 50% diện tích lá bị bệnh.
n5: số lá bị bệnh ở cấp 5 với > 50% diện tích lá bị bệnh.
N: tổng số lá điều tra.
2.3.1.2. Phương pháp điều tra
Mỗi ô chọn 5 điểm đối với khảo nghiệm diện hẹp và 10 điểm đối với khảo nghiệm diện rộng trên 2 đường chéo góc, mỗi điểm điều tra, quan sát và ghi nhận mức độ bị bệnh của toàn bộ số lá của 4 cây cố định. Các điểm điều tra phải cách mép ô khảo nghiệm 0,5 m.
2.3.1.3. Thời điểm điều tra
Thời điểm và số lần điều tra ngay trước mỗi lần xử lý thuốc và 7, 14 ngày sau xử lý thuốc lần cuối.
2.3.1.4. Xử lý số liệu
Hiệu lực phòng trừ của thuốc trừ bệnh đối với cây hoa cúc được đánh giá qua tỷ lệ bệnh và chỉ số bệnh tại các lần điều tra.
Các số liệu của khảo nghiệm diện hẹp phải được xử lý bằng các phương pháp thống kê thích hợp.
2.3.1.5. Đánh giá tác động của thuốc đến cây trồng
Đánh giá mọi ảnh hưởng tốt, xấu của thuốc (nếu có) đến sự sinh trưởng và phát triển của cây trồng theo thang phân cấp (phụ Iục 1).
Phương pháp đánh giá:
Những chỉ tiêu nào đo đếm được phải biểu thị bằng các số liệu cụ thể theo các phương pháp điều tra phù hợp.
Các chỉ tiêu đánh giá được bằng mắt như độ cháy lá, quăn lá, sự thay đổi màu sắc lá... thì phải được mô tả.
Nếu thuốc làm ảnh hưởng đến sinh trưởng, phát triển cây trồng phải theo dõi và ghi nhận ngày cây phục hồi trở lại.
2.3.1.6. Quan sát và ghi chép về thời tiết
Ghi chép các số liệu về nhiệt độ, ẩm độ, lượng mưa trong suốt thời gian khảo nghiệm theo số liệu thời tiết tại trạm khí tượng gần nhất.
III. QUY ĐỊNH VỀ QUẢN LÝ THỰC HIỆN
3.1. Báo cáo và công bố kết quả
3.1.1. Đánh giá mức độ độc của thuốc đối với cây trồng (Phụ lục 1)
3.1.2. Nội dung báo cáo (Phụ lục 2)
3.2. Tổ chức quản lý, thực hiện
Đơn vị thực hiện khảo nghiệm phải hoàn toàn chịu trách nhiệm về số liệu đưa ra trong báo cáo và có trách nhiệm lưu giữ số liệu thô của khảo nghiệm.
Căn cứ yêu cầu quản lý, Cục Bảo vệ thực vật có trách nhiệm kiến nghị Bộ Nông nghiệp và Phát triển nông thôn sửa đổi, bổ sung quy chuẩn này khi cần thiết.
Phụ lục 1.
Bảng phân cấp mức độ độc của thuốc khảo nghiệm đối với cây trồng
|
Cấp 1 2 3 4 5 6 7 8 9 |
Triệu chứng nhiễm độc. Cây chưa có biểu hiện ngộ độc. Ngộ độc nhẹ, sinh trưởng của cây giảm nhẹ. Có triệu chứng ngộ độc nhẹ nhìn thấy bằng mắt. Triệu chứng ngộ độc nhưng chưa ảnh hưởng đến năng suất. Cành lá biến màu hoặc cháy, thuốc gây ảnh hưởng đến năng suất. Thuốc làm giảm năng suất ít. Thuốc gây ảnh hưởng nhiều đến năng suất. Triệu chứng ngộ độc tăng dần tới làm chết cây. Cây bị chết hoàn toàn. |
Nếu cây bị ngộ độc thuốc, cần xác định bao nhiêu ngày sau thì cây phục hồi.
Phụ lục 2.
Nội dung chính báo cáo khảo nghiệm
1. Tên khảo nghiệm.
2. Yêu cầu của khảo nghiệm.
3. Điều kiện khảo nghiệm:
- Đơn vị khảo nghiệm.
- Tên cán bộ tiến hành khảo nghiệm
- Thời gian khảo nghiệm.
- Địa điểm khảo nghiệm.
- Nội dung khảo nghiệm.
- Đặc điểm khảo nghiệm.
- Đặc điểm đất đai, canh tác, giống cây trồng...
- Đặc điểm thời tiết trong quá trình khảo nghiệm.
- Tình hình phát sinh và phát triển của sâu hại cây trồng trong khu thí nghiệm.
4. Phương pháp khảo nghiệm:
- Công thức khảo nghiệm.
- Phương pháp bố trí khảo nghiệm.
- Số lần nhắc lại.
- Kích thước ô khảo nghiệm.
- Dụng cụ phun, rải thuốc.
- Lượng thuốc sử dụng kg, lít thuốc thương phẩm/ha hay g (kg) hoạt chất/ha hoặc nồng độ %.
- Lượng nước thuốc sử dụng (l/ha).
- Ngày xử lý thuốc.
- Phương pháp điều tra và đánh giá hiệu lực của các loại thuốc khảo nghiệm.
5. Kết quả khảo nghiệm:
- Các bảng số liệu.
- Đánh giá hiệu lực của từng loại thuốc.
- Nhận xét tác động của từng loại thuốc đến cây trồng, sinh vật có ích và các ảnh hưởng khác (xem phụ lục).
6. Kết luận: Nhận xét về hiệu lực và ảnh hưởng của thuốc khảo nghiệm đối với cây trồng phải căn cứ vào số liệu thu được.
QUY CHUẨN KỸ THUẬT QUỐC GIA VỀ PHƯƠNG PHÁP ĐIỀU TRA PHÁT HIỆN SINH VẬT CHÍNH HẠI CÂY HỒ TIÊU
National technical Regulation on Surveillance method of Black Pepper pests
Lời nói đầu
QCVN 01 - 172 : 2014/BNNPTNT do Phòng Quản lý sinh vật gây hại rừng biên soạn, Cục Bảo vệ thực vật trình duyệt, Bộ Nông nghiệp & PTNT ban hành tại Thông tư số 16/TT-BNNPTNT ngày 05 tháng 6 năm 2014.
QUY CHUẨN KỸ THUẬT QUỐC GIA VỀ PHƯƠNG PHÁP ĐIỀU TRA PHÁT HIỆN SINH VẬT CHÍNH HẠI CÂY HỒ TIÊU
National technical Regulation on Surveillance method of Black Pepper pests
I. QUY ĐỊNH CHUNG
1.1. Phạm vi điều chỉnh
Quy chuẩn này quy định những nguyên tắc, nội dung, phương pháp, chỉ tiêu theo dõi chủ yếu trong điều tra phát hiện sinh vật chính hại hồ tiêu danh mục các sinh vật chính (phụ lục 1).
1.2. Đối tượng áp dụng
Quy chuẩn này bắt buộc áp dụng trong hệ thống tổ chức chuyên ngành Bảo vệ và Kiểm dịch thực vật; các tổ chức, cá nhân có hoạt động liên quan đến điều tra, phát hiện sinh vật hại hồ tiêu trên lãnh thổ Việt Nam.
1.3. Giải thích từ ngữ
Trong quy chuẩn này các từ ngữ dưới đây được hiểu như sau:
1.3.1. Sinh vật hại (SVH)
Là những sinh vật hoạt động làm giảm số lượng, khối lượng, chất lượng cây trồng nông sản.
1.3.2. Sinh vật hại chính
Là những sinh vật thường xuyên xuất hiện phổ biến và hại nặng hàng năm ở địa phương.
1.3.3. Sinh vật hại chủ yếu
Là những sinh vật hại chính, mà tại thời điểm điều tra có mức độ gây hại cao hoặc có khả năng lây lan nhanh, phân bố rộng trong điều kiện ngoại cảnh thuận lợi.
1.3.4. Yếu tố điều tra chính
Là các yếu tố đại diện bao gồm giống, tuổi cây, địa hình.
1.3.5. Khu vực điều tra
Là vườn cây hồ tiêu đại diện cho các yếu tố điều tra được chọn cố định để điều tra ngay từ đầu vụ.
1.3.6. Tuyến điều tra
Là tuyến được xác định theo một lịch trình ở khu vực điều tra nhằm thỏa mãn các yếu tố điều tra chính của địa phương.
1.3.7. Điểm điều tra
Là điểm được bố trí ngẫu nhiên trong từng yếu tố điều tra.
1.3.8. Mẫu điều tra
Là số lượng cây hoặc các bộ phận của cây (lá, thân, cành, hoa, quả,...) trên đơn vị điều tra.
1.3.9. Mật độ sinh vật hại
Là số lượng cá thể sinh vật hại trên một đơn vị diện tích hoặc một đơn vị đối tượng khảo sát.
1.3.10. Tỷ lệ bệnh hoặc tỷ lệ hại
Là số lượng cá thể bị hại tính theo phần trăm (%) so với tổng số các cá thể điều tra trong quần thể.
1.3.11. Chỉ số bệnh hoặc chỉ số hại
Là đại lượng đặc trưng cho mức độ hại của từng loại sinh vật hại được biểu thị bằng phần trăm (%) và tính theo phân cấp được quy định (phụ lục 2).
1.3.12. Sinh vật có ích (thiên địch)
Là kẻ thù tự nhiên của các loài sinh vật hại.
1.3.13. Điều tra định kỳ
Là hoạt động điều tra thường xuyên của cán bộ bảo vệ thực vật theo một thời gian định trước trên tuyến điều tra thuộc khu vực điều tra nhằm nắm được diễn biến của SVH cây trồng và thiên địch.
1.3.14. Điều tra bổ sung
Là mở rộng điều tra vào các thời kỳ xung yếu của cây trồng và SVH đặc thù của các vùng sinh thái, nhằm xác định chính xác thời gian phát sinh, diện phân bố và mức độ gây hại của SVH chủ yếu của địa phương đó.
1.3.15. Diện tích nhiễm sinh vật hại
Là diện tích có mật độ, tỷ lệ hại từ 50% trở lên theo mức quy định của quy chuẩn này về mật độ, tỷ lệ hại để thống kê diện tích.
1.3.16. Cành điều tra
Là đoạn cành có chiều dài 30 cm tính từ đầu lá, đầu hoa, đầu quả.
1.3.17. Hình chiếu tán cây
Là hình chiếu của tán lá chiếu vuông góc xuống mặt đất.
1.3.18. Thân cây hồ tiêu
Là những dây tiêu phát triển theo chiều thẳng đứng, có các rễ bám vào thân cây trụ
1.3.19. Cành quả (cành ác, cành ngang)
Là cành thường phát sinh từ mầm nách ở cây tiêu trên 1 năm tuổi. Cành quả có góc độ phân cành lớn, mọc ngang, độ dài của cành thường ngắn hơn 1 m, cành khúc khuỷu và lóng ngắn.
II. QUY ĐỊNH KỸ THUẬT
2.1. Yêu cầu kỹ thuật
2.1.1. Điều tra
- Điều tra đầy đủ chính xác diễn biến các loại sinh vật hại, sinh vật có ích chính và các yếu tố ngoại cảnh tác động đến chúng.
2.1.2. Nhận định tình hình
- Đánh giá tình hình sinh vật hiện tại, nhận định khả năng phát sinh, phát triển và gây hại của sinh vật hại chính trong thời gian tới, so sánh với kỳ điều tra liền kề trước và cùng kỳ năm trước.
- Dự báo những loại sinh vật thứ yếu có khả năng phát triển thành đối tượng chính, phân tích nguyên nhân của hiện tượng đó.
2.1.3. Thống kê diện tích
Tổng hợp tính toán diện tích bị nhiễm sinh vật hại, (nhẹ, trung bình, nặng) diện tích mất trắng và diện tích đã được xử lý bằng các biện pháp phòng chống.
2.2. Thiết bị và dụng cụ điều tra
2.2.1. Dụng cụ điều tra ngoài vườn hồ tiêu
- Vợt côn trùng (phụ lục 3),
- Thước dây, thước gỗ điều tra, kính lúp cầm tay, thang chữ A, ống nhòm, băng giấy dính, băng dính, dao, kéo;
- Sổ ghi chép, bút viết, máy tính bỏ túi, túi nilon các cỡ, túi xách tay điều tra;
- Ống tuýp, hộp petri và hóa chất cần thiết;
- Bẫy đèn, bẫy bả, kính đeo mắt.
2.2.2. Thiết bị trong phòng thí nghiệm
- Kính lúp hai mắt soi nổi, kính hiển vi, lam, lamen;
- Tủ lạnh, tủ định ôn, máy ôn, ẩm kế tự ghi;
- Máy tính với phần mềm có liên quan;
- Máy khuấy, máy lắc, máy rây.
2.2.3. Trang bị bảo hộ lao động
- Mũ, ủng, áo mưa, găng tay, khẩu trang.
2.3. Phương pháp điều tra
2.3.1. Thời gian điều tra
- Điều tra định kỳ: điều tra 7 ngày/lần (vào các ngày thứ hai hoặc thứ ba hàng tuần) trong khu vực điều tra cố định.
- Điều tra bổ sung (không định kỳ): Tiến hành trước và trong cao điểm xuất hiện gây hại của từng loài sinh vật hại cây hồ tiêu.
2.3.2. Yếu tố điều tra
Chọn đại diện theo giống, tuổi cây, địa hình.
2.3.3. Khu vực điều tra
- Với vùng chuyên canh: diện tích từ 10 ha đến 50 ha, chọn 1 khu vực điều tra.
- Với vùng không chuyên canh: diện tích từ 2 ha đến <10 ha, chọn 1 khu vực điều tra.
2.3.4. Điểm điều tra
Mỗi yếu tố điều tra 10 điểm ngẫu nhiên hoặc nằm ngẫu nhiên trên đường chéo khu vực điều tra. Điểm điều tra phải nằm cách mép ngoài của vườn ít nhất 1 hàng cây hoặc 5 m.
2.3.5. Số mẫu điều tra của một điểm và cách điều tra.
2.3.5.1. Sinh vật hại trên ngọn, lá, chùm hoa, chùm quả
- Cây hồ tiêu ở vườn ươm: mỗi điểm điều tra 1 khung (thời kỳ các bầu ươm để dày, khung điều tra có kích thước 40 x 50 cm; thời kỳ các bầu ươm để tách thưa, khung điều tra là 1m2), điều tra toàn bộ các cây có trong khung và tính tỷ lệ (%) cây bị hại cho từng loài sinh vật hại.
- Cây hồ tiêu ở vườn trồng: Mỗi điểm điều tra 1 trụ, trên mỗi trụ điều tra 3 tầng tán (tầng gốc, tầng giữa và tầng ngọn), mỗi tầng điều tra 4 hướng; mỗi hướng điều tra 1 cành quả. Tính tỉ lệ (%) ngọn, lá, chùm hoa, chùm quả bị hại trên cành điều tra.
2.3.5.2. Sinh vật hại cành
Mỗi điểm điều tra 1 trụ, trên mỗi trụ điều tra 3 tầng tán (tầng gốc, tầng giữa và tầng ngọn). Mỗi tầng điều tra 4 cành quả ở 4 hướng. Tính tỷ lệ (%) cành bị hại; chỉ số hại (%).
2.3.5.3. Sinh vật hại thân
Mỗi điểm điều tra chọn 1 trụ, điều tra tất cả các thân có trên trụ. Trên mỗi thân điều tra 3 đoạn, đoạn gốc, đoạn giữa và đoạn ngọn, mỗi đoạn có chiều dài 50 cm. Tỉnh tỷ lệ (%) thân bị hại và chỉ số hại (%)
2.3.5.4. Sinh vật hại gốc, rễ
Mỗi điểm điều tra 1 trụ, nhận định các sinh vật hại rễ thông qua các biểu hiện triệu chứng hại trên các bộ phận cây trên mặt đất hoặc theo dõi đường đi của kiến sống cộng sinh với rệp sáp trên mặt đất trong khu vực hình chiếu tán cây. Theo dõi, tính tỷ lệ hại, mật độ từng sinh vật hại bằng cách đào các hố điều tra.
2.3.6. Cách điều tra
2.3.6.1. Trên vườn hồ tiêu
- Điều tra phát hiện và diễn biến của sinh vật hại trên cây.
- Quan sát bằng mắt thường từ xa đến gần, sau đó điều tra trực tiếp trên cây hoặc các bộ phận của cây; có thể sử dụng kính lúp cầm tay để quan sát, nhận diện loài sinh vật hại hoặc các triệu chứng gây hại. Dùng vợt để điều tra, thu bắt các loài côn trùng gây hại có hoạt động bay, nhảy trên bề mặt tán cây. Theo dõi mật độ, tỷ lệ hại, phân cấp hại và ghi nhận giai đoạn phát triển của sinh vật hại.
- Điều tra tình hình thiên địch của sinh vật hại
Trong quá trình điều tra phát hiện sinh vật hại, phải quan sát, xác định mật độ của các loài thiên địch. Các loài thiên địch ký sinh, cần thu về phòng để theo dõi ở pha sâu non, nhộng, trưởng thành: 30 cá thể; pha trứng: 30 ổ trứng hoặc 50 quả trứng đối với trứng đơn.
- Thu mẫu để theo dõi xác định loài sinh vật hại, thiên địch mới: Đối với các loài sinh vật hại hoặc thiên địch mới chưa biết, cần phải thu thập mẫu vật đưa về phòng thí nghiệm để theo dõi, giám định hoặc gửi đến các cơ quan chuyên môn để giám định.
2.3.6.2. Trong phòng thí nghiệm
Theo dõi phân tích các mẫu sinh vật hại đã thu được trong quá trình điều tra, xác định các loài sinh vật hại, sinh vật ký sinh, tỷ lệ ký sinh trên từng giai đoạn phát triển của sinh vật hại.
2.3.7. Các chỉ tiêu theo dõi, công thức tính
- Mật độ sinh vật hại (số lượng sinh vật hại/đơn vị mẫu điều tra)
|
Mật độ sinh vật hại |
= |
Tổng số sinh vật hại điều tra được |
|
|
Tổng số đơn vị mẫu điều tra |
|||
|
Tỷ lệ phát dục (%) |
= |
Tổng số cá thể ở từng pha |
x 100 |
|
Tổng số cá thể điều tra |
|||
|
Tỷ lệ hại (%) |
= |
Số đơn vị mẫu điều tra bị hại |
x 100 |
|
Tổng số đơn vị mẫu điều tra |
- Mật độ thiên địch (con/mẫu điều tra)
|
Mật độ thiên địch |
= |
Số thiên địch theo dõi được |
|
|
Tổng số mẫu điều tra |
|||
|
Tỷ lệ ký sinh (%) |
= |
Số cá thể bị ký sinh ở từng pha |
x 100 |
|
Tổng số cá thể theo dõi ở từng pha |
|||
|
Chỉ số hại (%) |
= |
å[(N1 x 1) + … + (Nn x n)] |
x 100 |
|
N x K |
|||
|
Trong đó: |
N1: là số mẫu điều tra bị hại ở cấp 1 Nn: là số mẫu điều tra bị hại ở cấp n N: là tổng mẫu điều tra K: là cấp hại cao nhất của thang phân cấp |
||
- Diện tích nhiễm sinh vật hại (ha)
Căn cứ để tính diện tích nhiễm sinh vật hại (nhẹ, trung bình, nặng, mất trắng) bao gồm:
- Tổng diện tích và cơ cấu diện tích giống, tuổi cây, địa hình.
- Số liệu điều tra của từng yếu tố liên quan.
- Quy định mật độ, tỷ lệ để thống kê diện tích nhiễm.
+ Diện tích nhiễm nhẹ là diện tích có mật độ, tỷ lệ hại từ 50 đến 100% mức quy định.
+ Diện tích nhiễm trung bình là diện tích có mật độ, tỷ lệ hại trên 100 đến 200% mức quy định.
+ Diện tích nhiễm nặng là diện tích có mật độ, tỷ lệ hại trên 200% mức quy định.
+ Diện tích mất trắng: Là tổng số diện tích cộng dồn sinh vật hại làm giảm trên 70% năng suất (dùng để thống kê cuối các đợt dịch hoặc cuối mỗi vụ sản xuất).
+ Tổng số diện tích cây hồ tiêu bị nhiễm sinh vật hại nào đó, là tổng diện tích nhiễm nặng, diện tích nhiễm trung bình, diện tích nhiễm nhẹ và diện tích bị mất trắng.
- Công thức tính diện tích bị nhiễm một loại sinh vật hại theo từng yếu tố điều tra:
|
X (ha) = |
N x b |
|
B |
Trong đó:
X: là diện tích bị nhiễm sinh vật hại của một yếu tố điều tra.
N: là tổng diện tích trồng cây hồ tiêu của yếu tố điều tra trên vùng điều tra.
B: là tổng số điểm điều tra.
b: là số điểm điều tra bị nhiễm sinh vật hại của yếu tố điều tra.
- Diện tích bị nhiễm sinh vật hại ở từng mức (nhẹ, trung bình, nặng) được tính theo công thức sau:
|
Xi (ha) = |
N x Ci |
|
B |
Trong đó:
Xi: là diện tích bị nhiễm sinh vật hại ở mức i (nhẹ, trung bình, nặng) đối với yếu tố điều tra;
N: là tổng diện tích trồng cây hồ tiêu của yếu tố điều tra trên vùng điều tra;
B: là số điểm điều tra
Ci: là số điểm điều tra bị nhiễm sinh vật hại ở cấp độ i (nhẹ, trung bình, nặng) đối với yếu tố điều tra;
2.3.8. Sổ theo dõi, ghi chép, báo cáo
- Sổ theo dõi dịch hại và thiên địch vào bẫy.
- Sổ ghi chép số liệu điều tra sinh vật hại và sinh vật có ích định kỳ, bổ sung.
- Sổ theo dõi diễn biến diện tích nhiễm sinh vật hại thường kỳ, hàng năm.
- Sổ theo dõi số liệu khí tượng.
- Các báo cáo thực hiện theo quy định chung của ngành Bảo vệ thực vật.
III. QUY ĐỊNH VỀ TỔ CHỨC THỰC HIỆN
Cục Bảo vệ thực vật có trách nhiệm tổ chức triển khai việc phổ biến, hướng dẫn áp dụng Quy chuẩn kỹ thuật quốc gia này tới các tổ chức, cá nhân có hoạt động liên quan đến điều tra phát hiện sinh vật hại hồ tiêu trên lãnh thổ Việt Nam.
Các tổ chức, cá nhân có hoạt động liên quan đến điều tra phát hiện dịch hại hồ tiêu trên lãnh thổ Việt Nam có trách nhiệm thực hiện đúng các quy định trong Quy chuẩn kỹ thuật./.
Phụ lục 1.
Danh mục sinh vật hại, vị trí gây hại và quy định về mật độ, tỷ lệ hại làm cơ sở thống kê diện tích nhiễm
|
TT |
Sinh vật hại |
Vị trí gây hại |
Mật độ, tỷ lệ hại |
|
|
Tên Việt Nam |
Tên khoa học |
|||
|
1 |
Rệp sáp |
Pseudococcus sp. |
Thân, cành, chùm hoa, chùm quả, rễ |
20% |
|
2 |
Rệp sáp giả vằn |
Ferria vigata Cockerell |
Cành lá, chùm hoa, chùm quả |
20% |
|
3 |
Rệp sáp mềm xanh |
Coccus viridis Green |
Các bộ phận non |
20% |
|
4 |
Sâu đục thân, cành |
Lophobaris piperis |
Thân, cành |
10% |
|
5 |
Bọ xít lưới |
Elasmognathus nepalensis Distant |
Các bộ phận non |
2 con/cành hoặc 10% bộ phận non bị hại |
|
6 |
Bệnh thán thư |
Collectotrichum gloeosporioides (Penz.) Penz. & Sacc) |
Lá, quả non, cành non |
10% |
|
7 |
Bệnh đốm đen lá |
Rosellinia spp. |
Lá |
10% |
|
8 |
Bệnh khô vằn |
Rhizoctonia solani Kuhn |
Cành, lá, thân |
10% |
|
9 |
Bệnh chết nhanh |
Phytophthora capsici Leonian |
Gốc, rễ, thân |
4% |
|
10 |
Bệnh chết chậm |
Tập hợp nấm và tuyến trùng |
Gốc rễ |
4% |
|
11 |
Bệnh tiêu điên |
Virus |
Lá, đọt non |
10% |
|
12 |
Bệnh tuyến trùng |
Meloidogyne sp., ... |
Rễ |
10% |
|
13 |
Bệnh nấm hồng |
Corticium salmonicolor Berk.&Broome |
Thân, cành |
10% |
Phụ lục 2.
Phân cấp hại
Phân cấp hại được quy định thống nhất theo thang 9 cấp đối với từng loài sinh vật hại như sau:
- Những loài sinh vật hại trên ngọn, lá, chùm hoa, chùm quả
Cấp 1: từ 1 đến 10% diện tích hoặc số ngọn, lá, chùm hoa, chùm quả bị hại;
Cấp 3: từ >10% đến 20% diện tích hoặc số ngọn, lá, chùm hoa, chùm quả bị hại;
Cấp 5: từ >20% đến 30% diện tích hoặc số ngọn, lá, chùm hoa, chùm quả bị hại;
Cấp 7: từ >30% đến 40% diện tích hoặc số ngọn, lá, chùm hoa, chùm quả bị hại;
Cấp 9: từ >40% diện tích hoặc số ngọn, lá, chùm hoa, chùm quả bị hại.
Ghi chú: cấp 1-≤3: nhẹ; cấp >3-<7: Trung bình; Cấp ≥ 7: nặng
- Đối với sinh vật hại thân, cành
Cấp 1: từ 1 đến 10% diện tích hoặc số thân, cành bị hại;
Cấp 3: từ >10% đến 20% diện tích hoặc số cành bị hại;
Cấp 5: từ >20% đến 30% diện tích hoặc số thân, cành bị hại;
Cấp 7: từ >30% đến 40% diện tích hoặc số thân, cành bị hại;
Cấp 9: từ >40% diện tích hoặc số thân, cành bị hại.
Ghi chú: Cấp 1-≤3: nhẹ; Cấp >3-<7: Trung bình; Cấp ≥7: nặng
- Đối với các loại sinh vật hại khác và các sinh vật chích hút có kích thước cơ thể nhỏ (rệp, nhện nhỏ, bọ cánh tơ, bọ xít muỗi...)
Cấp 1: bị hại nhẹ, xuất hiện rải rác đến ≤ 1/3 diện tích hoặc số lá, ngọn, cành non bị hại
Cấp 2: bị hại trung bình (> 1/3 đến ≤ 2/3 diện tích hoặc số lá, ngọn, cành non bị hại)
Cấp 3: bị hại nặng (> 2/3 diện tích hoặc số lá, ngọn, cành non bị hại)
- Đối với các loài sinh vật hại gốc rễ
|
Cấp hại |
Tỷ lệ (%) bị hại |
|
Cấp 1 (nhẹ) |
≤1/3 số rễ bị hại hoặc diện tích tán cây bị vàng, cành bị khô |
|
Cấp 2 (trung bình) |
>1/3 -<2/3 số rễ bị hại hoặc diện tích tán cây bị vàng, cành bị khô |
|
Cấp 3 (nặng) |
≥2/3 số rễ bị hại hoặc diện tích tán cây bị vàng, cành bị chết khô |
Phụ lục 3.
Một số dụng cụ điều tra ngoài thực địa
- Vợt, khay, khung, hố điều tra;
|
Khung điều tra |
Khay điều tra |
Hố điều tra |
Vợt côn trùng
National technical regulation on Procedure for identification of Mal secco (Phoma tracheiphila (Pertri) Kantachveli & Gikachvili) - Plant quarantine pest of Vietnam
Lời nói đầu
QCVN 01 - 173 : 2014/BNNPTNT do Trung tâm Giám định Kiểm dịch thực vật biên soạn, Cục Bảo vệ thực vật trình duyệt, Bộ Nông nghiệp & PTNT ban hành tại Thông tư số 16/TT-BNNPTNT ngày 05 tháng 6 năm 2014.
QUY CHUẨN KỸ THUẬT QUỐC GIA VỀ QUY TRÌNH GIÁM ĐỊNH BỆNH KHÔ CÀNH CAM QUÝT PHOMA TRACHEIPHILA (PERTRI) KANTACHVELI & GIKACHVILI LÀ DỊCH HẠI KIỂM DỊCH THỰC VẬT CỦA VIỆT NAM
National technical regulation on Procedure for identification of Mal secco (Phoma tracheiphila (Pertri) Kantachveli & Gikachvili) - Plant quarantine pest of Vietnam
I. QUY ĐỊNH CHUNG
1.1. Phạm vi điều chỉnh
Quy chuẩn này quy định quy trình giám định bệnh khô cành cam quýt Phoma tracheiphila (Pertri) Kantachveli & Gikachvili - là dịch hại kiểm dịch thực vật nhóm I của Việt Nam
1.2. Đối tượng áp dụng
Quy chuẩn này áp dụng đối với các tổ chức, cá nhân Việt Nam hoặc nước ngoài có hoạt động liên quan đến lĩnh vực bảo vệ và kiểm dịch thực vật thực hiện giám định bệnh khô cành cam quýt Phoma tracheiphila (Pertri) Kantachveli & Gikachvili - là dịch hại kiểm dịch thực vật (KDTV) nhóm I thuộc Danh mục dịch hại KDTV của Việt Nam.
1.3. Giải thích từ ngữ
Trong quy chuẩn này, các từ ngữ dưới đây được hiểu như sau:
1.3.1. Dịch hại kiểm dịch thực vật (plant quarantine pest)
Là loài dịch hại có nguy cơ gây hại nghiêm trọng tài nguyên thực vật trong một vùng mà ở đó loài sinh vật này chưa xuất hiện hoặc xuất hiện có phân bố hẹp và phải được kiểm soát chính thức.
1.3.2. Thực vật (plant)
Là cây và những bộ phận của cây còn sống, kể cả hạt giống và sinh chất có khả năng làm giống.
1.3.3. Mẫu (sample)
Là khối lượng thực vật, sản phẩm thực vật hoặc tàn dư của sản phẩm thực vật được lấy ra theo một qui tắc nhất định.
1.3.4. Tiêu bản (specimen)
Là mẫu vật điển hình tiêu biểu của dịch hại được xử lý để dùng cho việc định loại, nghiên cứu, giảng dạy, phổ biến kỹ thuật và trưng bày thành các bộ sưu tập.
1.3.5. Phản ứng chuỗi trùng hợp hoặc phản ứng khuếch đại gen (Polymerase Chain Reaction - PCR)
Là một kỹ thuật phổ biến trong sinh học phân tử nhằm khuếch đại (tạo ra nhiều bản sao) một đoạn DNA mà không cần sử dụng các sinh vật sống
II. QUY ĐỊNH KỸ THUẬT
2.1. Phương pháp thu thập và bảo quản mẫu
2.1.1. Thu thập mẫu
Đối với hàng xuất, nhập khẩu, quá cảnh hoặc vận chuyển, bảo quản trong nước: Tiến hành lấy mẫu theo tiêu chuẩn Việt Nam TCVN 4731:891 "Kiểm dịch thực vật - phương pháp lấy mẫu", quy chuẩn kỹ thuật quốc gia QCVN 01-22:2010/BNNPTNT1 "Phương pháp kiểm tra cây xuất nhập khẩu và quá cảnh".
Đối với cây trồng ngoài đồng ruộng: Lấy mẫu theo Quy chuẩn kỹ thuật quốc gia QCVN 01-38/2010/BNNPTNT1 "Phương pháp điều tra phát hiện dịch hại cây trồng".
2.1.2. Bảo quản mẫu
Các bộ phận tươi có triệu chứng bệnh (cành, lá, thân) chứa trong các túi ni-lông có lỗ thông khí bảo quản trong tủ lạnh ở nhiệt độ 3 - 5oC.
Các tiêu bản lam của nấm được dán nhãn, để trong hộp chuyên dụng đựng tiêu bản lam và bảo quản ở nhiệt độ phòng.
2.2. Thiết bị dụng cụ, hóa chất
Kính lúp soi nổi có độ phóng đại 10 - 40 lần, kính hiển vi có độ phóng đại 40 - 1.000 lần.
Máy ly tâm, máy lắc, tủ sấy, tủ định ôn, cân điện, máy trộn dịch, máy PCR, máy điện di, buồng tối và máy chụp ảnh
Bộ dao, kim giải phẫu, panh, kéo, bộ piptet, găng tay, đèn cồn, đĩa petri, ống hút, lam, lamen, bình tam giác, cốc đong, ống ly tâm 1,5ml.
Cồn 70o, cồn tuyệt đối, parafin, lactophenol blue, acid acetic, nước cất vô trùng.
Nitơ lỏng, NaCI, phenol:chloroform:isoamylalcohol (25:24:1), chloroform, isopropanol, Proteinase K, Tris-HCI, EDTA, SDS.
MgCI2 ,KCI, dNTP, mồi, Taq DNA polymerase, agarose.
2.3. Phương pháp phát hiện và giám định bệnh
2.3.1. Phát hiện và thu thập mẫu bệnh
Khi lá bị nhiễm bệnh gân lá trở nên trong (gân chính hoặc gân phụ), lá cong và biến vàng, chồi non cũng bị biến vàng. Sau đó lá rụng còn lại cuống lá, cành bị héo và bị chết ngọn (hình 1 đến hình 4, phụ lục 1). Đôi khi trên lá rụng các gân chính hoặc gân phụ có thể biến thành màu đỏ.
Cành bị bệnh có màu nâu hoặc màu nâu nhạt và bị nứt ra bệnh nặng đoạn thân và cành khô, có màu xám tro, trên mặt vết bệnh có các hạt nhỏ màu đen (hình 5, phụ lục 1)
Trên thân cây nhiễm bệnh, khi cắt ngang các mô cây hóa màu hồng hoặc nâu với các mô già (hình 6, phụ lục 1).
2.3.2. Phương pháp giám định bằng đặc điểm hình thái nấm gây bệnh
2.3.2.1. Phương pháp kiểm tra trực tiếp
Bào tử và các quả cành của nấm P. tracheiphila có thể quan sát trực tiếp dưới kính hiển vi quang học. Để quan sát rõ cấu trúc của bào tử và quả cành có thể nhuộm bằng lactophenol blue.
Dùng kim khêu nấm khêu bào tử nấm và quả cành trực tiếp từ các bộ phận bị phần nghi ngờ nhiễm bệnh hoặc có triệu chứng điển hình, đặt lên lam đã có 01 giọt lactophenol và đậy lamen. Đặt lam lên kính hiển vi và quan sát đặc điểm hình thái, đo kích thước bào tử nấm và so sánh với đặc điểm bào tử của nấm P. tracheiphila (phụ lục 1).
2.3.2.2. Phương pháp để ẩm
Các cành khô, các mẫu thân có triệu chứng bệnh (trên cành có các vùng khô màu xám chì hoặc xám tro, các thân cây mà mạch dẫn hóa màu hồng) để ẩm trong 12-24 giờ. Sau đó dùng kim khêu nấm khêu bào tử trực tiếp từ các phần nghi ngờ nhiễm bệnh, đặt lên lam đã có 01 giọt lactophenol. Đặt lam lên kính hiển vi và tìm, quan sát đặc điểm hình thái, đo kích thước bào tử nấm.
Quan sát trên kính hiển vi so sánh với đặc điểm bào tử của nấm P. tracheiphila (phụ lục 1)
2.3.2.3. Phương pháp phân lập nấm từ vật liệu nhiễm bệnh
Cắt ở phần rìa vết bệnh một đoạn thân, cành khoảng 20-100mm và nhúng vào cồn tuyệt đối. Sau đó, đốt đoạn thân trên đèn cồn. Khi lửa tắt dùng dao khử trùng cắt ngang hoặc dọc đoạn thân, cành thành những lát mỏng.
Nuôi cấy các lát mỏng trên môi trường PDA hoặc CPA ở 22-24oC. Sau 3-5 ngày, kiểm tra sắc tố nấm tiết ra trên đĩa môi trường bằng cách soi đĩa lên ánh sáng (hình 9, phụ lục 1). Tiếp theo, cấy truyền làm thuần nấm.
Khêu mẫu nấm đã thuần từ môi trường nuôi cấy đưa lên lam và quan sát dưới kính hiển vi. Quan sát đặc điểm hình thái của bào tử nấm thu được.
So sánh với đặc điểm hình thái của bào tử nấm P. tracheiphila (phụ lục 1)
2.3.3. Phương pháp giám định PCR
Sử dụng phương pháp PCR để giám định nấm P. tracheiphila (Pertri) Kantachveli & Gikachvili gây bệnh khô cành cam quýt.
Quy trình chi tiết như phụ lục 2.
III. THẨM ĐỊNH KẾT QUẢ GIÁM ĐỊNH VÀ BÁO CÁO
Sau khi khẳng định kết quả giám định bệnh khô cành cam quýt Phoma tracheiphila (Pertri) Kantachveli & Gikachvili- là dịch hại kiểm dịch thực vật của Việt Nam, đơn vị giám định phải gửi báo cáo về Cục Bảo vệ thực vật kèm theo phiếu kết quả giám định (phụ lục 4).
Tất cả các đơn vị thuộc hệ thống Bảo vệ và KDTV phải lưu giữ, quản lý và khai thác dữ liệu về kết quả điều tra, báo cáo và giám định bệnh khô cành cam quýt.
Đối với đơn vị lần đầu tiên giám định và phát hiện được bệnh khô cành cam quýt Phoma tracheiphila (Pertri) Kantachveli & Gikachvili phải gửi mẫu hoặc tiêu bản về Trung tâm Giám định kiểm dịch thực vật để thẩm định.
Đơn vị giám định phải đảm bảo thời gian lưu mẫu theo quy định hiện hành.
IV. TỔ CHỨC THỰC HIỆN
Cục Bảo vệ thực vật có trách nhiệm phổ biến; tổ chức, hướng dẫn và kiểm tra việc thực hiện Quy chuẩn này trong hệ thống tổ chức chuyên ngành Bảo vệ và Kiểm dịch thực vật cũng như các tổ chức, cá nhân khác có liên quan;
Các tổ chức, cá nhân có hoạt động liên quan đến điều tra, thu thập mẫu, xử lý và bảo quản mẫu bệnh khô cành cam quýt Phoma tracheiphila (Pertri) Kantachveli & Gikachvili tại Việt Nam phải tuân theo quy định của quy chuẩn này cũng như các quy định của pháp luật có liên quan hiện hành.
Phụ lục 1.
Thông tin về dịch hại
1. Phân bố và ký chủ
1.1. Phân bố
Trong nước: Bệnh chưa có ở Việt Nam
Trên thế giới: Châu Á (Armenia, Georgia, Iraq, Lebanon, Syria, Israel, Thổ Nhĩ Kì, Yemen), Châu Phi (Tunisia, Ai Cập, Libya, Algeria), Châu Âu (Hy Lạp, Albania, Hy Lạp, Italy, Liên Bang Nga, Cyprus, Pháp, Bỉ, Hà Lan)
1.2. Ký chủ: Hầu hết các loài thuộc họ Citrus đều mẫn cảm với bệnh nhưng chanh (Citrus limon) là loài bị hại nặng nhất. Các loài kí chủ khác là Phật thủ (Citrus medica), Citrus bergamia, Quýt (Citrus reticulata), Cam chua (Citrus aurantium), Citrofortunella microcarpa, Citrus aurantiifolia, Citrus jambhiri, Citrus latifolia, Citrus limonia, Citrus macrophylla, Citrus sinensis, Citrus unshiu, Citrus x paradisi, Quất (Fortunella), Poncirus trifoliata
2. Tên khoa học và vị trí phân loại
Tên tiếng Việt: Bệnh khô cành cam quýt
Tên khoa học: Phoma tracheiphila (Pertri) Kantachveli & Gikachvili
Tên khác:
Bakerophoma tracheiphila (Petri) Cif.
Deuterophoma tracheiphila Petri
Vị trí phân loại:
Lớp: Dothideomycetes
Bộ: Pleosporales
Họ: Pleosporaceae
3. Triệu chứng bệnh khô cành cam quýt

|
Hình 1: Triệu chứng trên lá của bệnh khô cành cam quýt P. tracheiphila (Nguồn: PaDIL, 2012) |
Hình 2: Lá rụng còn lại cuống do bệnh khô cành cam quýt P. tracheiphila (Nguồn: PaDIL, 2012) |

|
Hình 3: Cành héo do bệnh khô cành cam quýt P. tracheiphila (Nguồn: PaDIL, 2012) |
Hình 4: Chết ngọn do bệnh khô cành cam quýt P. tracheiphila (Nguồn: PaDIL, 2012) |

|
Hình 5: Vết bệnh có chứa các quả cành nấm P. tracheiphila (Nguồn: PaDIL, 2012) |
Hình 6: Triệu chứng bó mạch hóa hồng của bệnh khô cành cam quýt (Nguồn: PaDIL, 2012) |
4. Đặc điểm hình thái bào tử nấm P. tracheiphila
Quả cành hình cầu, hơi kéo dài thành một cổ ngắn có miệng nhỏ, màu đen đường kính 60-165x45-150mm (hình 7, phụ lục 1). Các bào tử phân sinh nằm trong quả cành dạng đơn bào, kích thước 0,5-1,5x2-4mm.
Bào tử phân sinh được sinh ra từ các tế bào sinh bào tử. Bào tử phân sinh (phialoconidia) đơn bào thường có 1 đến 3 giọt dầu màu trong suốt, dạng thẳng hoặc cong, đầu bào tử tròn kích thước 1,5-3x3-8mm thường được sản sinh bởi các tế bào sinh bào tử ở trên các sợi nấm tự do phát triển ở vùng gỗ trên thân lộ ra ngoài, phần mô bị thương hoặc trong mạch dẫn (hình 8, phụ lục 1).
Bào tử đính dạng chồi (blastoconidia) có dạng trứng hoặc dạng quả lê được sinh ra từ mạch dẫn cây kí chủ và trên môi trường nuôi cấy nhân tạo lỏng.

Hình 7: Quả cành của nấm P. tracheiphila
(Nguồn: S. Grasso,1992)
|
Hình 8: Bào tử (phialoconidia) của P. tracheiphila (Nguồn: EPPO,2004) |
Hình 9: Sắc tố đỏ trên đĩa khi đặt các lát cành nhiễm bệnh khô cành trên môi trường PDA (Nguồn: PaDIL, 2009) |
Phụ lục 2.
(quy định)
Quy trình giám định bệnh khô cành cam quýt bằng PCR
1. Tách chiết DNA tổng số
1.1. Tách chiết DNA tổng số từ mô cây (mô gỗ, cành, lá)
Nghiền 500mg mô cây bằng chày và cối sứ trong nitơ lỏng. Chuyển 100mg mô nghiền vào ống eppendorf chứa 450ml dịch chiết cây.Trộn đều bằng máy trộn dịch. Ủ ở 65oC trong 1 giờ.Thêm vào ống 300ml NaCI 6M và trộn đều bằng máy trộn dịch. Ly tâm 12.000 vòng/phút trong 15 phút và thu dịch nổi vào ống mới. Thêm phenol:chloroform:isoamylalcohol (25:24:1) vào ống với một thể tích tương đương và trộn đều bằng máy trộn dịch. Ly tâm 12.000 vòng/phút trong 15 phút thu dịch nổi. Thêm chloroform vào ống với một thể tích tương đương và trộn đều bằng máy trộn dịch. Ly tâm 12.000 vòng/phút trong 15 phút thu dịch nổi. Thêm isopropanol vào ống một thể tích tương đương. Ly tâm 12.000 vòng/phút trong 15 phút thu tủa DNA loại bỏ dịch. Thêm vào ống 100ml Ethanol 70% để rửa tủa DNA. Loại bỏ Ethanol để tủa DNA khô tự nhiên trong 10 phút. Hòa tan tủa DNA trong 100ml TE pH8 bảo quản ở 4oC.
1.2. Tách chiết DNA tổng số từ sợi nấm nuôi cấy trên môi trường.
Dùng kim khêu nấm vô trùng chuyển sợi nấm từ đĩa nuôi cấy vào ống eppendorf. Nghiền nhỏ nấm bằng chày nhựa vô trùng trong nitơ tỏng. Chuyển hỗn hợp nghiền vào ống eppendorf mới đã chứa 400ml dịch chiết nấm. Trộn đều bằng máy trộn dịch. Thêm vào ống 8ml Proteinase K 20mg/ml lắc nhẹ. Ủ ở 65oC trong 2 giờ hoặc qua đêm.Thêm vào 300ml NaCI 6M trộn bằng máy trộn dịch trong 30 giây. Ly tâm 13.000 vòng/phút trong 30 phút thu dịch phía trên. Thêm isopropanol vào ống với một thể tích tương đương lắc nhẹ. Ủ ở -20oC trong 1 giờ hoặc lâu hơn. Ly tâm 13.000 vòng/phút trong 15 phút thu tủa DNA loại bỏ dịch. Thêm vào 100ml Ethanol 70% để rửa tủa DNA. Loại bỏ ethanol, để tủa DNA khô tự nhiên trong 10 phút. Hòa tan tủa DNA trong 100ml TE pH8 bảo quản ở 4oC.
2. Nhân gen bằng máy PCR.
Đoạn mồi sử dụng
Pt-FOR2 (5'-GGATGGGCGCCAGCCTTC-3')
Pt-REV2 (5'-GCACAAGGGCAGTGGACAAA-3')
Master mix: 25ml mỗi phản ứng
1.5 mM MgCI2,
50 mM KCl;
200 mM mỗi loại dATP, dCTP, dGTP và dTTP
1.0 mM mỗi mồi
10 ng DNA tách chiết
0.8 ml Taq DNA polymerase
3. Chu trình nhiệt
|
94oC trong 5 phút |
|
|
94oC trong 30 giây |
Lặp lại 30 chu kì |
|
65oC trong 60 giây |
|
|
72oC trong 90 giây |
|
|
72oC trong 5 phút |
|
4. Đọc kết quả
Sản phẩm nhân gen được điện di trong gel agarose 1,5% trong 2,5 giờ hiệu điện thế 3,3 V/cm trong dung môi TAE. Nhuộm gel bằng ethidium bromide và quan sát dưới đèn UV
Mẫu dương tính cho ra đoạn gen kích thước 378bp
5. Thành phần dịch chiết dùng cho PCR
5.1. Thành phần dịch chiết cây
0,4 M NaCI; 10 mM Tris-HCI pH 8,0; 2,0 mM EDTA pH 8,0; 400 mg/mL proteinase K; 2% SDS
5.2. Thành phần dịch chiết nấm
400 mM NaCI; 10 mM Tris-CI pH 8,0; 2 mM EDTA; 20 g/l SDS
Phụ lục 3.
Một số loại môi trường nuôi cấy nấm
1. Môi trường PDA
Cân 200g khoai tây
Cắt thành những hình lập phương 1x1x1 cm
Đun trong 1 giờ.
Lọc qua vải lọc thu nước trong.
Thêm 20g dextrose.
Thêm 15 g Agar.
Thêm nước cất cho đủ 1 lít.
2. Môi trường CPA
Rửa sạch mài nhuyễn hoặc nghiền nhỏ cà rốt và khoai tây.
Lấy mỗi loại 20g đun trong nước cất khoảng 1 giờ
Lọc qua vải lọc chỉ thu lại phần nước trong
Thêm vào 15g agar
Thêm nước cất cho đủ 1 lít
Phụ lục 4.
(quy định)
Mẫu phiếu kết quả giám định
|
Cơ quan Bảo vệ |
CỘNG HÒA XÃ
HỘI CHỦ NGHĨA VIỆT NAM |
|
|
……….. ngày …. tháng …. năm 20….. |
PHIẾU KẾT QUẢ GIÁM ĐỊNH
Bệnh khô cành cam quýt Phoma tracheiphila (Pertri) Kantachveli & Gikachvili- là dịch hại kiểm dịch thực vật của Việt Nam
|
1. Tên hàng hóa |
: |
|
|
2. Nước xuất khẩu |
: |
|
|
3. Xuất xứ |
: |
|
|
4. Phương tiện vận chuyển |
: |
Khối lượng: |
|
5. Địa điểm lấy mẫu |
: |
|
|
6. Ngày lấy mẫu |
: |
|
|
7. Người lấy mẫu |
: |
|
|
8. Tình trạng mẫu |
: |
|
|
9. Ký hiệu mẫu |
: |
|
|
10. Số mẫu lưu |
: |
|
|
11. Người giám định |
: |
|
12. Phương pháp giám định: Theo quy chuẩn kỹ thuật quốc gia QCVN 01 - 173 : 2014/BNNPTNT về "Quy trình giám định bệnh khô cành cam quýt Phoma tracheiphila (Pertri) Kantachveli & Gikachvili- là dịch hại kiểm dịch thực vật của Việt Nam".
13. Kết quả giám định
Tên khoa học: Phoma tracheiphila (Pertri) Kantachveli & Gikachvili
Lớp: Dothideomycetes
Bộ: Pleosporales
Họ: Pleosporaceae
Là dịch hại kiểm dịch thực vật thuộc danh mục dịch hại kiểm dịch thực vật của Việt Nam.
|
TRƯỞNG PHÒNG KỸ
THUẬT |
THỦ TRƯỞNG ĐƠN VỊ |
National technical regulation on bio-efficacy field trials against canker (Xanthomonas campestris pv.citri (Hasse) Dowson) on citrus of fungicides
Lời nói đầu
QCVN 01 - 174 : 2014/BNNPTNT do Trung tâm Kiểm định và Khảo nghiệm thuốc bảo vệ thực vật biên soạn, Cục Bảo vệ thực vật trình duyệt, Bộ Nông nghiệp & PTNT ban hành tại Thông tư số 16/TT-BNNPTNT ngày 05 tháng 6 năm 2014.
QUY CHUẨN KỸ THUẬT QUỐC GIA VỀ KHẢO NGHIỆM TRÊN ĐỒNG RUỘNG HIỆU LỰC PHÒNG TRỪ BỆNH LOÉT (XANTHOMONAS CAMPESTRIS PV.CITRI (HASSE) DOWSON) HẠI CÂY CÓ MÚI CỦA CÁC THUỐC PHÒNG TRỪ BỆNH
National technical regulation on bio-efficacy field trials against canker (Xanthomonas campestris pv.citri (Hasse) Dowson) on citrus of fungicides
I. QUY ĐỊNH CHUNG
1.1. Phạm vi điều chỉnh
Quy chuẩn này quy định những nguyên tắc, nội dung và phương pháp chủ yếu để đánh giá hiệu lực phòng trừ bệnh loét (Xanthomonas campestris pv.citri (Hasse) Dowson) hại cây có múi của các loại thuốc trừ bệnh.
1.2. Đối tượng áp dụng
Quy chuẩn này áp dụng cho các cơ quan, tổ chức thực hiện khảo nghiệm thuốc bảo vệ thực vật.
1.3. Giải thích từ ngữ
Những thuật ngữ trong quy chuẩn này được hiểu như sau:
1.3.1. Dịch hại
Là bất cứ loài, chủng hoặc biotype của tác nhân gây tổn hại thực vật, động vật hoặc gây bệnh cho thực vật hoặc sản phẩm thực vật (FAO, 1995; IPPC, 1997).
1.4. Điều kiện khảo nghiệm
Khảo nghiệm phải được tiến hành tại các cơ sở có đủ điều kiện theo quy định hiện hành về khảo nghiệm thuốc bảo vệ thực vật của Bộ Nông nghiệp và Phát triển nông thôn.
Khảo nghiệm được bố trí trên những ruộng sản xuất cây có múi thường bị bệnh loét gây hại, tại các thời điểm có điều kiện thuận lợi cho bệnh phát triển và ở các địa điểm đại diện cho các vùng sinh thái.
Điều kiện trồng trọt (đất, phân bón, giống cây trồng, mật độ trồng...) phải đồng đều trên toàn khu khảo nghiệm và phù hợp với tập quán canh tác tại địa phương.
Các khảo nghiệm trên diện hẹp và diện rộng phải được tiến hành ở ít nhất 2 vùng sản xuất nông nghiệp (phía Bắc và phía Nam) đại diện cho khu vực sản xuất cây có múi.
Trong thời gian khảo nghiệm không được sử dụng bất kỳ một loại thuốc trừ bệnh khác trên khu khảo nghiệm (bao gồm cả các công thức và dải phân cách). Nếu khu khảo nghiệm bắt buộc phải sử dụng thuốc để trừ các đối tượng gây hại khác như: sâu, cỏ dại, điều hòa sinh trưởng... thì thuốc được sử dụng để trừ các đối tượng này phải không làm ảnh hưởng đến thuốc cần khảo nghiệm, không làm ảnh hưởng đến đối tượng khảo nghiệm và phải được xử lý đều trên tất cả các ô khảo nghiệm, kể cả ô đối chứng. Các trường hợp trên (nếu có) phải được ghi chép lại.
Khi xử lý thuốc không để thuốc ở ô khảo nghiệm này tạt sang ô khảo nghiệm khác.
II. QUY ĐỊNH KỸ THUẬT
2.1. Phương pháp khảo nghiệm
2.1.1. Bố trí công thức khảo nghiệm
Khảo nghiệm được bố trí theo phương pháp khối ngẫu nhiên đầy đủ hoặc theo các phương pháp khác đã được quy định trong thống kê sinh học.
Mỗi khảo nghiệm phải thực hiện theo các công thức sau:
Công thức khảo nghiệm là công thức sử dụng các loại thuốc định khảo nghiệm ở những nồng độ khác nhau hoặc theo cách sử dụng khác nhau.
Công thức so sánh là công thức sử dụng một loại thuốc trừ bệnh đã được đăng ký trong danh mục thuốc bảo vệ thực vật được phép sử dụng ở Việt Nam và đang được sử dụng phổ biến, có hiệu quả ở địa phương để phòng trừ bệnh loét hại cây có múi.
Công thức đối chứng là công thức không sử dụng bất kỳ loại thuốc bảo vệ thực vật nào để phòng trừ bệnh loét hại cây có múi. Với khảo nghiệm là thuốc phun: công thức đối chứng được phun bằng nước lã.
2.1.2. Diện tích ô khảo nghiệm và số lần nhắc lại
Khảo nghiệm diện hẹp: Diện tích ô khảo nghiệm tối thiểu là 10 m2 đối với cây trong vườn ươm. Đối với các vườn kinh doanh, kích thước của mỗi ô khảo nghiệm tối thiểu là 5 cây. Số lần nhắc lại 3 - 4 lần.
Khảo nghiệm diện rộng: Diện tích của mỗi ô khảo nghiệm tối thiểu là 30 m2 đối với cây vườn ươm. Đối với các vườn kinh doanh, kích thước của mỗi ô khảo nghiệm tối thiểu là 15 cây. Số lần nhắc lại là không.
Các ô khảo nghiệm phải có hình dạng vuông hay hình chữ nhật nhưng chiều dài không gấp đôi chiều rộng đối với khảo nghiệm trong vườn ươm.
Giữa các công thức khảo nghiệm phải có dải phân cách rộng 0,5 m đối với cây vườn ươm và 1 hàng cây với cây kinh doanh.
2.2. Tiến hành xử lý thuốc
2.2.1. Lượng thuốc và lượng nước thuốc sử dụng
Lượng thuốc sử dụng được tính bằng nồng độ % trên đơn vị diện tích 1 ha.
Với dạng thuốc thương phẩm pha với nước để phun: Lượng nước sử dụng phải theo hướng dẫn cụ thể đối với từng loại thuốc, phù hợp với giai đoạn sinh trưởng của cây cũng như cách thức tác động của từng loại thuốc. Khi không có khuyến cáo của các tổ chức cá nhân đăng ký về lượng nước thuốc, lượng nước thuốc sử dụng từ 600 - 1000 l/ha.
Các số liệu về lượng thuốc thành phẩm và lượng nước sử dụng (l/ha) phải được ghi rõ.
2.2.2. Dụng cụ xử lý thuốc
Dụng cụ xử lý thuốc: Bình bơm động cơ, bình bơm tay đeo vai, cốc đong, cân, pipet...
Khi xử lý thuốc, phải dùng các công cụ phun, rải thuốc thích hợp đảm bảo yêu cầu của khảo nghiệm, ghi chép đầy đủ tình hình vận hành của công cụ phun rải thuốc để đảm bảo yêu cầu kỹ thuật.
2.2.3. Thời điểm và số lần xử lý thuốc
Thời điểm và số lần xử lý thuốc thực hiện đúng theo hướng dẫn sử dụng của nhà sản xuất và đăng ký.
Khi không có khuyến cáo cụ thể thời điểm xử lý thuốc thì tùy theo mục đích khảo nghiệm, các đặc tính hóa học, phương thức tác động của thuốc và đặc điểm sinh trưởng của cây trồng thì số lần xử lý thuốc từ 1 - 2 lần cách nhau 7 ngày. Xử lý lần đầu khi tỷ lệ bệnh khoảng 5%.
2.3. Điều tra và thu thập số liệu
2.3.1. Chỉ tiêu, phương pháp và thời điểm điều tra
2.3.1.1. Chỉ tiêu điều tra
|
+ Tỷ lệ bệnh (%) = |
Số lá (quả) bị bệnh |
x 100 |
|
Tổng số lá (quả) điều tra |
||
|
+ Chỉ số bệnh (%) = |
5n5 + 4n4 + 3n3 + 2n2 + n1 |
x 100 |
|
5 N |
Trong đó:
n1: số lá (quả) bị bệnh ở cấp 1 với ≤ 5 % diện tích lá (quả) bị bệnh.
n2: số lá (quả) bị bệnh ở cấp 2 với > 5 - 10 % diện tích lá (quả) bị bệnh.
n3: số lá (quả) bị bệnh ở cấp 3 với >10 - 15% diện tích lá (quả) bị bệnh.
n4: số lá (quả) bị bệnh ở cấp 4 với >15 - 20% diện tích lá (quả) bị bệnh.
n5: số lá (quả) bị bệnh ở cấp 5 với > 20% diện tích lá (quả) bị bệnh.
N: tổng số lá (quả) điều tra.
2.3.1.2. Phương pháp điều tra
Với khảo nghiệm trên vườn ươm: Mỗi ô chọn 5 điểm đối với khảo nghiệm diện hẹp và 10 điểm đối với khảo nghiệm diện rộng trên 2 đường chéo góc, mỗi điểm điều tra, quan sát và ghi nhận mức độ bị bệnh toàn bộ số lá của 4 cây cố định. Các điểm điều tra phải cách mép ô khảo nghiệm 0,2 m.
Với khảo nghiệm trên vườn cây kinh doanh: Mỗi ô điều tra ngẫu nhiên 3 cây đối với khảo nghiệm diện hẹp và 6 cây đối với khảo nghiệm diện rộng, mỗi cây điều tra, quan sát và ghi nhận mức độ bị bệnh của toàn bộ số lá hoặc quả của 4 cành cấp 3 ở tầng giữa theo 4 hướng cây. Các cành điều tra được cố định trong suốt thời gian khảo nghiệm.
2.3.1.3. Thời điểm điều tra
Thời điểm và số lần điều tra ngay trước mỗi lần xử lý thuốc và 7, 14 ngày sau xử lý thuốc lần cuối.
2.3.1.4. Xử lý số liệu
Hiệu lực phòng trừ của thuốc trừ bệnh đối với cây có múi được đánh giá qua tỷ lệ bệnh và chỉ số bệnh tại các lần điều tra.
Các số liệu của khảo nghiệm diện hẹp phải được xử lý bằng các phương pháp thống kê thích hợp.
2.3.1.5. Đánh giá tác động của thuốc đến cây trồng
Đánh giá mọi ảnh hưởng tốt, xấu của thuốc (nếu có) đến sự sinh trưởng và phát triển của cây trồng theo thang phân cấp (phụ lục 1).
Phương pháp đánh giá:
Những chỉ tiêu nào đo đếm được phải biểu thị bằng các số liệu cụ thể theo các phương pháp điều tra phù hợp.
Các chỉ tiêu đánh giá được bằng mắt như độ cháy lá, quăn lá, sự thay đổi màu sắc lá ... thì phải được mô tả.
Nếu thuốc làm ảnh hưởng đến sinh trưởng, phát triển cây trồng phải theo dõi và ghi nhận ngày cây phục hồi trở lại.
2.3.1.6. Quan sát và ghi chép về thời tiết
Ghi chép các số liệu về nhiệt độ, ẩm độ, lượng mưa trong suốt thời gian khảo nghiệm theo số liệu thời tiết tại trạm khí tượng gần nhất.
III. QUY ĐỊNH VỀ QUẢN LÝ THỰC HIỆN
3.1. Báo cáo và công bố kết quả
3.1.1. Đánh giá mức độ độc của thuốc đối với cây trồng (Phụ lục 1)
3.1.2. Nội dung báo cáo (Phụ lục 2)
3.2. Tổ chức quản lý, thực hiện
Đơn vị thực hiện khảo nghiệm phải hoàn toàn chịu trách nhiệm về số liệu đưa ra trong báo cáo và có trách nhiệm lưu giữ số liệu thô của khảo nghiệm.
Căn cứ yêu cầu quản lý, Cục Bảo vệ thực vật có trách nhiệm kiến nghị Bộ Nông nghiệp và Phát triển nông thôn sửa đổi, bổ sung quy chuẩn này khi cần thiết.
Phụ lục 1.
Bảng phân cấp mức độ độc của thuốc khảo nghiệm đối với cây trồng
|
Cấp 1 2 3 4 5 6 7 8 9 |
Triệu chứng nhiễm độc. Cây chưa có biểu hiện ngộ độc. Ngộ độc nhẹ, sinh trưởng của cây giảm nhẹ. Có triệu chứng ngộ độc nhẹ nhìn thấy bằng mắt. Triệu chứng ngộ độc nhưng chưa ảnh hưởng đến năng suất. Cành lá biến màu hoặc cháy, thuốc gây ảnh hưởng đến năng suất. Thuốc làm giảm năng suất ít. Thuốc gây ảnh hưởng nhiều đến năng suất. Triệu chứng ngộ độc tăng dần tới làm chết cây. Cây bị chết hoàn toàn. |
Nếu cây bị ngộ độc thuốc, cần xác định bao nhiêu ngày sau thì cây phục hồi.
Phụ lục 2.
Nội dung chính báo cáo khảo nghiệm
1. Tên khảo nghiệm.
2. Yêu cầu của khảo nghiệm.
3. Điều kiện khảo nghiệm:
- Đơn vị khảo nghiệm.
- Tên cán bộ tiến hành khảo nghiệm.
- Thời gian khảo nghiệm.
- Địa điểm khảo nghiệm.
- Nội dung khảo nghiệm.
- Đặc điểm khảo nghiệm.
- Đặc điểm đất đai, canh tác, giống cây trồng...
- Đặc điểm thời tiết trong quá trình khảo nghiệm.
- Tình hình phát sinh và phát triển của sâu hại cây trồng trong khu thí nghiệm.
4. Phương pháp khảo nghiệm
- Công thức khảo nghiệm.
- Phương pháp bố trí khảo nghiệm.
- Số lần nhắc lại.
- Kích thước ô khảo nghiệm.
- Dụng cụ phun, rải thuốc.
- Lượng thuốc sử dụng nồng độ %, kg, lít thuốc thương phẩm/ha hay g (kg) hoạt chất/ha.
- Lượng nước thuốc sử dụng (l/ha).
- Ngày xử lý thuốc.
- Phương pháp điều tra và đánh giá hiệu lực của các loại thuốc khảo nghiệm.
5. Kết quả khảo nghiệm:
- Các bảng số liệu.
- Đánh giá hiệu lực của từng loại thuốc.
- Nhận xét tác động của từng loại thuốc đến cây trồng, sinh vật có ích và các ảnh hưởng khác (xem phụ lục).
6. Kết luận: Nhận xét về hiệu lực và ảnh hưởng của thuốc khảo nghiệm đối với cây trồng phải căn cứ vào số liệu thu được.
National technical regulation on procedure for preservation and handling of samples in plant quarantine
Lời nói đầu
QCVN 01 - 175 : 2014/BNNPTNT do Trung tâm Giám định Kiểm dịch thực vật biên soạn, Cục Bảo vệ thực vật trình duyệt, Bộ Nông nghiệp & PTNT ban hành tại Thông tư số 16/TT-BNNPTNT ngày 05 tháng 6 năm 2014.
QUY CHUẨN KỸ THUẬT QUỐC GIA VỀ QUY TRÌNH LƯU GIỮ, BẢO QUẢN VÀ VẬN CHUYỂN MẪU TRONG KIỂM DỊCH THỰC VẬT
National technical regulation on procedure for preservation and handling of samples in plant quarantine
I. QUY ĐỊNH CHUNG
1.1. Phạm vi điều chỉnh
Quy chuẩn này áp dụng thống nhất trên phạm vi toàn quốc cho việc lưu giữ, bảo quản và vận chuyển mẫu trong công tác kiểm dịch thực vật ở Việt Nam.
1.2. Đối tượng áp dụng
Quy chuẩn này áp dụng đối với mọi tổ chức, cá nhân của Việt Nam hoặc nước ngoài có hoạt động liên quan đến lĩnh vực bảo vệ và kiểm dịch thực vật (KDTV) tại Việt Nam thực hiện việc lưu giữ, bảo quản và vận chuyển mẫu trong công tác kiểm dịch thực vật ở Việt Nam.
1.3. Giải thích từ ngữ
Những thuật ngữ trong quy chuẩn này được hiểu như sau:
1.3.1. Dịch hại kiểm dịch thực vật (plant quarantine pest)
Loài sinh vật gây hại có nguy cơ gây tác hại nghiêm trọng tài nguyên thực vật trong một vùng mà ở đó loài sinh vật này chưa có mặt hoặc có mặt với phân bố hẹp và được kiểm soát chính thức.
1.3.2. Thực vật (plant)
Cây và những bộ phận của cây còn sống gồm cả hạt giống và những nguồn gen có khả năng làm giống.
1.3.3. Tiêu bản (specimen)
Là mẫu vật điển hình tiêu biểu của dịch hại được xử lý để dùng cho việc định loại, nghiên cứu, giảng dạy, phổ biến kỹ thuật và trưng bày thành các bộ sưu tập.
1.3.4. Sản phẩm thực vật (plant product)
Vật liệu chưa chế biến có nguồn gốc thực vật (kể cả hạt) và các sản phẩm đã chế biến mà bản chất của chúng hoặc quá trình chế biến có thể tạo ra nguy cơ cho sự du nhập và lan rộng của dịch hại.
1.3.5. Mẫu (sample)
Là khối lượng thực vật, sản phẩm thực vật, tàn dư của sản phẩm thực vật hoặc đất được lấy ra theo một quy tắc nhất định.
1.3.6. Mẫu ban đầu (primary sample)
Là khối lượng mẫu thực vật, sản phẩm thực vật hoặc tàn dư của sản phẩm thực vật được lấy ra từ một vị trí trong lô vật thể.
1.3.7. Mẫu chung (aggregate sample)
Là mẫu gộp các mẫu ban đầu.
1.3.8. Mẫu trung bình (average sample)
Là mẫu được lấy từ mẫu chung theo phương pháp của tiêu chuẩn Việt Nam TCVN 4731:891, dùng làm mẫu lưu, mẫu phân tích, mẫu gửi và mẫu tồn.
1.3.9. Mẫu phân tích (sample for testing)
Là mẫu được lấy từ mẫu trung bình theo nguyên tắc đường chéo và được dùng để phân tích trong phòng thí nghiệm.
1.3.10. Mẫu lưu (stored sample)
Là mẫu được lấy từ mẫu trung bình theo nguyên tắc đường chéo, được lưu lại trong thời gian quy định để làm cơ sở để giải quyết khiếu nại trong công tác kiểm dịch thực vật.
1.3.11. Mẫu gửi (delivered sample)
Là mẫu được lấy từ mẫu trung bình theo nguyên tắc đường chéo và được gửi đi giám định hoặc theo dõi sau nhập khẩu hoặc gửi đến cơ quan chức năng (khi có yêu cầu).
1.3.12. Mẫu tồn (contingency sample)
Là phần mẫu còn lại sau khi chia mẫu trung bình theo nguyên tắc đường chéo để có mẫu gửi, mẫu phân tích, mẫu lưu, được dự phòng cho những mục đích khác khi cần.
II. QUY ĐỊNH KỸ THUẬT
2.1. Trình tự chia mẫu trong kiểm dịch thực vật
2.2. Quy trình lưu giữ, bảo quản và vận chuyển mẫu là thực vật và sản phẩm thực vật trong kiểm dịch thực vật
2.2.1. Quy trình lưu giữ mẫu là thực vật và sản phẩm thực vật trong kiểm dịch thực vật
2.2.1.1. Thời gian lưu giữ
Đối với củ, quả tươi: Thời gian lưu giữ tối thiểu là 15 ngày.
Đối với rau tươi: Thời gian lưu giữ tối thiểu là 7 ngày.
Đối với hàng hóa là cây, cành, mắt ghép: Thời gian lưu giữ tối thiểu là 15 ngày.
Đối với hoa tươi: Thời gian lưu giữ tối thiểu là 7 ngày.
Hàng hóa là các loại hạt: Thời gian lưu giữ tối thiểu là 3 tháng.
Các sản phẩm thực vật đã qua chế biến: Thời gian lưu giữ tối thiểu là 3 tháng.
Các sản phẩm thực vật khác chưa qua chế biến: Thời gian lưu giữ tối thiểu là 3 tháng.
2.2.2.2. Theo dõi mẫu lưu
- Hàng hóa là rau, củ, quả tươi: Kiểm tra thành phần sinh vật gây hại định kỳ 7 ngày/lần đối với củ, quả tươi và 3 ngày/lần đối với rau tươi. Hết thời gian lưu thì tiến hành hủy mẫu.
- Hàng hóa là cây, cành, mắt ghép, hoa tươi: Kiểm tra thành phần sinh vật gây hại định kỳ 7 ngày/lần đối với cây, cành, mắt ghép và 3 ngày/lần đối với hoa tươi. Hết thời gian lưu thì tiến hành hủy mẫu.
- Hàng hóa là các loại hạt: Mỗi tháng tiến hành kiểm tra định kỳ các hộp lưu mẫu, thống kê thành phần sinh vật hại, tình trạng mẫu. Hết thời hạn lưu, tiến hành hủy mẫu.
- Các sản phẩm thực vật đã qua chế biến: Mỗi tháng tiến hành kiểm tra định kỳ các hộp lưu mẫu, thống kê thành phần sinh vật gây hại, tình trạng mẫu. Hết thời hạn lưu tiến hành hủy mẫu.
- Các sản phẩm thực vật khác chưa qua chế biến: Mỗi tháng tiến hành kiểm tra định kỳ các hộp lưu mẫu, thống kê thành phần sinh vật hại, tình trạng mẫu. Hết thời hạn lưu, tiến hành hủy mẫu.
- Sổ lưu mẫu như quy định của Thông tư 14TT/2012/TT-BNNPTNT2 ngày 27 tháng 3 năm 2012 của Bộ Nông nghiệp và PTNT về sổ giám định và lưu mẫu hàng xuất khẩu, nhập khẩu.
2.2.2. Quy trình bảo quản mẫu là thực vật và sản phẩm thực vật trong kiểm dịch thực vật
2.2.2.1. Hàng hóa là rau, củ, quả tươi
Mẫu được bảo quản trong các túi ni-lông có lỗ thông khí (dùng kim côn trùng số 2 châm vào 1/3 phía trên của túi ni-lông khoảng 5 lỗ/cm2) và phải bảo quản trong tủ lạnh hoặc tủ bảo quản rau quả chuyên dùng. Mỗi túi phải đính kèm nhãn ký hiệu của mẫu.
2.2.2.2. Hàng hóa là cây, cành, mắt ghép, hoa tươi
- Đối với mẫu không có giá thể (cành mắt ghép, chồi, hom, hoa tươi), mẫu được giữ ẩm bằng bông hoặc giấy thấm nước, sau đó đặt trong các túi ni-lông có lỗ thông khí (dùng kim côn trùng số 2 châm vào 1/3 phía trên của túi ni-lông khoảng 5 lỗ/cm2) và để ở điều kiện nhiệt độ phòng. Mỗi túi phải đính kèm nhãn ký hiệu của mẫu.
- Đối với mẫu là cây có kèm các giá thể thì cho toàn bộ cây và giá thể vào trong túi ni-lông có lỗ thông khí và bảo quản ở điều kiện nhiệt độ và ánh sáng trong phòng. Mỗi túi phải đính nhãn ghi ký hiệu mẫu.
2.2.2.3. Hàng hóa là các loại hạt
Mẫu được đặt trong các hộp nhựa có nắp lưới (1cm2 có từ 630-700 mắt lưới). Thành phía trong của hộp nhựa (1/3 khoảng cách tính từ trên nắp xuống) được bôi/phủ một lớp hóa chất ngăn côn trùng bò lên nắp (Fluon hoặc bột đá). Các lọ có dán nhãn ký hiệu mẫu và đặt trong các tủ đựng mẫu lưu (phụ lục 1).
2.2.2.4. Các sản phẩm thực vật đã qua chế biến
Quy trình bảo quản tương tự mục 2.2.2.3.
2.2.2.5. Các sản phẩm thực vật khác chưa qua chế biến
Quy trình bảo quản tương tự mục 2.2.2.3.
2.2.2.6. Nội dung nhãn của mẫu lưu và trang thiết bị, dụng cụ của phòng lưu mẫu (phụ lục 1)
2.2.3. Quy trình vận chuyển mẫu là thực vật và sản phẩm thực vật trong kiểm dịch thực vật
2.2.3.1. Phương thức vận chuyển
Mẫu được vận chuyển từ địa điểm lấy mẫu về phòng thí nghiệm để giám định hoặc lưu hoặc gieo trồng trong thời gian sớm nhất có thể bằng bưu điện hoặc các phương tiện thích hợp tùy thuộc vào yêu cầu và điều kiện cụ thể.
2.2.3.2. Bảo quản mẫu trong vận chuyển
2.2.3.2.1. Hàng hóa là rau, củ, quả tươi
Khi vận chuyển, các mẫu được đặt riêng vào các túi ni-lông có lỗ thông khí (dùng kim côn trùng số 2 châm vào 1/3 phía trên của túi ni-lông khoảng 5 lỗ/cm2) có ghi rõ ký hiệu, sau đó đặt vào thùng carton để tránh dập nát. Để bảo quản tốt sản phẩm trong quá trình vận chuyển, nên đặt đá khô vào trong thùng carton (khi nhiệt độ bên ngoài cao trên 20oC).
2.2.3.2.2. Hàng hóa là cây, cành, mắt ghép, hoa tươi
Khi vận chuyển, các mẫu được đặt riêng vào các túi ni-lông có lỗ thông khí (đối với mẫu không có giá thể thì giữ ẩm bằng bông hoặc giấy thấm nước). Các túi cũng phải đính nhãn ghi ký hiệu mẫu. Các túi được đặt trong thùng cactông để tránh dập nát trong quá trình vận chuyển.
2.2.3.2.3. Hàng hóa là các loại hạt
Khi vận chuyển, các mẫu được đặt riêng trong các hộp nhựa nắp lưới thoáng (1cm2 có từ 630-700 mắt lưới). Thành phía trong của hộp nhựa được bôi/phủ một lớp hóa chất ngăn côn trùng bò lên nắp (Fluon hoặc bột đá). Các hộp có dán nhãn ký hiệu mẫu. Các hộp được đặt trong thùng cactông để tránh đổ, vỡ trong quá trình vận chuyển.
2.2.3.2.4. Các sản phẩm đã qua chế biến
Quy trình vận chuyển tương tự mục 2.2.3.2.3.
2.2.3.2.5. Các sản phẩm thực vật khác chưa qua chế biến
Quy trình vận chuyển tương tự mục 2.2.3.2.3.
2.2.3.2.6. Phiếu gửi mẫu: như quy định ở phụ lục 2.
2.3. Quy trình lưu giữ, bảo quản và vận chuyển mẫu là sinh vật gây hại trong kiểm dịch thực vật
2.3.1. Quy trình lưu giữ mẫu là sinh vật gây hại trong kiểm dịch thực vật
2.3.1.1. Côn trùng và nhện
- Hàng hóa có chứa côn trùng và nhện hại, quy trình lưu giữ tương tự mục 2.2.1.
- Côn trùng và nhện hại, thời gian lưu giữ tối thiểu là 3 tháng.
2.3.1.2. Vi sinh vật gây hại như nấm, vi khuẩn, virus, viroids và phytoplasma
- Hàng hóa có triệu chứng nghi là nấm, vi khuẩn, virus, viroids và phytoplasma, quy trình lưu giữ tương tự mục 2.2.1.
- Tiêu bản của nấm, vi khuẩn, thời gian lưu giữ tối thiểu là 3 tháng.
2.3.1.3. Tuyến trùng ký sinh thực vật
- Hàng hóa có triệu chứng nghi là tuyến trùng, quy trình lưu giữ tương tự mục 2.2.1.
- Tiêu bản của tuyến trùng, thời gian lưu giữ tối thiểu là 3 tháng.
2.3.1.4. Cỏ dại
- Hàng hóa có chứa cỏ dại, quy trình lưu giữ tương tự mục 2.2.1.
- Hạt cỏ dại và tiêu bản cây cỏ, thời gian lưu giữ tối thiểu là 3 tháng.
2.3.1.5. Các nhóm sinh vật gây hại khác
Các nhóm sinh vật gây hại khác, phải tiến hành lưu giữ cho đến khi có kết quả giám định.
2.3.2. Quy trình bảo quản mẫu là sinh vật gây hại trong kiểm dịch thực vật
2.3.2.1. Côn trùng và nhện
- Hàng hóa có chứa côn trùng và nhện hại, quy trình bảo quản tương tự mục 2.2.2.
- Côn trùng và nhện:
Các cá thể côn trùng trưởng thành được làm chết trong lọ độc (KCN), tiếp theo sấy ở 45 - 50oC trong 3-4 ngày. Sau đó cho vào lọ nút mài kín và để ở nhiệt độ phòng. Các lọ đều được dán nhãn đầy đủ.
Các cá thể sâu non, rệp, bọ trĩ và nhện được cho vào các lọ nút mài kín có chứa dung dịch cồn 70% hoặc dung dịch ngâm sâu non (Chloroform - formalin 10%). Các lọ đều được dán nhãn đầy đủ.
Các tiêu bản lam phải có nhãn ký hiệu mẫu, để trong hộp chuyên dụng đựng tiêu bản lam và được bảo quản ở nhiệt độ phòng.
2.3.2.2. Các vi sinh vật gây hại như nấm, vi khuẩn, virus, viroids và phytoplasma
- Các bộ phận tươi có triệu chứng bệnh (cành, lá, thân, rễ, củ...), mẫu được để trong các túi ni-lông có lỗ thông khí có đính nhãn và bảo quản trong tủ lạnh ở nhiệt độ 3 - 5oC.
- Các sản phẩm khô có triệu chứng bệnh (hạt, quả khô,...), mẫu được để trong các túi ni-lông hoặc hộp nhựa kín có nhãn và bảo quản ở nhiệt độ phòng.
- Mẫu đất được cho vào túi ni-lông, có lỗ thông khí, có đính nhãn và để ở những nơi thoáng mát hoặc ở nhiệt độ phòng.
- Các tiêu bản lam của nấm được dán nhãn, để trong hộp chuyên dụng đựng tiêu bản lam và bảo quản ở nhiệt độ phòng.
2.3.2.3. Tuyến trùng ký sinh thực vật
- Các bộ phận tươi có triệu chứng nghi là tuyến trùng (cành, lá, thân, rễ, củ...) được để trong các túi ni-lông có lỗ thông khí có đính nhãn vả bảo quản trong tủ lạnh ở nhiệt độ khoảng 5oC.
- Các sản phẩm khô có triệu chứng nghi là tuyến trùng (hạt, quả khô,...) được để trong các túi ni-lông hoặc hộp nhựa kín có dán nhãn và bảo quản ở nhiệt độ phòng.
- Mẫu đất được cho vào túi ni-lông, có lỗ thông khí, có đính nhãn và để ở những nơi thoáng mát hoặc ở nhiệt độ phòng.
- Dung dịch có tuyến trùng được tách ra từ bộ phận bị hại để trong các lọ kín có dán nhãn và bảo quản trong tủ lạnh ở nhiệt độ 5oC -10oC.
Tiêu bản:
Tiêu bản lam phải có nhãn ký hiệu mẫu, để trong hộp chuyên dụng đựng tiêu bản lam và được bảo quản ở nhiệt độ phòng.
Tuyến trùng được tách ra từ mẫu hàng hóa được xử lý nhiệt bằng nước nóng ở nhiệt độ 60 - 80oC trong 1 - 2 phút, sau đó cho vào lọ có nút kín chứa một trong ba loại dung dịch dưới đây và bảo quản ở điều kiện nhiệt độ phòng. Các lọ có nhãn đầy đủ.
|
Dung dịch 1: |
Formalin Dung dịch Formaldehyde 4%. |
|
|
Dung dịch 2: |
Formalin - glycerol (FG) Formalin (40% formaldehyde): 10ml Glycerol: Nước cất: |
01ml 89ml |
|
Dung dịch 3: |
TAF Triethanolamine: Formalin (40% formaldehyde): Nước cất: |
02ml 07ml 91ml |
2.3.2.4. Cỏ dại
- Hàng hóa có lẫn cỏ dại, phương pháp bảo quản như quy định ở mục 2.2.2.
- Hạt cỏ sàng tách ra từ hàng hóa được phơi khô tự nhiên hoặc sấy ở 50oC cho đến khi độ ẩm đạt 13%, sau đó cho vào các lọ kín, có dán nhãn và bảo quản ở nhiệt độ phòng.
- Cây cỏ tươi: Tiến hành làm tiêu bản ép khô và bảo quản ở điều kiện nhiệt độ phòng.
2.3.2.5. Nhóm sinh vật gây hại khác
Các cá thể còn sống của nhóm sinh vật gây hại khác được bảo quản trong các dụng cụ bảo quản mẫu phù hợp với từng loài ở điều kiện nhiệt độ phòng. Các dụng cụ bảo quản mẫu phải có nhãn đầy đủ.
2.3.2.6. Nội dung nhãn của mẫu lưu (phụ lục 1).
2.3.3. Quy trình vận chuyển mẫu là sinh vật gây hại trong kiểm dịch thực vật
2.3.3.1. Phương thức vận chuyển
Mẫu được vận chuyển từ địa điểm lấy mẫu về phòng thí nghiệm để giám định hoặc lưu hoặc gieo trồng trong thời gian sớm nhất có thể bằng bưu điện hoặc các phương tiện thích hợp tùy thuộc vào yêu cầu và điều kiện cụ thể.
2.3.3.2. Bảo quản mẫu trong vận chuyển
2.3.3.2.1. Côn trùng và nhện
- Hàng hóa có chứa côn trùng và nhện gây hại, quy trình vận chuyển tương tự mục 2.2.3.
- Côn trùng trưởng thành chết được cho vào các lọ nhỏ hoặc ống nghiệm nắp kín, có nhãn và đóng gói cẩn thận, tránh vỡ khi vận chuyển.
- Dung dịch ngâm sâu non, rệp, bọ trĩ và nhện được cho vào các ống nghiệm nhỏ có nắp kín (chú ý là dung dịch trong ống nghiệm phải đầy), có dán nhãn và đóng gói cẩn thận, tránh vỡ khi vận chuyển.
- Các tiêu bản lam được đính nhãn và cho vào hộp chuyên dụng đựng tiêu bản lam, đóng gói cẩn thận, tránh vỡ hỏng trong quá trình vận chuyển.
2.3.3.2.2. Vi sinh vật gây hại như nấm, vi khuẩn, virus, viroids và phytoplasma
- Hàng hóa có triệu chứng nghi là nấm, vi khuẩn, virus, viroids và phytoplasma, quy trình vận chuyển tương tự mục 2.2.3.
- Các tiêu bản lam được đính nhãn và cho vào hộp chuyên dụng đựng tiêu bản lam, đóng gói cẩn thận, tránh vỡ hỏng trong quá trình vận chuyển.
2.3.3.2.3. Tuyến trùng ký sinh thực vật
- Hàng hóa có triệu chứng nghi là tuyến trùng, quy trình vận chuyển tương tự mục 2.2.3.
- Để vận chuyển, các tiêu bản lam được cho vào hộp chuyên dụng đựng tiêu bản lam, dung dịch có tuyến trùng được đóng vào lọ kín có dán nhãn và đóng gói cẩn thận, tránh vỡ hỏng trong quá trình vận chuyển.
2.3.3.2.4. Cỏ dại
- Hàng hóa có lẫn cỏ dại, quy trình vận chuyển tương tự mục 2.2.3.
- Hạt cỏ dại được cho vào các lọ hoặc ống nghiệm có nắp kín, có ghi nhãn và đóng gói cẩn thận, tránh vỡ khi vận chuyển.
- Tiêu bản ép khô được đóng gói cẩn thận trong thùng cactông để tránh nát, hỏng trong quá trình vận chuyển. Các tiêu bản phải có nhãn đầy đủ.
- Cây cỏ tươi: Mẫu được giữ ẩm bằng bông hoặc giấy thấm nước, sau đó đặt trong các túi ni-lông có lỗ thông khí (dùng kim côn trùng số 2 châm vào 1/3 phía trên của túi khoảng 5 lỗ/1cm2). Các túi cũng phải đính nhãn ghi ký hiệu mẫu. Các túi được đặt trong thùng carton để tránh dập nát trong quá trình vận chuyển.
2.3.3.2.5. Nhóm sinh vật gây hại khác
- Các cá thể còn sống của nhóm sinh vật gây hại khác phải để trong các dụng cụ bảo quản phù hợp với từng loài trong khi vận chuyển để tránh làm chết hoặc bị thoát ra ngoài. Các dụng cụ phải có nhãn đầy đủ.
- Tiêu bản (khô hoặc ướt) của nhóm sinh vật gây hại khác phải được đóng gói cẩn thận trong thùng carton để tránh đổ vỡ, hỏng. Các tiêu bản phải có nhãn đầy đủ.
2.3.3.2. Phiếu gửi mẫu (phụ lục 2).
III. QUY ĐỊNH VỀ QUẢN LÝ
Tất cả các đơn vị thuộc hệ thống Bảo vệ và KDTV phải lưu giữ, quản lý và khai thác dữ liệu về kết quả thực hiện việc lưu giữ, bảo quản và vận chuyển mẫu trong công tác kiểm dịch thực vật ở Việt Nam.
IV. TỔ CHỨC THỰC HIỆN
Cục Bảo vệ thực vật có trách nhiệm phổ biến; tổ chức, hướng dẫn và kiểm tra việc thực hiện Quy chuẩn này trong hệ thống tổ chức chuyên ngành Bảo vệ và Kiểm dịch thực vật cũng như các tổ chức, cá nhân khác có liên quan;
Các tổ chức, cá nhân có hoạt động liên quan đến việc lưu giữ, bảo quản và vận chuyển mẫu trong công tác kiểm dịch thực vật ở Việt Nam phải tuân theo quy định của quy chuẩn này cũng như các quy định của pháp luật có liên quan hiện hành.
Phụ lục 1.
(quy định)
A.1. Nhãn dùng cho mẫu lưu và mẫu gửi
A.1.1. Nhãn dùng cho mẫu thực vật và sản phẩm thực vật
1. Tên thực vật/ sản phẩm thực vật
2. Ký hiệu mẫu
3. Ngày lấy mẫu
4. Ngày lưu mẫu
5. Người lấy mẫu
A.1.2. Nhãn dùng cho mẫu là sinh vật gây hại
1. Tên ký chủ/ hàng hóa
2. Ký hiệu mẫu
3. Ngày lấy mẫu
4. Ngày lưu mẫu
5. Người lấy mẫu
A.2. Thiết bị phòng lưu mẫu
1. Tủ đựng mẫu lưu: Tủ làm bằng khung nhôm hoặc sắt, cửa kính, hai vách bên là lưới để ngăn côn trùng.
2. Quạt thông gió
3. Bàn kiểm tra mẫu:
- Sàng với kích thước mắt sàng từ 0,025 - 3,35 mm.
- Lồng để bắt côn trùng (hình 1).
- Hệ thống đèn bàn.
- Khay men, bút lông, panh côn trùng, lọ độc, lúp cầm tay, cồn...
Hình 1: Lồng bắt côn trùng (khung nhôm kính)
1. Ô cho tay thao tác bắt côn trùng; 2. Cánh cửa đẩy; 3. Đáy (để hở)
Phụ lục 2.
(quy định)
Mẫu phiếu gửi mẫu
CỘNG HÒA XÃ
HỘI CHỦ NGHĨA VIỆT NAM
Độc lập - Tự do - Hạnh phúc
---------------
......, ngày…. tháng….. năm 20….
PHIẾU GỬI MẪU GIÁM ĐỊNH SÂU, BỆNH VÀ CỎ DẠI
1. Cơ quan/Đơn vị gửi mẫu:
2. Tên mẫu gửi:
3. Pha phát dục (côn trùng), bộ phận của cây (bệnh và cỏ dại)
4. Số lượng mẫu gửi:
5. Ký hiệu mẫu:
6. Loại hàng hóa xuất, nhập khẩu hoặc loại cây trồng bị hại:
7. Nước xuất/nhập hàng:
8. Cơ quan xuất, nhập khẩu hàng:
9. Phương tiện vận chuyển:
10. Cửa khẩu xuất, nhập:
11. Địa điểm gieo trồng:
12. Ngày lấy mẫu:
13. Người lấy mẫu:
14. Kết quả giám định bước đầu của cơ sở:
15. Yêu cầu của cơ quan/đơn vị gửi mẫu:
|
Vào sổ số: ngày tháng năm |
Thủ trưởng
cơ quan/đơn vị gửi mẫu |
|
Người nhận
mẫu |
|
National technical regulation on Procedure for identification of groundnut bruchid (Pachymerus pallidus Olivier) - Plant quarantine pest of Vietnam
Lời nói đầu
QCVN 01 - 176 : 2014/BNNPTNT do Trung tâm Giám định Kiểm dịch thực vật biên soạn, Cục Bảo vệ thực vật trình duyệt, Bộ Nông nghiệp & PTNT ban hành tại Thông tư số 16/TT-BNNPTNT ngày 05 tháng 6 năm 2014.
QUY CHUẨN KỸ THUẬT QUỐC GIA VỀ QUY TRÌNH GIÁM ĐỊNH MỌT LẠC (PACHYMERUS PALLIDUS OLIVIER) LÀ DỊCH HẠI KIỂM DỊCH THỰC VẬT CỦA VIỆT NAM
National technical regulation on Procedure for identification of groundnut bruchid (Pachymerus pallidus Olivier) - Plant quarantine pest of Vietnam
I. QUY ĐỊNH CHUNG
1.1. Phạm vi điều chỉnh
Quy chuẩn này áp dụng thống nhất trên phạm vi toàn quốc cho việc giám định mọt lạc (Pachymerus pallidus Olivier) là dịch hại kiểm dịch thực vật của Việt Nam.
1.2. Đối tượng áp dụng
Quy chuẩn này áp dụng đối với mọi tổ chức, cá nhân Việt Nam hoặc nước ngoài có hoạt động liên quan đến lĩnh vực bảo vệ và kiểm dịch thực vật tại Việt Nam (viết tắt là KDTV) thực hiện giám định mọt lạc (Pachymerus pallidus Olivier) là dịch hại KDTV nhóm l thuộc Danh mục dịch hại KDTV của Việt Nam ban hành kèm theo Quyết định số 73/2005/QĐ-BNN ngày 14/11/2005 của Bộ trưởng Bộ Nông nghiệp và Phát triển nông thôn.
1.3. Giải thích từ ngữ
Những thuật ngữ trong quy chuẩn này được hiểu như sau:
1.3.1. Dịch hại kiểm dịch thực vật (plant quarantine pest)
Là loài sinh vật hại có nguy cơ gây hại nghiêm trọng tài nguyên thực vật trong một vùng mà ở đó loài sinh vật này chưa xuất hiện hoặc xuất hiện có phân bố hẹp và phải được kiểm soát chính thức.
1.3.2. Côn trùng (insect)
Là động vật không xương sống thuộc ngành chân đốt, cơ thể pha trưởng thành gồm 3 phần: đầu, ngực và bụng. Ngực mang 3 đôi chân.
1.3.3. Mọt (weevil)
Là nhóm côn trùng cánh cứng gây hại chủ yếu trên các sản phẩm bảo quản sau thu hoạch.
1.3.4. Mẫu (sample)
Là khối lượng thực vật, sản phẩm thực vật, tàn dư của sản phẩm thực vật hoặc đất được lấy ra theo một qui tắc nhất định.
1.3.5. Tiêu bản (specimen)
Là mẫu vật điển hình tiêu biểu của dịch hại được xử lý để dùng cho việc định loại, nghiên cứu, giảng dạy, phổ biến kỹ thuật và trưng bày thành các bộ sưu tập.
II. QUY ĐỊNH KỸ THUẬT
2.1. Phương pháp thu thập và bảo quản mẫu
2.1.1. Thu thập mẫu
Đối với hàng hóa xuất, nhập khẩu, quá cảnh hoặc vận chuyển, bảo quản trong nước: Tiến hành lấy mẫu theo tiêu chuẩn Việt Nam TCVN 4731:891 "Kiểm dịch thực vật - phương pháp lấy mẫu", quy chuẩn kỹ thuật quốc gia QCVN 01-23:2010/BNNPTNT1 "Phương pháp kiểm tra các loại hạt xuất nhập khẩu và quá cảnh".
2.1.2. Bảo quản mẫu giám định
Các cá thể côn trùng trưởng thành được làm chết trong lọ độc (KCN), tiếp theo sấy ở 45 - 50oC trong 3 - 4 ngày. Sau đó cho vào lọ nút mài kín và để ở nhiệt độ phòng. Các lọ đều được dán nhãn đầy đủ.
2.2. Dụng cụ, hóa chất phục vụ làm tiêu bản và giám định
- Kính lúp soi nổi, kính hiển vi.
- Kim côn trùng, kim mũi mác.
- Đĩa petri, lọ nút mài, giấy lọc, panh, bút lông.
- Lọ độc (KCN).
- Hồ dán tiêu bản (60 g gum arabic + 30 g đường + 2 ml carbolic acid + 8 ml cồn 95% + 45 ml nước cất)
2.3. Phương pháp làm tiêu bản mẫu giám định
Tiêu bản giám định được thực hiện với trưởng thành mọt lạc theo phương pháp sau:
- Chuyển mẫu đã sấy từ lọ bảo quản vào đĩa petri và để qua đêm cho mẫu mềm.
- Cắm kim côn trùng số 3 vào gần cạnh đáy của mảnh bìa cứng cắt nhọn (kích thước 11 x 3,5mm), dùng panh gập đỉnh của mảnh bìa (khoảng 1 - 2 mm) vuông góc và hướng xuống dưới. Phết hồ dán tiêu bản vào phần đã gập.
- Đặt ngửa trưởng thành trên lam, đầu hướng về bên trái của người làm tiêu bản, dính phần hồ dán của mảnh bìa nhọn vào mặt bên phần ngực giữa của côn trùng (đầu nhọn của kim côn trùng hướng lên phía trên) (phụ lục 1).
- Tiêu bản được cắm vào miếng xốp mỏng để phục vụ việc quan sát và giám định.
2.4. Trình tự giám định
Quan sát mẫu tiêu bản trên kính lúp soi nổi lần lượt các đặc điểm sau:
- Hình dạng và màu sắc râu đầu, số đốt râu.
- Kích thước cơ thể
- Hình dạng mảnh lưng ngực
- Hoa văn trên cánh cứng
- Đốt đùi chân sau, số lượng gai
- Hình dạng đốt chày chân sau
2.5. Đối chiếu kết quả quan sát với đặc điểm hình thái của mọt lạc (Pachymerus pallidus Olivier) (phụ lục 2).
Thông thường, số lượng cá thể nghiên cứu phải đảm bảo là 30 (n=30). Trong trường hợp số lượng cá thể ít hơn hoặc chỉ phát hiện duy nhất một cá thể trưởng thành có các đặc điểm nhận dạng như trên có thể cho phép kết luận là loài (Pachymerus pallidus Olivier) [chỉ áp dụng đối với các đơn vị đã từng giám định được (Pachymerus pallidus Olivier).
2.6. Thẩm định kết quả giám định và báo cáo
Sau khi khẳng định kết quả giám định là mọt lạc (Pachymerus pallidus Olivier) thuộc danh mục dịch hại KDTV nhóm I của Việt Nam, đơn vị giám định phải gửi báo cáo về Cục Bảo vệ thực vật kèm theo phiếu kết quả giám định (phụ lục 2).
Tất cả các đơn vị thuộc hệ thống Bảo vệ và KDTV phải lưu giữ, quản lý và khai thác dữ liệu về kết quả điều tra, báo cáo và giám định mọt lạc.
Đối với đơn vị lần đầu tiên giám định và phát hiện được mọt lạc phải gửi mẫu hoặc tiêu bản về Trung tâm Giám định kiểm dịch thực vật để thẩm định và báo cáo Cục Bảo vệ thực vật trước khi công bố và xử lý dịch theo quy định của pháp luật hiện hành.
Đơn vị giám định phải lưu mẫu theo Quy chuẩn kỹ thuật hiện hành về thời gian để giải quyết khiếu nại về kết quả giám định (nếu có).
III. TỔ CHỨC THỰC HIỆN
Cục Bảo vệ thực vật có trách nhiệm phổ biến; tổ chức, hướng dẫn và kiểm tra việc thực hiện Quy chuẩn này trong hệ thống tổ chức chuyên ngành Bảo vệ và Kiểm dịch thực vật cũng như các tổ chức, cá nhân khác có liên quan.
Các tổ chức, cá nhân có hoạt động liên quan đến điều tra, thu thập mẫu, xử lý và bảo quản mẫu mọt lạc tại Việt Nam phải tuân theo quy định của quy chuẩn này cũng như các quy định của pháp luật có liên quan hiện hành.
Phụ lục 1.
Phương pháp làm tiêu bản giám định
|
Hình 1. Vị trí cắm kim vào mảnh bìa nhọn và dán vào côn trùng (Nguồn: Walker A.K. and Crosby T.K, 1988) |
Hình 2. Tiêu bản mẫu giám định (Nguồn: Walker A.K. and Crosby T.K, 1988) |
Phụ lục 2.
Thông tin về dịch hại
1. Phân bố và ký chủ
Châu Âu: Greece, Yugoslavia (cũ), Franch.
Châu Á: Israel, India, Indonesia, Jordan, Siria, Turkey, Sri Lanca
Châu Phi: Ghana, Guinea, Egypt, Zaire, Cameroon, Kenya, Lebanon, Senegal, Somalia, Tunisia, Burkina Faso, Côte d'Ivoire, Gambia, Nigeria, Niger, Sudan, Tanzania, Uganda.
Tây Bán cầu: Uganda, Haiti, Jamaica, Mexico, USA, Venezuela
Ký chủ: Lạc, đậu
2. Tên khoa học và vị trí phân loại
|
- Tên khoa học Tên tiếng Việt Tên khác |
: Pachymerus pallidus Olivier : Mọt lạc : Bruchus pallidus Ol., Caryedon gonagra Ol., Caryedon pallidus Ol., Caryeborus pallidus Ol., Pachymerus acaciae Gyll., Caryeborus germani Kust. |
- Vị trí phân loại:
|
Ngành Lớp Bộ Họ Giống |
: Arthropoda : Insecta : Coleoptera : Bruchidae : Pachymerus |
3. Đặc điểm chung
3.1. Họ Bruchidae
- Trưởng thành họ Bruchidae cơ thể hình bầu dục, toàn thân phủ đầy lông ngắn. Tấm lưng ngực hình chuông, bờ trước tròn. Mắt nhô rõ ra khỏi đầu về phía trước, Đầu nhỏ, kiểu miệng dưới. Râu đầu có hai dạng: dạng hình răng cưa và dạng hình răng lược. Cánh cứng không che hết bụng, để lộ đốt bụng cuối. Đùi chân sau, đốt chày thường có gai.
- Sâu non không chân, cong dạng chữ C
- Nhộng dạng nhộng trần
- Trứng thường được đẻ bên ngoài hạt
3.2. Họ phụ Pachymerinae
- Râu đầu 10 - 12 đốt
- Đốt đùi chân sau phát triển, bờ trong có từ 8 - 12 gai cứng
- Đốt chày chân sau cong hình chữ C
3.3. Giống Pachymerus
- Kích thước trưởng thành từ 3,5 - 7,5mm, hình trụ
- Râu đầu 10 - 12, đốt có màu không đồng nhất
- Đốt đùi chân sau phát triển bờ trong đốt đùi chân sau có từ 8 -12 gai cứng
- Đốt chày chân sau cong hình chữ C
4. Đặc điểm nhận dạng mọt lạc Pachymerus pallidus Olivier - dịch hại kiểm dịch thực vật nhóm I của Việt Nam
Trưởng thành: Hình oval, dài 4,5 - 5mm, màu nâu đỏ hoặc vàng đỏ, toàn thân phủ đầy lông màu vàng xám, mắt to lồi, màu đen, mắt con đực to hơn mắt con cái.
Râu đầu 11 đốt, từ đốt 2 đến đốt 4 về
phía gốc và đốt ngoài cùng có màu nâu nhạt, các đốt còn lại có màu nâu đậm. Râu
đầu con đực nhỏ kéo dài, ở con cái ngắn hơn ![]() chiều
dài thân.
chiều
dài thân.
Mảnh lưng ngực hình chuông, chiều rộng lớn hơn chiều dài, mặt trên có nhiều chấm lõm tròn. Mép trước thu hẹp hình cánh cung, góc sau gần vuông.
Cánh cứng hình oval dài, phía sau hơi thu hẹp lại, phủ lông mịn màu nhạt, góc ngoài cánh cứng nổi lên.Trên đường rãnh thứ 2 và 3 có đốm lông màu đen nhưng chạy đứt quãng, ở 1/3 phần gốc cánh cứng có những đốm lông màu nâu nhạt hơn làm thành hoa văn, đôi khi còn có những đốm lông nhỏ màu đen. Cánh cứng không che hết bụng, để lộ đốt bụng cuối, mặt trên đốt bụng cuối phủ lông tơ màu vàng nhạt.
Chân trước nhỏ, đốt đùi chân sau to mập, bờ trong đốt đùi chân sau có hàng gai cứng nhọn xếp dạng răng cưa (9 gai cứng) màu đen, gai đầu tiên dài nhất các gai sau ngắn dần, đốt chày chân sau rất cong. Bàn chân nhỏ.
Đốt hậu môn của con cái bằng phẳng hơi nghiêng về phía sau.
|
|
|
|
|
Hình 3. Mảnh lưng ngực |
Hình 4. Chân sau |
Hình 5. Trưởng thành |
(Nguồn: Đối tượng KDTV của Liên Xô, 1995)
Phụ lục 3.
(quy định)
Mẫu phiếu kết quả giám định
|
Cơ quan Bảo vệ |
CỘNG HÒA XÃ
HỘI CHỦ NGHĨA VIỆT NAM |
|
|
……….. ngày …. tháng …. năm 20….. |
PHIẾU KẾT QUẢ GIÁM ĐỊNH
Mọt lạc (Pachymerus pallidus Olivier) là dịch hại kiểm dịch thực vật của Việt Nam
|
1. Tên hàng hóa |
: |
|
|
2. Nước xuất khẩu |
: |
|
|
3. Xuất xứ |
: |
|
|
4. Phương tiện vận chuyển |
: |
Khối lượng: |
|
5. Địa điểm lấy mẫu |
: |
|
|
6. Ngày lấy mẫu |
: |
|
|
7. Người lấy mẫu |
: |
|
|
8. Tình trạng mẫu |
: |
|
|
9. Ký hiệu mẫu |
: |
|
|
10. Số mẫu lưu |
: |
|
|
11. Người giám định |
: |
|
12. Phương pháp giám định: Theo quy chuẩn kỹ thuật quốc gia QCVN 01 - 176 : 2014/BNNPTNT về "Quy trình giám định mọt lạc (Pachymerus pallidus Olivier) là dịch hại kiểm dịch thực vật của Việt Nam".
|
13. Kết quả giám định Tên khoa học Họ Bộ |
: : : Bruchidae : Coleoptera |
Là dịch hại kiểm dịch thực vật nhóm I thuộc danh mục dịch hại kiểm dịch thực vật của Việt Nam.
|
TRƯỞNG PHÒNG KỸ
THUẬT |
THỦ TRƯỞNG ĐƠN VỊ |
QUY CHUẨN KỸ THUẬT QUỐC GIA VỀ PHƯƠNG PHÁP ĐIỀU TRA PHÁT HIỆN SINH VẬT CHÍNH GÂY HẠI CÂY NHÃN, VẢI
National technical Regulation on Surveillance method of Longan, Lychee pests
Lời nói đầu
QCVN 01 - 177 : 2014/BNNPTNT do Phòng Quản lý sinh vật gây hại rừng biên soạn, Bảo vệ thực vật trình duyệt, Bộ Nông nghiệp & PTNT ban hành tại Thông tư số 16/TT-BNNPTNT ngày 05 tháng 6 năm 2014.
QUY CHUẨN KỸ THUẬT QUỐC GIA VỀ PHƯƠNG PHÁP ĐIỀU TRA PHÁT HIỆN SINH VẬT CHÍNH GÂY HẠI CÂY NHÃN, VẢI
National technical Regulation on Surveillance method of Longan, Lychee pests
I. QUY ĐỊNH CHUNG
1.1. Phạm vi điều chỉnh
Quy chuẩn này quy định những nguyên tắc, nội dung, phương pháp, chỉ tiêu theo dõi chủ yếu trong điều tra phát hiện sinh vật chính hại nhãn, vải; danh mục các sinh vật chính (phụ lục 1).
1.2. Đối tượng áp dụng
Quy chuẩn này bắt buộc áp dụng trong hệ thống tổ chức chuyên ngành Bảo vệ và Kiểm dịch thực vật; các tổ chức, cá nhân hoạt động liên quan đến điều tra phát hiện sinh vật hại nhãn, vải trên lãnh thổ Việt Nam.
1.3. Giải thích từ ngữ
Trong quy chuẩn này các từ ngữ dưới đây được hiểu như sau:
1.3.1. Sinh vật hại (SVH)
Là những sinh vật hoạt động làm giảm số lượng, khối lượng, chất lượng cây trồng nông sản.
1.3.2. Sinh vật hại chính
Là những sinh vật thường xuyên xuất hiện phổ biến và hại nặng hàng năm ở địa phương.
1.3.3. Sinh vật hại chủ yếu
Là những sinh vật hại chính, mà tại thời điểm điều tra có mức độ gây hại cao hoặc có khả năng lây lan nhanh, phân bố rộng trong điều kiện ngoại cảnh thuận lợi.
1.3.4. Yếu tố điều tra chính
Là các yếu tố đại diện bao gồm giống, tuổi cây, địa hình.
1.3.5. Khu vực điều tra
Là vườn nhãn, vải đại diện cho các yếu tố điều tra được chọn cố định để điều tra ngay từ đầu vụ.
1.3.6. Tuyến điều tra
Là tuyến được xác định theo một lịch trình ở khu vực điều tra nhằm thỏa mãn các yếu tố điều tra chính của địa phương.
1.3.7. Điểm điều tra
Là điểm được bố trí ngẫu nhiên trong từng yếu tố điều tra.
1.3.8. Mẫu điều tra
Là số lượng cây hoặc các bộ phận của cây (lá, thân, cành, hoa, quả,...) trên đơn vị điều tra.
1.3.9. Mật độ sinh vật hại
Là số lượng cá thể sinh vật hại trên một đơn vị diện tích hoặc một đơn vị đối tượng khảo sát.
1.3.10. Tỷ lệ bệnh hoặc tỷ lệ hại
Là số lượng cá thể bị hại tính theo phần trăm (%) so với tổng số các cá thể điều tra trong quần thể.
1.3.11. Chỉ số bệnh hoặc chỉ số hại
Là đại lượng đặc trưng cho mức độ hại của từng loại sinh vật hại được biểu thị bằng phần trăm (%) và tính theo phân cấp được quy định (phụ lục 2).
1.3.12. Sinh vật có ích (thiên địch)
Là kẻ thù tự nhiên của các loài sinh vật hại.
1.3.13. Điều tra định kỳ
Là hoạt động điều tra thường xuyên của cán bộ bảo vệ thực vật theo một thời gian định trước trên tuyến điều tra thuộc khu vực điều tra nhằm nắm được diễn biến của SVH cây trồng và thiên địch.
1.3.14. Điều tra bổ sung
Là mở rộng điều tra vào các thời kỳ xung yếu của cây trồng và SVH đặc thù của các vùng sinh thái, nhằm xác định chính xác thời gian phát sinh, diện phân bổ và mức độ gây hại của SVH chủ yếu của địa phương đó.
1.3.15. Diện tích nhiễm sinh vật hạt
Là diện tích có mật độ, tỷ lệ hại từ 50% trở lên theo mức quy định của quy chuẩn này về mật độ, tỷ lệ hại để thống kê diện tích.
1.3.16. Cành điều tra
Là đoạn cành có chiều dài 30 cm tính từ đầu lá, đầu hoa, đầu quả.
1.3.17. Hình chiếu tán cây
Là hình chiếu của tán lá chiếu vuông góc xuống mặt đất.
II. QUY ĐỊNH KỸ THUẬT
2.1. Yêu cầu kỹ thuật
2.1.1. Điều tra
- Điều tra đầy đủ chính xác diễn biến các loại sinh vật hại, sinh vật có ích chính và các yếu tố ngoại cảnh tác động đến chúng.
2.1.2. Nhận định tình hình
- Đánh giá tình hình sinh vật hiện tại, nhận định khả năng phát sinh, phát triển và gây hại của sinh vật hại chính trong thời gian tới, so sánh với kỳ điều tra liền kề trước và cùng kỳ năm trước.
- Dự báo những loại sinh vật thứ yếu có khả năng phát triển thành đối tượng chính, phân tích nguyên nhân của hiện tượng đó.
2.1.3. Thống kê diện tích
Tổng hợp tính toán diện tích bị nhiễm sinh vật hại, (nhẹ, trung bình, nặng) diện tích mất trắng và diện tích đã được xử lý bằng các biện pháp phòng chống.
2.2. Thiết bị và dụng cụ điều tra
2.2.1. Dụng cụ điều tra ngoài vườn nhãn, vải
- Vợt côn trùng (phụ lục 3).
- Thước dây, thước gỗ điều tra, kính lúp cầm tay, thang chữ A, ống nhòm, băng giấy dính, băng dính, dao, kéo;
- Sổ ghi chép, bút viết, máy tính bỏ túi, túi nilon các cỡ, túi xách tay điều tra;
- Ống tuýp, hộp petri và hóa chất cần thiết;
- Bẫy đèn, bẫy bả, kính đeo mắt.
2.2.2. Thiết bị trong phòng thí nghiệm
- Kính lúp hai mắt soi nổi, kính hiển vi, lam, lamen;
- Tủ lạnh, tủ định ôn, máy ôn, ẩm kế tự ghi;
- Máy tính với phần mềm có liên quan;
- Máy khuấy, máy lắc, máy rây.
2.2.3. Trang bị bảo hộ lao động
- Mũ, ủng, áo mưa, găng tay, khẩu trang.
2.3. Phương pháp điều tra
2.3.1. Thời gian điều tra
- Điều tra định kỳ: 7 ngày một lần theo tuyến điều tra trong khu vực điều tra cố định ngay từ đầu vụ vào các ngày thứ 2, thứ 3 hàng tuần.
- Điều tra bổ sung: Tiến hành trước và trong cao điểm xuất hiện gây hại của từng loại sinh vật gây hại cây nhãn, vải.
2.3.2. Yếu tố điều tra
Chọn đại diện theo giống, tuổi cây, địa hình.
2.3.3. Khu vực điều tra
- Chọn khu vực điều tra có diện tích từ 5 ha trở lên đại diện cho các yếu tố điều tra.
2.3.4. Điểm điều tra
Mỗi yếu tố điều tra 10 điểm ngẫu nhiên hoặc nằm ngẫu nhiên trên đường chéo của khu vực điều tra. Điểm điều tra phải cách đường biên ít nhất 1 hàng cây.
2.3.5. Số mẫu điều tra của một điểm và cách điều tra.
2.3.5.1. Sinh vật hại cành (cành lá, cành hoa, cành quả)
Điều tra 4 hướng ở tầng giữa, mỗi hướng 2 cành (lá, hoa, quả)/1 cây/điểm.
* Sâu đục cuống quả: Điều tra số quả bị hại, tính tỷ lệ % quả bị hại.
Riêng điều tra mật độ trưởng thành, chọn cành cấp 1, đoạn cành điều tra tính từ thân ra 100 cm, tính mật độ con trưởng thành/cành.
* Bọ xít: Điều tra mật độ trưởng thành và bọ xít non trên cành, tính mật độ con trưởng thành (non)/ cành.
* Sâu đo: Điều tra mật độ sâu trên cành, tính mật độ con/cành.
* Xén tóc: Điều tra số cành bị hại, tính tỷ lệ % cành bị hại.
* Ve sầu bướm nâu: Điều tra mật độ trưởng thành và sâu non trên cành, tính mật độ con trưởng thành và sâu non/cành.
* Sâu đục gân lá: Điều tra số lá (kép) bị hại, tính tỷ lệ (%) lá bị hại.
* Sâu cuốn lá: Điều tra mật độ sâu trên cành, tính mật độ con/cành.
* Nhện lông nhung: Điều tra số cành lá, cành hoa bị hại, tính tỷ lệ (%) cành lá, cành hoa bị hại.
* Bướm chích hút quả: Điều tra số quả bị hại, tính tỷ lệ % quả bị hại.
* Bệnh chổi rồng: Đếm số chồi bị bệnh, tính tỷ lệ % số chồi bị bệnh.
* Bệnh sương mai: Điều tra số lá, cành hoa, số quả bị hại, tính tỷ lệ % số lá, cành hoa và quả bị hại.
* Bệnh thán thư: Điều tra số lá, cành hoa, số quả bị hại, tính tỷ lệ % cành lá, cành hoa, số quả bị hại.
* Bệnh biến màu quả: Điều tra số quả bị hại, tính tỷ lệ % quả bị hại.
2.3.5.2. Sinh vật hại thân: Điều tra 3 cây/điểm.
* Sâu tiện vỏ: Điều tra số cây bị hại, tính tỷ lệ % cây bị hại.
2.3.5.3. Sinh vật hại rễ
Mỗi điểm điều tra ngẫu nhiên 1 hố (kích thước theo phụ lục 3), là điểm giữa của bán kính hình chiếu tán.
2.3.6. Cách điều tra
2.3.6.1. Ngoài vườn nhãn, vải
- Quan sát từ xa đến gần, sau đó điều tra trực tiếp trên cây. Dùng vợt để thu bắt các loại côn trùng gây hại có hoạt động bay, nhảy trên bề mặt tán cây và sinh vật có ích hoạt động bay, nhảy trên mặt tán cây nhãn, vải.
Theo dõi mật độ, tỷ lệ hại, phân cấp hại và ghi nhận giai đoạn phát triển của sinh vật hại.
- Thu mẫu để theo dõi ký sinh: Trong quá trình điều tra phát hiện sinh vật hại cần xác định mật độ, tỷ lệ ký sinh của sinh vật có ích. Đối với các loại sinh vật có ích cần thu về phòng để theo dõi ở pha sâu non, nhộng, trưởng thành: 30 cá thể; pha trứng: 30 ổ trứng vả 50 quả trứng đối với trứng đơn.
- Đối với các loại sinh vật hại hoặc sinh vật có ích mới cần phải thu mẫu để theo dõi, giám định hoặc gửi đến cơ quan chuyên môn để giám định.
2.3.6.2. Trong phòng
Theo dõi phân tích những mẫu sinh vật hại đã thu được trong quá trình điều tra và xác định các loài sinh vật ký sinh, tỷ lệ ký sinh trên từng giai đoạn phát triển của sinh vật hại.
2.3.7. Các chỉ tiêu theo dõi, công thức tính
- Mật độ sinh vật hại (số lượng sinh vật hại/đơn vị mẫu điều tra)
|
Mật độ sinh vật hại |
= |
Tổng số sinh vật hại điều tra được |
|
|
Tổng số đơn vị mẫu điều tra |
|||
|
- Tỷ lệ phát dục (%) |
= |
Tổng số cá thể ở từng pha |
x 100 |
|
Tổng số cá thể điều tra |
|||
|
- Tỷ lệ hại (%) |
= |
Số đơn vị mẫu điều tra bị hại |
x 100 |
|
Tổng số đơn vị mẫu điều tra |
- Mật độ thiên địch (con/mẫu điều tra)
|
Mật độ thiên địch |
= |
Số thiên địch theo dõi được |
|
|
Tổng số mẫu điều tra |
|||
|
- Tỷ lệ ký sinh (%) |
= |
Số cá thể bị ký sinh ở từng pha |
x 100 |
|
Tổng số cá thể theo dõi ở từng pha |
|||
|
- Chỉ số hại (%) |
= |
å[(N1 x 1) + … + (Nn x n)] |
x 100 |
|
N x K |
Trong đó:
N1: là số mẫu điều tra bị hại ở cấp 1
Nn: là số mẫu điều tra bị hại ở cấp n
N: là tổng mẫu điều tra
K: là cấp hại cao nhất của thang phân cấp
- Diện tích nhiễm sinh vật hại (ha)
Căn cứ để tính diện tích nhiễm sinh vật hại (nhẹ, trung bình, nặng, mất trắng) bao gồm:
- Tổng diện tích và cơ cấu diện tích giống, tuổi cây, địa hình.
- Số liệu điều tra của từng yếu tố liên quan.
- Quy định mật độ, tỷ lệ để thống kê diện tích nhiễm.
+ Diện tích nhiễm nhẹ là diện tích có mật độ, tỷ lệ hại từ 50 đến 100% mức quy định.
+ Diện tích nhiễm trung bình là diện tích có mật độ, tỷ lệ hại trên 100 đến 200% mức quy định.
+ Diện tích nhiễm nặng là diện tích có mật độ, tỷ lệ hại trên 200% mức quy định.
+ Diện tích mất trắng: Là tổng số diện tích cộng dồn sinh vật hại làm giảm trên 70% năng suất (dùng để thống kê cuối các đợt dịch hoặc cuối mỗi vụ sản xuất).
+ Tổng số diện tích cây nhãn bị nhiễm sinh vật hại nào đó, là tổng diện tích nhiễm nặng, diện tích nhiễm trung bình, diện tích nhiễm nhẹ và diện tích bị mất trắng.
- Công thức tính diện tích bị nhiễm một loại sinh vật hại theo từng yếu tố điều tra:
|
X (ha) = |
N x b |
|
B |
Trong đó:
X: là diện tích bị nhiễm sinh vật hại của một yếu tố điều tra.
N: là tổng diện tích trồng cây nhãn của yếu tố điều tra trên vùng điều tra.
B: là tổng số điểm điều tra.
b: là số điểm điều tra bị nhiễm sinh vật hại của yếu tố điều tra.
- Diện tích bị nhiễm sinh vật hại ở từng mức (nhẹ, trung bình, nặng) được tính theo công thức sau:
|
Xi (ha) = |
N x Ci |
|
B |
Trong đó:
Xi: là diện tích bị nhiễm sinh vật hại ở mức i (nhẹ, trung bình, nặng) đối với yếu tố điều tra;
N: là tổng diện tích trồng cây nhãn, vải của yếu tố điều tra trên vùng điều tra;
B: là tổng số điểm điều tra
Ci: là số điểm điều tra bị nhiễm sinh vật hại ở cấp độ i (nhẹ, trung bình, nặng) đối với yếu tố điều tra;
2.3.8. Sổ theo dõi, ghi chép, báo cáo
- Sổ theo dõi dịch hại và thiên địch vào bẫy.
- Sổ ghi chép số liệu điều tra sinh vật hại và sinh vật có ích định kỳ, bổ sung.
- Sổ theo dõi diễn biến diện tích nhiễm sinh vật hại thường kỳ, hàng năm.
- Sổ theo dõi số liệu khí tượng.
- Các báo cáo thực hiện theo quy định chung của ngành Bảo vệ thực vật.
III. QUY ĐỊNH VỀ TỔ CHỨC THỰC HIỆN
- Cục Bảo vệ thực vật có trách nhiệm tổ chức triển khai việc phổ biến, hướng dẫn áp dụng Quy chuẩn kỹ thuật quốc gia này tới các tổ chức, cá nhân có hoạt động liên quan đến điều tra phát hiện sinh vật hại nhãn, vải trên lãnh thổ Việt Nam.
- Các tổ chức, cá nhân có hoạt động liên quan đến điều tra phát hiện dịch hại nhãn, vải trên lãnh thổ Việt Nam có trách nhiệm thực hiện đúng các quy định trong Quy chuẩn kỹ thuật.
Phụ lục 1.
Danh mục sinh vật hại, giai đoạn, vị trí cây bị hại và mật độ, tỷ lệ hại làm cơ sở thống kê diện tích nhiễm
|
TT |
Sinh vật hại |
Giai đoạn sinh trưởng |
Mật độ, tỷ lệ hại |
|
|
Tên Việt Nam |
Tên khoa học |
|||
|
1 |
Bọ xít nâu (vải) |
Tessaratoma papillosa Drury |
Các gđ sinh trưởng |
1 con trưởng thành/cành 5 con non/cành |
|
2 |
Sâu đục gân lá |
Conopomorpha litchiella Bradley |
Các gđ sinh trưởng |
25% lá |
|
3 |
Nhện lông nhung |
Eriophyes litchii Keifer |
Các gđ sinh trưởng |
25% cành hoa 25% cành lá |
|
4 |
Rệp |
Aspidiotus sp. |
Các gđ sinh trưởng |
25% cành |
|
5 |
Rầy chổng cánh vân nâu |
Corngenapsylla sinica Yang & Li |
Các gđ sinh trưởng |
25% cành |
|
6 |
Sâu hồng |
Zeuzera coffea Nietner |
cành |
25% cành |
|
7 |
Bọ Trĩ |
Scirtothrips dorsalis |
|
25% cành |
|
8 |
Sâu đục cuống quả |
Conopomorpha sinensis Bradley |
Quả |
1 con trưởng thành/cành 5% quả |
|
9 |
Ve sầu bướm nâu |
Ricania speculum |
Các gđ sinh trưởng |
2 con trưởng thành/cành 2 con non/cành |
|
10 |
Ngài chích hút quả |
Eudocima fullonia C. |
Quả |
5% số quả |
|
11 |
Ruồi đục quả |
Bactrocera dorsalis H |
Quả |
5% số quả |
|
12 |
Sâu đo củi |
Buzura suppessaria Guenee |
Cành hoa |
0,5 con/cành hoa; 2 con/cành quả, cành lá |
|
13 |
Sâu cuốn lá |
Statherotis discana Felder & Rogenhofer |
Các gđ sinh trưởng |
2 con/cành lá |
|
14 |
Sâu tiện vỏ |
Arbela dea Swinhoe |
Các gđ sinh trưởng |
35% cây |
|
15 |
Xén tóc |
Agriona germari Hope |
cành |
25% cành |
|
16 |
Bệnh sương mai |
Phytophthora sp. |
Cành hoa, quả non |
25% cành lá 25% cành hoa, quả |
|
17 |
Bệnh thán thư |
Gloeosporium sp. |
Cành lá, cành hoa, quả |
25% cành lá 25% cành hoa, số quả |
Phụ lục 2.
Phân cấp hại
Phân cấp hại được quy định thống nhất theo thang 9 cấp đối với từng loài dịch hại như sau:
- Những loài bệnh hại trên thân, cành, lá, hoa.
Cấp 1: từ 1 đến 10% diện tích lá, thân, cành, quả hoặc số hoa bị hại;
Cấp 3: từ >10% đến 20% diện tích lá, thân, cành, quả hoặc số hoa bị hại;
Cấp 5: từ >20% đến 30% diện tích lá, thân cành, quả hoặc số hoa bị hại;
Cấp 7: từ >30% đến 40% diện tích lá, thân, cành, quả hoặc số hoa bị hại;
Cấp 9: từ >40% diện tích lá, thân, cành, quả hoặc số hoa bị hại.
+ Đối với các loại dịch hại khác và các dịch hại do sinh vật chích hút có kích thước cơ thể nhỏ (rệp,...)
Cấp 1: nhẹ (Xuất hiện rải rác)
Cấp 2: trung bình (Phân bố dưới 1/3 diện tích lá,... bị hại)
Cấp 3: nặng (Phân bố trên 1/3 diện tích lá, ... bị hại)
+ Đối với các loài dịch hại gốc rễ:
|
Cấp hại |
Tỷ lệ bị hại |
|
Cấp 1 (nhẹ) |
≤ 1/3 số rễ bị hại |
|
Cấp 2 (trung bình) |
> 1/3 - <2/3 số rễ bị hại |
|
Cấp 3 (nặng) |
≥ 2/3 số rễ bị hại |
Phụ lục 3.
Một số dụng cụ điều tra ngoài thực địa
- Vợt, hố điều tra, bẫy đèn;
Hố điều tra
Vợt côn trùng
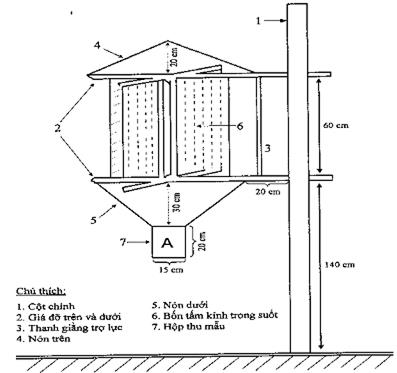
Mẫu lắp đặt bẫy đèn dùng bóng Neon (tốt nhất là bóng đèn 40W trở lên)
Ghi chú:
Đường kính nón trên 80 cm, cao 20 cm; đường kính nón dưới 60 cm, cao 30 cm; 4 tấm kính cao 62 cm, rộng 20 cm, dày 0,5 cm.
Hộp A, bên trong có một hộp nhỏ để đựng mẫu.
1. Vị trí lắp đui đèn; 2. Rãnh lắp kính sâu 1 cm, dài 20 cm
Mẫu bẫy đèn dùng bóng Neon dài 120 cm, tốt nhất là bóng đèn 40W trở lên
National technical regulation on bio-efficacy against gummy stem blight (Mycosphaerella melonis (Passerini) Chui & Walker) on watermelon of fungicides
Lời nói đầu
QCVN 01 - 178 : 2014/BNNPTNT do Trung tâm Kiểm định và Khảo nghiệm thuốc bảo vệ thực vật phía Bắc biên soạn, Cục Bảo vệ thực vật trình duyệt, Bộ Nông nghiệp & PTNT ban hành tại Thông tư số 16/TT-BNNPTNT ngày 05 tháng 6 năm 2014.
QUY CHUẨN KỸ THUẬT QUỐC GIA VỀ KHẢO NGHIỆM TRÊN ĐỒNG RUỘNG HIỆU LỰC PHÒNG TRỪ BỆNH NỨT THÂN CHẢY NHỰA (MYCOSPHAERELLA MELONIS (PASSERINI) CHUI & WALKER) HẠI CÂY DƯA HẤU CỦA CÁC THUỐC TRỪ BỆNH
National technical regulation on bio-efficacy against gummy stem blight (Mycosphaerella melonis (Passerini) Chui & Walker) on watermelon of fungicides
I. QUY ĐỊNH CHUNG
1.1. Phạm vi điều chỉnh
Quy chuẩn này quy định những nguyên tắc, nội dung và phương pháp để đánh giá hiệu lực phòng trừ bệnh nứt thân chảy nhựa (Mycosphaerella melonis (Passerini) Chui & Walker) hại cây dưa hấu của các thuốc trừ bệnh trên đồng ruộng.
1.2. Đối tượng áp dụng
Quy chuẩn này áp dụng cho các tổ chức, cá nhân thực hiện khảo nghiệm thuốc bảo vệ thực vật.
1.3. Giải thích từ ngữ
Những thuật ngữ trong quy chuẩn này được hiểu như sau:
1.3.1. Dịch hại
Là bất cứ loài, chủng hoặc biotype của tác nhân gây tổn hại thực vật, động vật hoặc gây bệnh cho thực vật hoặc sản phẩm thực vật (FAO, 1995; IPPC, 1997).
1.4. Điều kiện khảo nghiệm
Khảo nghiệm phải được tiến hành tại các cơ sở có đủ điều kiện theo quy định hiện hành về khảo nghiệm thuốc bảo vệ thực vật của Bộ Nông nghiệp và Phát triển nông thôn.
Khảo nghiệm được bố trí trên những ruộng dưa hấu thường bị bệnh nứt thân chảy nhựa gây hại, tại các thời gian có điều kiện thuận lợi cho bệnh phát triển và ở các địa điểm đại diện cho các vùng sinh thái.
Điều kiện trồng trọt (đất, phân bón, giống cây trồng, mật độ trồng...) phải đồng đều trên toàn khu khảo nghiệm và phù hợp với tập quán canh tác tại địa phương.
Các khảo nghiệm trên diện hẹp và diện rộng phải được tiến hành ở ít nhất 2 vùng sản xuất nông nghiệp (phía Bắc và phía Nam) đại diện cho khu vực sản xuất cây dưa hấu.
Trong thời gian khảo nghiệm không được sử dụng bất kỳ một loại thuốc trừ bệnh nào khác trên khu khảo nghiệm (bao gồm cả các công thức và dải phân cách). Nếu khu khảo nghiệm bắt buộc phải sử dụng thuốc để trừ các đối tượng gây hại khác như: sâu, cỏ dại, điều hòa sinh trưởng... thì thuốc được sử dụng để trừ đối tượng này phải không làm ảnh hưởng đến thuốc cần khảo nghiệm, không làm ảnh hưởng đến đối tượng khảo nghiệm và phải được phun rải đều trên tất cả các ô khảo nghiệm, kể cả ô đối chứng. Các trường hợp trên (nếu có) phải được ghi chép lại.
Khi xử lý thuốc không để thuốc ở ô khảo nghiệm này tạt sang ô khảo nghiệm khác
II. QUY ĐỊNH KỸ THUẬT
2.1. Phương pháp khảo nghiệm
2.1.1. Bố trí công thức khảo nghiệm
Khảo nghiệm được bố trí theo phương pháp khối ngẫu nhiên đầy đủ hoặc theo các phương pháp khác đã được quy định trong thống kê sinh học.
Mỗi khảo nghiệm phải thực hiện theo các công thức sau:
Công thức khảo nghiệm là công thức sử dụng các loại thuốc định khảo nghiệm ở những liều lượng khác nhau hoặc theo các cách sử dụng khác nhau.
Công thức so sánh là công thức sử dụng một loại thuốc phòng trừ bệnh đã được đăng ký trong danh mục thuốc bảo vệ thực vật được phép sử dụng ở Việt Nam và đang được sử dụng phổ biến, có hiệu quả ở địa phương để phòng trừ bệnh nứt thân chảy nhựa hại cây dưa hấu.
Công thức đối chứng là công thức không sử dụng bất kỳ loại thuốc bảo vệ thực vật nào để phòng trừ bệnh nứt thân chảy nhựa dưa hấu. Với khảo nghiệm là thuốc phun: công thức đối chứng được phun bằng nước lã.
2.1.2. Diện tích ô khảo nghiệm và số lần nhắc lại
Khảo nghiệm diện hẹp: Diện tích của mỗi ô khảo nghiệm từ 30 m2 - 50 m2, số lần nhắc lại 3 - 4 lần.
Khảo nghiệm diện rộng: Diện tích của mỗi ô khảo nghiệm từ 300 m2 - 500 m2, không nhắc lại.
Các ô khảo nghiệm phải có dạng hình vuông hay hình chữ nhật nhưng chiều dài phải không vượt quá hai lần chiều rộng.
Giữa các công thức khảo nghiệm phải có dải phân cách ít nhất là 1 hàng cây dưa hấu.
2.2. Tiến hành xử lý thuốc
2.2.1. Lượng thuốc và lượng nước sử dụng
Lượng thuốc sử dụng được tính bằng kg; lít chế phẩm hoặc gam hoạt chất trên đơn vị diện tích 1 ha.
Với dạng thuốc thương phẩm pha với nước để phun: Lượng nước sử dụng phải theo hướng dẫn cụ thể đối với từng loại thuốc, phù hợp với từng giai đoạn sinh trưởng của cây dưa hấu cũng như cách thức tác động của từng loại thuốc. Khi không có khuyến cáo của các tổ chức cá nhân đăng ký về lượng nước pha thuốc, lượng nước pha thuốc thì sử dụng từ 500 - 600 lít/ha.
Các số liệu về lượng thuốc thành phẩm và lượng nước sử dụng (l/ha) phải được ghi rõ.
2.2.2. Dụng cụ phun rải thuốc
Dụng cụ xử lý thuốc: Bình bơm động cơ, bình bơm tay đeo vai, cốc đong, cân, pipet...
Khi xử lý thuốc, phải sử dụng các công cụ phun rải thuốc thích hợp đảm bảo yêu cầu của khảo nghiệm, ghi chép đầy đủ tình hình vận hành của công cụ phun rải thuốc để đảm bảo yêu cầu kỹ thuật.
2.2.3. Thời điểm và số lần xử lý thuốc
Thời điểm và số lần xử lý thuốc thực hiện đúng theo hướng dẫn sử dụng của nhà sản xuất và đăng ký.
Khi không có khuyến cáo cụ thể thời điểm xử lý thuốc thì tùy theo mục đích khảo nghiệm, các đặc tính hóa học, phương thức tác động của thuốc và đặc điểm sinh trưởng của cây trồng thì số lần xử lý từ 1-2 lần cách nhau 7 ngày. Xử lý lần đầu khi tỷ lệ bệnh khoảng 5%.
2.3. Điều tra và thu thập số liệu
2.3.1. Chỉ tiêu, phương pháp và thời điểm điều tra
2.3.1.1. Chỉ tiêu điều tra
|
+ Tỷ lệ bệnh (%) = |
Số dây bị bệnh |
x 100 |
|
Tổng số dây điều tra |
||
|
+ Chỉ số bệnh (%) = |
5n5 + 4n4 + 3n3 + 2n2 + n1 |
x 100 |
|
5N |
Trong đó:
n1: số dây bị bệnh ở cấp 1: Dây có < 3 lá bị bệnh
n2: số dây bị bệnh ở cấp 2: Dây có 3 - 4 lá bị bệnh
n3: số dây bị bệnh ở cấp 3: Dây có vết bệnh nứt ở thân <3 cm hoặc < 3 lá bị khô cháy
n4: số dây bị bệnh ở cấp 4: Dây có vết bệnh nứt ở thân >3 - 5 cm hoặc 3 - 4 lá bị khô cháy
n5: số dây bị bệnh ở cấp 5: Dây có cuống quả bị bệnh hoặc có vết bệnh nứt ở thân > 5 cm hoặc > 4 lá bị khô cháy.
N - Tổng số dây điều tra
2.3.1.2. Phương pháp điều tra
Mỗi ô chọn 5 điểm cố định nằm trên 2 đường chéo góc (đối với khảo nghiệm diện hẹp) và 10 điểm (đối với khảo nghiệm diện rộng), mỗi điểm điều tra 4 dây cố định, các điểm này nằm cách mép ô khảo nghiệm ít nhất 1 hàng dưa hấu.
2.3.1.3. Thời điểm điều tra
Thời điểm và số lần điều tra ngay trước khi xử lý thuốc và 7, 14 ngày sau khi xử lý thuốc lần cuối.
2.3.1.4. Xử lý số liệu
Hiệu lực phòng trừ của thuốc trừ bệnh nứt thân chảy nhựa hại cây dưa hấu được đánh giá qua tỷ lệ và chỉ số bệnh tại các lần điều tra.
Những số liệu thu được qua khảo nghiệm diện hẹp phải được xử lý bằng các phương pháp thống kê thích hợp.
2.3.1.5. Đánh giá tác động của thuốc đến cây trồng
Đánh giá ảnh hưởng của thuốc khảo nghiệm (nếu có) đến sự sinh trưởng và phát triển của cây dưa hấu theo thang phân cấp (phụ lục 1).
Những chỉ tiêu nào đo đếm được phải biểu thị bằng các số liệu cụ thể theo các phương pháp điều tra phù hợp.
Các chỉ tiêu đánh giá được bằng mắt như độ cháy lá, quăn lá, sự thay đổi màu sắc lá... phải mô tả.
Nếu thuốc làm ảnh hưởng đến sinh trưởng, phát triển cây dưa hấu phải theo dõi và ghi nhận ngày cây phục hồi trở lại.
2.3.1.6. Quan sát và ghi chép về thời tiết
Ghi chép các số liệu về nhiệt độ, ẩm độ, lượng mưa trong suốt thời gian khảo nghiệm theo số liệu thời tiết tại trạm khí tượng gần nhất.
III. QUY ĐỊNH VỀ QUẢN LÝ THỰC HIỆN
3.1. Báo cáo và công bố kết quả
3.1.1. Đánh giá mức độ độc của thuốc đối với cây trồng (Phụ lục 1)
3.1.2. Nội dung báo cáo (Phụ lục 2)
3.2. Tổ chức quản lý, thực hiện
Đơn vị thực hiện khảo nghiệm phải hoàn toàn chịu trách nhiệm về số liệu đưa ra trong báo cáo và có trách nhiệm lưu giữ số liệu thô của khảo nghiệm.
Căn cứ yêu cầu quản lý, Cục Bảo vệ thực vật có trách nhiệm kiến nghị Bộ Nông nghiệp và Phát triển nông thôn sửa đổi, bổ sung quy chuẩn này khi cần thiết.
Phụ lục 1.
Bảng phân cấp mức độ độc của thuốc khảo nghiệm đối với cây dưa hấu
|
Cấp 1 2 3 4 5 6 7 8 9 |
Triệu chứng nhiễm độc Cây chưa có biểu hiện ngộ độc Ngộ độc nhẹ, sinh trưởng của cây giảm nhẹ Có triệu chứng ngộ độc nhẹ nhìn thấy bằng mắt. Triệu chứng ngộ độc nhưng chưa ảnh hưởng đến năng suất Dây và lá biến màu hoặc cháy, thuốc gây ảnh hưởng đến năng suất Thuốc làm giảm năng suất ít Thuốc gây ảnh hưởng nhiều đến năng suất Triệu chứng ngộ độc tăng dần tới làm chết cây Cây bị chết hoàn toàn |
Nếu cây dưa hấu bị ngộ độc thuốc, cần xác định bao nhiêu ngày sau thì phục hồi.
Phụ lục 2.
Nội dung chính báo cáo khảo nghiệm
1. Tên khảo nghiệm
2. Yêu cầu của khảo nghiệm
3. Điều kiện khảo nghiệm:
- Đơn vị khảo nghiệm
- Tên cán bộ tiến hành khảo nghiệm
- Thời gian khảo nghiệm.
- Địa điểm khảo nghiệm.
- Nội dung khảo nghiệm.
- Đặc điểm khảo nghiệm.
- Đặc điểm đất đai, canh tác, giống cây trồng...
- Đặc điểm thời tiết trong quá trình khảo nghiệm.
- Tình hình phát sinh và phát triển của bệnh hại trong khu thí nghiệm.
4. Phương pháp khảo nghiệm:
- Công thức khảo nghiệm.
- Phương pháp bố trí khảo nghiệm.
- Số lần nhắc lại.
- Kích thước ô khảo nghiệm.
- Dụng cụ phun, rải thuốc.
- Lượng thuốc sử dụng kg, lít thuốc thương phẩm/ha hay g(kg) hoạt chất/ha.
- Lượng nước thuốc sử dụng (l/ha).
- Ngày xử lý thuốc.
- Phương pháp điều tra và đánh giá hiệu lực của các loại thuốc khảo nghiệm.
5. Kết quả khảo nghiệm:
- Các bảng số liệu.
- Đánh giá hiệu lực của từng loại thuốc.
- Nhận xét tác động của từng loại thuốc đến cây trồng và các ảnh hưởng khác (xem phụ lục).
6. Kết luận: Nhận xét về hiệu lực và ảnh hưởng của thuốc khảo nghiệm đối với cây trồng phải căn cứ vào số liệu thu được.
National technical regulation on Procedure for identification of South American leaf blight of rubber (Microcyclus ulei (Henn.) Arx) - Plant quarantine pest of Vietnam
Lời nói đầu
QCVN 01 - 179 : 2014/BNNPTNT do Trung tâm Giám định Kiểm dịch thực vật biên soạn, Cục Bảo vệ thực vật trình duyệt, Bộ Nông nghiệp & PTNT ban hành tại Thông tư số 16/TT-BNNPTNT ngày 05 tháng 6 năm 2014.
QUY CHUẨN KỸ THUẬT QUỐC GIA VỀ QUY TRÌNH GIÁM ĐỊNH BỆNH RỤNG LÁ CAO SU NAM MỸ MICROCYCLUS ULEI (HENN.) ARX LÀ DỊCH HẠI KIỂM DỊCH THỰC VẬT CỦA VIỆT NAM
National technical regulation on Procedure for identification of South American leaf blight of rubber (Microcyclus ulei (Henn.) Arx) - Plant quarantine pest of Vietnam
I. QUY ĐỊNH CHUNG
1.1. Phạm vi điều chỉnh
Quy chuẩn này quy định quy trình giám định bệnh rụng lá cao su Nam Mỹ Microcyclus ulei (Henn.) Arx- là dịch hại kiểm dịch thực vật nhóm I của Việt Nam
1.2. Đối tượng áp dụng
Quy chuẩn này áp dụng đối với các tổ chức, cá nhân Việt Nam hoặc nước ngoài có hoạt động liên quan đến lĩnh vực bảo vệ và kiểm dịch thực vật thực hiện giám định bệnh rụng lá cao su Nam Mỹ Microcyclus ulei (Henn.) Arx. - là dịch hại kiểm dịch thực vật (KDTV) nhóm I thuộc Danh mục dịch hại KDTV của Việt Nam.
1.3. Giải thích từ ngữ
Trong quy chuẩn này, các từ ngữ dưới đây được hiểu như sau:
1.3.1. Dịch hại kiểm dịch thực vật (plant quarantine pest)
Là loài dịch hại có nguy cơ gây hại nghiêm trọng tài nguyên thực vật trong một vùng mà ở đó loài sinh vật này chưa xuất hiện hoặc xuất hiện có phân bố hẹp và phải được kiểm soát chính thức.
1.3.2. Thực vật (plant)
Là cây và những bộ phận của cây còn sống, kể cả hạt giống và sinh chất có khả năng làm giống.
1.3.3. Mẫu (sample)
Là khối lượng thực vật, sản phẩm thực vật hoặc tàn dư của sản phẩm thực vật được lấy ra theo một qui tắc nhất định.
1.3.4. Tiêu bản (specimen)
Là mẫu vật điển hình tiêu biểu của dịch hại được xử lý để dùng cho việc định loại, nghiên cứu, giảng dạy, phổ biến kỹ thuật và trưng bày thành các bộ sưu tập.
II. QUY ĐỊNH KỸ THUẬT
2.1. Phương pháp thu thập và bảo quản mẫu
2.1.1. Thu thập mẫu
![]() Đối với hàng xuất,
nhập khẩu, quá cảnh hoặc vận chuyển, bảo quản trong nước: Tiến hành
lấy mẫu theo
tiêu chuẩn Việt Nam TCVN 4731:891
"Kiểm dịch thực vật - phương pháp lấy mẫu", quy chuẩn kỹ thuật quốc
gia QCVN 01-21:2010/BNNPTNT1 "Phương
pháp kiểm tra củ, quả xuất nhập khẩu và quá cảnh", QCVN 01-23:2010/BNNPTNT1
"Phương pháp kiểm tra các loại hạt xuất, nhập khẩu và quá cảnh", QCVN 01-22:2010/BNNPTNT1
"Phương pháp kiểm tra cây xuất nhập khẩu và quá cảnh".
Đối với hàng xuất,
nhập khẩu, quá cảnh hoặc vận chuyển, bảo quản trong nước: Tiến hành
lấy mẫu theo
tiêu chuẩn Việt Nam TCVN 4731:891
"Kiểm dịch thực vật - phương pháp lấy mẫu", quy chuẩn kỹ thuật quốc
gia QCVN 01-21:2010/BNNPTNT1 "Phương
pháp kiểm tra củ, quả xuất nhập khẩu và quá cảnh", QCVN 01-23:2010/BNNPTNT1
"Phương pháp kiểm tra các loại hạt xuất, nhập khẩu và quá cảnh", QCVN 01-22:2010/BNNPTNT1
"Phương pháp kiểm tra cây xuất nhập khẩu và quá cảnh".
Đối với cây trồng ngoài đồng ruộng: Lấy mẫu theo Quy chuẩn kỹ thuật quốc gia QCVN 01-38/2010/BNNPTNT1 "Phương pháp điều tra phát hiện dịch hại cây trồng".
2.1.2. Bảo quản mẫu
Các bộ phận tươi có triệu chứng bệnh (cành, lá, thân, quả...) chứa trong các túi ni-lông có lỗ thông khí bảo quản trong tủ lạnh ở nhiệt độ 3 - 5oC.
Các tiêu bản lam của nấm được dán nhãn, để trong hộp chuyên dụng đựng tiêu bản lam và bảo quản ở nhiệt độ phòng.
2.2. Thiết bị dụng cụ, hóa chất
Kính lúp soi nổi có độ phóng đại 10 - 40 lần, kính hiển vi có độ phóng đại 40 - 1.000 lần.
Bộ dao, kim giải phẫu, panh, kéo, đèn cồn, đĩa petri, lam, lamen
Cồn 70%, lactophenol
2.3. Phương pháp phát hiện và giám định bệnh
2.3.1. Phương pháp phát hiện và thu thập mẫu bệnh
Trên lá non (giai đoạn lá đỏ đồng): lá đổi màu và biến dạng, Các vết bệnh không có hình dạng nhất định và phát triển ở mặt dưới của lá (hình 1, phụ lục 1). Bệnh nặng lá có thể co lại và rụng. Cuống lá vẫn đính trên cây vài ngày sau mới rụng.
Trên lá non: bề mặt vết bệnh điển hình phủ lớp mốc màu xám đen. (hình 2, phụ lục 1). Lá bị bệnh nhỏ và biến dạng so với lá khỏe. Mặt trên của lá ở những điểm tương ứng với vết bệnh sẽ biến vàng.
Trên lá trưởng thành: vết bệnh tạo thành các u lồi hình nhẫn ở mặt trên của lá.
Trên lá già: mô ở phần trung tâm vết bệnh chết hoại có màu trắng như giấy và sau đó rời ra để lại các lỗ thủng trên lá (hình 3, phụ lục 1).
Nấm còn gây hại các bộ phận khác của cây như gân chính, cuống lá, chùm hoa, quả và thân. Thân bị nhiễm bệnh, cây có thể bị chết ngọn.
2.3.2. Phương pháp giám định bệnh
Dùng kim khêu nấm khêu bào tử nấm trực tiếp từ các lớp mốc trên các phần nghi ngờ nhiễm bệnh, đặt lên lam đã có 01 giọt lactophenol. Đặt lam lên kính hiển vi tìm và quan sát đặc điểm hình thái, đo kích thước bào tử nấm.
So sánh với đặc điểm và kích thước của bào tử nấm Microcyclus ulei (Henn.) Arx (phụ lục 1)
III. THẨM ĐỊNH KẾT QUẢ GIÁM ĐỊNH VÀ BÁO CÁO
Sau khi khẳng định kết quả giám định bệnh rụng lá cao su Nam Mỹ Microcyclus ulei (Henn.) Arx) là dịch hại Kiểm dịch thực vật của Việt Nam, đơn vị giám định phải gửi báo cáo về Cục Bảo vệ thực vật kèm theo phiếu kết quả giám định (phụ lục 2).
Tất cả các đơn vị thuộc hệ thống Bảo vệ và KDTV phải lưu giữ, quản lý và khai thác dữ liệu về kết quả điều tra, báo cáo và giám định bệnh rụng lá cao su Nam Mỹ Microcyclus ulei (Henn.) Arx).
Đối với đơn vị lần đầu tiên giám định và phát hiện được bệnh rụng lá cao su Nam Mỹ Microcyclus ulei (Henn.) Arx phải gửi mẫu hoặc tiêu bản về Trung tâm Giám định kiểm dịch thực vật để thẩm định.
Đơn vị giám định phải đảm bảo thời gian lưu mẫu theo quy định hiện hành.
IV. TỔ CHỨC THỰC HIỆN
Cục Bảo vệ thực vật có trách nhiệm phổ biến; tổ chức, hướng dẫn và kiểm tra việc thực hiện Quy chuẩn này trong hệ thống tổ chức chuyên ngành Bảo vệ và Kiểm dịch thực vật cũng như các tổ chức, cá nhân khác có liên quan;
Các tổ chức, cá nhân có hoạt động liên quan đến điều tra, thu thập mẫu, xử lý và bảo quản mẫu bệnh rụng lá cao su Nam Mỹ tại Việt Nam phải tuân theo quy định của quy chuẩn này cũng như các quy định của pháp luật có liên quan hiện hành.
Phụ lục 1.
Thông tin về dịch hại
1. Phân bố và ký chủ
1.1. Phân bố
Trong nước: Bệnh chưa có ở Việt Nam
Trên thế giới: Chỉ phân bố ở châu Mỹ: Brazil, Belize, Costa Rica, El Salvador, Guatemala, Haiti, Honduras, Nicaragua, Panama, Trinidad và Tobago, Bolivia, Colombia, Ecuador, French Guiana, Guyana, Peru, Suriname, Venezuela, Dominica, Mexico
1.2. Ký chủ
Kí chủ chính là cao su (Hevea brasiliensis) ngoài ra còn kí sinh trên H. benthamiana, H. camargoana, H. camporum, H. guianensis, H. pauciflora và H. spruceana, và loài lai giữa các loài trên.
2. Tên khoa học và vị trí phân loại
Tên tiếng Việt: Bệnh rụng lá cao su Nam Mỹ
Tên khoa học: Microcyclus ulei (Henn.) Arx
Tên khác:
Passalora heveae Massee, nom. nud. [anamorph]
Aposphaeria ulei Henn. [anamorph]
Dothidella ulei Henn. [teleomorph]
Fusicladium heveae K. Schub. & U. Braun [anamorph]
Fusiciadium macrosporum J. Küyper [anamorph]
Melanopsammopsis ulei (Henn.) Stahel [teleomorph]
Vị trí phân loại:
Lớp: Dothideomycetes
Bộ: Capnodiales
Họ: Mycosphaerellaceae
3. Triệu chứng bệnh rụng lá cao su Nam Mỹ (SALB) M. ulei.

Hình 1: Giai đoạn đầu của bệnh SALB trên lá non
(Nguồn: FAO, 2012)

|
Hình 2: Vết bệnh SALB trên mặt dưới của lá (Nguồn: CABI, 2012) |
Hình 3: Vết bệnh SALB trên lá già (Nguồn: FAO, 2012) |
4. Đặc điểm hình thái nấm M. ulei gây bệnh rụng lá cao su Nam Mỹ.
Giám định nấm chủ yếu dựa trên đặc điểm hình thái của bào tử nấm. Nấm M. ulei thuộc lớp nấm túi (Ascomycete), nấm sản sinh 3 loại bào tử: Bào tử phân sinh; bào tử phấn và bào tử túi.
Bào tử phân sinh có vách ngăn (2 tế bào) hoặc có một số ít là đơn bào. Bào tử có hình gậy, tế bào phía trên to hơn tế bào phía dưới, phần đuôi cụt và bào tử có dạng xoắn đặc trưng (hình 4). Bào tử có màu trong suốt khi còn non sau đó xám dần theo thời gian. Kích thước của bào tử khá đa dạng 23-65x5-10mm (Chee); 23-62x5-10mm (Holliday); 12-30x5-8mm (Langford). Trong điều kiện khô thì bào tử teo lại (hình 5) và sẽ căng lên khi gặp ẩm độ cao.
Bào tử phấn có dạng chày một đầu to hơn (12-25mm) đầu kia (2-5mm). Bào tử dài 6-10mm. Bào tử túi 2 tế bào có vách ngăn thắt lại. Tế bào có kích thước không đồng đều 3-5 x 10-15 mm (Langford, 1945); 2-5 x 12-20 mm (Holliday, 1970); 12-20 x 2-5 mm (Chee and Holliday, 1986).

|
Hình 4: Bào tử phân sinh nấm M. ulei (Nguồn: CABI, 2012) |
Hình 5: Bào tử phân sinh nấm M. ulei khi bị khô (Nguồn: FAO, 2012) |
Phụ lục 2.
(quy định)
Mẫu phiếu kết quả giám định
|
Cơ quan Bảo vệ |
CỘNG HÒA XÃ
HỘI CHỦ NGHĨA VIỆT NAM |
|
|
……….. ngày …. tháng …. năm 20….. |
PHIẾU KẾT QUẢ GIÁM ĐỊNH
Bệnh rụng lá cao su Nam Mỹ Microcyclus ulei (Henn.) Arx là dịch hại kiểm dịch thực vật của Việt Nam
|
1. Tên hàng hóa |
: |
|
|
2. Nước xuất khẩu |
: |
|
|
3. Xuất xứ |
: |
|
|
4. Phương tiện vận chuyển |
: |
Khối lượng: |
|
5. Địa điểm lấy mẫu |
: |
|
|
6. Ngày lấy mẫu |
: |
|
|
7. Người lấy mẫu |
: |
|
|
8. Tình trạng mẫu |
: |
|
|
9. Ký hiệu mẫu |
: |
|
|
10. Số mẫu lưu |
: |
|
|
11. Người giám định |
: |
|
12. Phương pháp giám định: Theo quy chuẩn kỹ thuật quốc gia QCVN 01 - 179 : 2014/BNNPTNT về "Quy trình giám định bệnh rụng lá cao su Nam Mỹ Microcyclus ulei (Henn.) Arx - là dịch hại kiểm dịch thực vật của Việt Nam".
13. Kết quả giám định
Tên khoa học: Microcyclus ulei (Henn.) Arx
Lớp: Dothideomycetes
Bộ: Capnodiales
Họ: Mycosphaerellaceae
Là dịch hại kiểm dịch thực vật thuộc danh mục dịch hại kiểm dịch thực vật của Việt Nam.
|
TRƯỞNG PHÒNG KỸ THUẬT |
THỦ TRƯỞNG ĐƠN VỊ |
National technical regulation on Procedure for identification of Rhadinaphelenchus cocophilus (Cobb) Goodey - Plant quarantine pests of Vietnam
Lời nói đầu
QCVN 01 - 180 : 2014/BNNPTNT do Trung tâm Giám định Kiểm dịch thực vật biên soạn, Cục Bảo vệ thực vật trình duyệt, Bộ Nông nghiệp & PTNT ban hành tại Thông tư số 16/TT-BNNPTNT ngày 05 tháng 6 năm 2014.
QUY CHUẨN KỸ THUẬT QUỐC GIA VỀ QUY TRÌNH GIÁM ĐỊNH TUYẾN TRÙNG THỐI THÂN, RỄ CỌ DẦU, DỪA RHADINAPHELENCHUS COCOPHILUS (COBB) GOODEY LÀ DỊCH HẠI KIỂM DỊCH THỰC VẬT CỦA VIỆT NAM
National technical regulation on Procedure for identification of Rhadinaphelenchus cocophilus (Cobb) Goodey - Plant quarantine pests of Vietnam
I. QUY ĐỊNH CHUNG
1.1. Phạm vi điều chỉnh
Quy chuẩn này quy định Quy trình giám định tuyến trùng thối thân, rễ cọ dầu, dừa Rhadinaphelenchus cocophilus (Cobb) Goodey là dịch hại kiểm dịch thực vật của Việt Nam
1.2. Đối tượng áp dụng
Quy chuẩn này áp dụng đối với mọi tổ chức, cá nhân Việt Nam hoặc nước ngoài có hoạt động liên quan đến lĩnh vực bảo vệ và kiểm dịch thực vật tại Việt Nam (viết tắt là KDTV) thực hiện giám định tuyến trùng thối thân, rễ cọ dầu, dừa Rhadinaphelenchus cocophilus (Cobb) Goodey là dịch hại kiểm dịch thực vật (KDTV) thuộc Danh mục dịch hại KDTV của Việt Nam.
1.3. Giải thích từ ngữ
Những thuật ngữ trong quy chuẩn này được hiểu như sau:
1.3.1. Dịch hại kiểm dịch thực vật (quarantine pest)
Là loài dịch hại có nguy cơ gây hại nghiêm trọng tài nguyên thực vật trong một vùng mà ở đó loài sinh vật này chưa xuất hiện hoặc xuất hiện có phân bố hẹp và phải được kiểm soát chính thức.
1.3.2. Thực vật (plant)
Là cây và những bộ phận của cây còn sống, kẻ cả hạt giống và sinh chất có khả năng làm giống.
1.3.3. Tuyến trùng ký sinh thực vật (phytonematoda)
Là những loài tuyến trùng chủ yếu sống trong đất và có quan hệ chặt chẽ với thực vật đang phát triển và trong các tàn dư, sản phẩm thực vật sau thu hoạch. Chúng sống và ký sinh ở tất cả các phần của thực vật bao gồm rễ, củ, thân, lá, hoa, quả và hạt của các thực vật đang phát triển.
1.3.4. Mẫu (sample)
Là khối lượng thực vật, sản phẩm thực vật hoặc tàn dư của sản phẩm thực vật được định lượng và lấy ra theo một qui tắc nhất định.
1.3.5. Tiêu bản (specimen)
Là mẫu vật điển hình tiêu biểu của một loại dịch hại được xử lý để dùng cho việc định loại, nghiên cứu, giảng dạy, phổ biến kỹ thuật và trưng bày thành các bộ mẫu chuẩn sưu tập.
II. QUY ĐỊNH KỸ THUẬT
2.1. Phương pháp thu thập và bảo quản mẫu
2.1.1. Thu thập mẫu
- Đối với hàng hóa xuất, nhập khẩu, quá cảnh hoặc vận chuyển, bảo quản trong nước: Tiến hành lấy mẫu theo tiêu chuẩn Việt Nam TCVN 4731:891 "Kiểm dịch thực vật - phương pháp lấy mẫu", QCVN 01-22:2010/BNNPTNT "Phương pháp kiểm tra cây xuất, nhập khẩu và quá cảnh".
- Đối với cây trồng ngoài đồng ruộng: Lấy mẫu theo phương pháp của quy chuẩn kỹ thuật quốc gia QCVN 01-38:2010/BNNPTNT1 "Phương pháp điều tra phát hiện dịch hại cây trồng".
2.1.2. Bảo quản mẫu giám định
Mẫu được lưu giữ và bảo quản như sau:
- Các bộ phận tươi có triệu chứng nghi là tuyến trùng (rễ, thân, lá, chồi, hoa, quả) được để trong các túi ni-lông có lỗ thông khí, có đính nhãn và bảo quản trong tủ lạnh ở nhiệt độ khoảng 5oC.
- Mẫu đất được giữ ẩm bằng cách cho vào túi ni-lông có lỗ thông khí, có đính nhãn và để ở những nơi thoáng mát hoặc ở nhiệt độ phòng.
- Dung dịch có tuyến trùng được tách ra từ bộ phận bị hại thường được định hình trong dung dịch Formalin hoặc TAF để trong các lọ kín có dán nhãn và bảo quản trong tủ lạnh ở nhiệt độ 5 - 10oC.
- Tiêu bản lam phải có nhãn ký hiệu mẫu, để trong hộp chuyên dụng đựng tiêu bản lam và được bảo quản ở nhiệt độ phòng.
2.2. Thiết bị, dụng cụ, hóa chất dùng làm tiêu bản và giám định
- Kính lúp soi nổi có độ phóng đại 10 - 40 lần (10x - 40x), kính hiển vi có thước đo, có độ phóng đại 40 - 1.000 lần (40x - 1000x).
- Một số dụng cụ, hóa chất cần thiết khác:
+ Chậu thủy tinh có dung tích 4 lít, cốc thủy tinh 500ml, 250ml, 100ml, chén thủy tinh 4ml, đũa thủy tinh, khay men, giấy lọc, kéo, paraffin, keo dính tiêu bản, ...
+ Kim gắp tuyến trùng, đĩa đồng hồ, kim dầm mẫu, đĩa petri, lam, lamen.
+ Rây lọc tuyến trùng có đường kính mắt rây là: 25mm, 75mm, 150mm, 250mm, 700mm, 1.000mm, lưới lọc có đường kính mắt lưới 2mm.
+ Máy ly tâm, tủ định ôn, bình hút ẩm.
+ Dung dịch ZnSO4 hoặc MgSO4 hoặc đường saccazosa (tỷ trọng 1,18), formaldehyde (40%), glycerol (tinh khiết), triethanolamine (tinh khiết), nước cất.
2.3. Phương pháp tách lọc tuyến trùng
2.3.1. Phương pháp tách tuyến trùng từ các bộ phận của cây
2.3.1.1. Phương pháp kiểm tra trực tiếp
Các bộ phận của cây (rễ, thân, lá, chồi, hoa, quả) được rửa sạch. Chọn các bộ phận của cây có vết tổn thương, biến màu (lưu ý mẫu tế bào có màu đỏ) cắt nhỏ đặt vào đĩa petri. Chú ý các vết đục của côn trùng, thu thập côn trùng và ấu trùng của côn trùng môi giới truyền bệnh vì tuyến trùng có thể thu được trong ruột, xoang cơ thể và vùng cơ quan đẻ trứng của môi giới truyền tuyến trùng. Thêm nước vào đĩa để giữ cho mẫu không bị khô. Đặt đĩa petri có mẫu dưới kính lúp soi nổi có độ phóng đại từ 10 đến 40 lần.
Dùng kim dầm nhẹ mẫu và quan sát tìm tuyến trùng. Nếu phát hiện thấy tuyến trùng, dùng kim gắp tuyến trùng lên lam và quan sát dưới kính hiển vi có độ phóng đại từ 40 - 1.000 lần.
2.3.1.2. Phương pháp lọc tĩnh
Mẫu thực vật (rễ, thân, lá, chòi, hoa, quả) được rửa sạch, cắt thành những đoạn thật nhỏ (khoảng 0,5mm). Chú ý các vết đục của côn trùng, thu thập côn trùng và ấu trùng của côn trùng môi giới truyền bệnh. Đặt mẫu đã cắt lên trên rây có đường kính 0,75mm và thêm nước vừa xâm xấp rây. Sau 24 - 48 giờ, đổ nước dưới rây vào cốc thủy tinh. Dùng ống hút lấy dung dịch thu được ở cốc thủy tinh cho vào đĩa đồng hồ và kiểm tra dưới kính lúp soi nổi có độ phóng đại từ 10 - 40 lần. Nếu phát hiện thấy tuyến trùng, dùng kim gắp tuyến trùng lên lam và quan sát dưới kính hiển vi có độ phóng đại 40 - 1.000 lần. Kiểm tra lần lượt cho đến khi hết nước trong cốc thủy tinh.
2.3.1.3. Phương pháp ly tâm
Mẫu thực vật (rễ, thân, lá, chồi, hoa, quả) được rửa sạch, cắt thành từng đoạn 0,5cm, trộn đều và cân lấy 5-10 gram (tùy theo lượng mẫu có). Chú ý các vết đục của côn trùng, thu thập côn trùng và ấu trùng của côn trùng môi giới truyền bệnh. Thêm 250ml nước sạch, nghiền nhỏ mẫu bằng máy xay sinh tố. Lọc qua rây có đường kính 1200mm, dùng vòi nước nhỏ rửa sạch từ phía trên xuống cho đến khi phần mẫu nghiền phía trên rây sạch. Thu phần nước phía dưới và thêm nước cho đủ 1 lít, khuấy đều.
Lấy 100ml dung dịch thu được ở trên cho vào ống nghiệm. Thêm 01 thìa cà phê bột cao lanh vào ống và khuấy đều bằng máy khuấy. Đặt ống nghiệm vào máy ly tâm và ly tâm với vận tốc 1.800 vòng/phút trong 4 phút. Sau đó, bỏ phần dung dịch phía trên, giữ lại phần cặn phía dưới. Thêm dung dịch ZnSO4 hoặc MgSO4 hoặc đường saccazosa (cao hơn 1cm so với bề mặt của lớp cặn) và khuấy đều trong 1 phút. Tiếp tục ly tâm với vận tốc 1.800 vòng/phút trong 4 phút.
Đổ phần dung dịch phía trên của ống ly tâm qua rây lọc có đường kính 5mm vào cốc thủy tinh để kiểm tra. Dùng ống hút lấy dung dịch thu được ở cốc thủy tinh cho vào đĩa đồng hồ và kiểm tra dưới kính lúp soi nổi có độ phóng đại từ 10 - 40 lần. Nếu phát hiện thấy tuyến trùng, dùng kim gắp tuyến trùng lên lam và quan sát dưới kính hiển vi có độ phóng đại 40 - 1.000 lần. Kiểm tra lần lượt cho đến khi hết nước trong cốc thủy tinh.
Rửa phần trên rây bằng nước sạch và dùng bình xịt nước để rửa, thu tuyến trùng bám dính trên rây vào cốc thủy tinh và tiến hành kiểm tra tuyến trùng tương tự như trên.
2.3.2. Phương pháp tách tuyến trùng từ đất
2.3.2.1. Phương pháp rây Cobb
Cân 100 gram đất cho vào chậu thủy tinh, cho thêm 2 - 3 lít nước vào chậu thủy tinh và ngâm trong 1 - 2 giờ cho đất tan. Khuấy đều đất và nước, để lắng trong 10 giây. Sau đó lọc qua rây có đường kính 1.000mm, rửa sạch rây và phần cặn trên rây. Dung dịch được thu vào chậu thủy tinh thứ 2. Bỏ phần cặn còn lại trên rây và trong chậu thủy tinh ban đầu. Quá trình này lặp lại 2-3 lần nhằm loại bỏ cát, sạn, rác và đá.
Khuấy đều dung dịch đã thu được ở trên và tiếp tục lọc bằng rây có đường kính 700mm, dung dịch được thu vào chậu thủy tinh. Phần cặn trên rây được rửa sạch và cho vào cốc thủy tinh. Tiếp tục lọc dung dịch thu được ở chậu thủy tinh qua các rây có đường kính 250mm, 150mm và 25mm. Phần cặn trên rây cũng được rửa sạch và cho vào cốc thủy tinh. Riêng với rây 25mm có thể lọc lại 3 - 4 lần.
Nếu lượng nước thu được trong cốc thủy tinh quá đầy, để lắng trong 2 giờ và đổ bớt nước phía trên. Tiếp đó, chuyển dung dịch trên sang rây lọc tĩnh. Sau 24 - 48 giờ, đổ nước dưới rây vào cốc thủy tinh. Dùng ống hút lấy dung dịch thu được ở cốc thủy tinh cho vào đĩa đồng hồ và kiểm tra dưới kính lúp soi nổi có độ phóng đại từ 10 - 40 lần. Nếu phát hiện thấy tuyến trùng, dùng kim gắp tuyến trùng lên lam và quan sát dưới kính hiển vi có độ phóng đại 40 - 1.000 lần. Kiểm tra lần lượt cho đến khi hết nước trong cốc thủy tinh.
2.3.2.2. Phương pháp phễu lọc Baermann cải tiến
Chuẩn bị khay và lưới lọc có đường kính mắt lưới 2mm. Đặt lớp giấy lọc lên trên mặt lưới. Cân lượng đất cần kiểm tra (tối thiểu là 100gram) và rải đều trên mặt giấy. Thao tác đặt giấy và rải đất phải thật nhẹ để tránh rách, thủng giấy lọc. Đổ nước theo mép khay sao cho nước vừa ướt đất. Sau 24 - 48 giờ, đổ nước dưới rây vào cốc thủy tinh và kiểm tra dần bằng đĩa đồng hồ dưới kính lúp soi nổi có độ phóng đại từ 10 - 40 lần. Nếu phát hiện thấy tuyến trùng, dùng kim gắp tuyến trùng lên lam và quan sát dưới kính hiển vi có độ phóng đại 40 - 1.000 lần. Kiểm tra lần lượt cho đến khi hết nước trong cốc thủy tinh.
Chú ý: Lưới lọc phải có chân hoặc quai (gác lên thành khay) để khi đặt trong khay, đáy của lưới lọc không chạm sát đáy khay.
2.3.2.3. Phương pháp ly tâm
Cân 100 gram đất vào cốc thủy tinh, thêm 250ml nước, khuấy đều. Lọc qua rây có đường kính 1.200mm, dùng vòi nước rửa kỹ phần trên rây, loại bỏ phần cặn còn lại trên rây. Thu phần nước dưới rây, thêm nước cho đủ 1 lít và khuấy đều.
Lấy 100 ml dung dịch thu được ở trên vào ống nghiệm. Thêm 01 thìa cà phê bột cao lanh vào ống và khuầy đều bằng máy khuấy. Đặt ống nghiệm vào máy và ly tâm với vận tốc 1.800 vòng/phút trong 4 phút.
Bỏ phần dung dịch phía trên, giữ lại phần cặn phía dưới. Thêm dung dịch ZnSO4 hoặc MgSO4 hoặc đường saccazosa (cao hơn 1 cm so với bề mặt của lớp cặn). Khuấy đều trong 1 phút. Tiếp tục ly tâm với vận tốc 1.800 vòng/phút trong 4 phút.
Đổ dung dịch phía trên qua rây lọc có đường kính 5mm. Rửa phần trên rây bằng nước sạch và dùng bình xịt nước để rửa, thu tuyến trùng bám dính trên rây vào cốc.
Dùng ống hút lấy dung dịch thu được ở cốc thủy tinh cho vào đĩa đồng hồ và kiểm tra dưới kính lúp soi nổi có độ phóng đại từ 10 - 40 lần. Nếu phát hiện thấy tuyến trùng, dùng kim gắp tuyến trùng lên lam và quan sát dưới kính hiển vi có độ phóng đại 40 - 1.000 lần. Kiểm tra lần lượt cho đến khi hết nước trong cốc thủy tinh.
2.4. Phương pháp làm tiêu bản tuyến trùng
2.4.1. Dung dịch bảo quản tuyến trùng
Tuyến trùng ký sinh thực vật thu được từ một trong các phương pháp tách lọc nêu trên được đưa vào một trong ba loại dung dịch dưới đây để bảo quản tuyến trùng.
Để tiêu bản tuyến trùng giữ được hình dáng đặc trưng, trước khi cho vào dung dịch bảo quản nên xử lý nhiệt tuyến trùng bằng nước nóng ở nhiệt độ 70-80oC trong 5 phút.
- Dung dịch 1: Formalin
Dung dịch Formadehyde 4%.
- Dung dịch 2: Formalin - glycerol (FG)
|
Formalin (40% - Formaldehyde): Glycerol: Nước cất: |
10ml 01ml 89ml |
- Dung dịch 3: TAF
|
Triethanolamine: Formalin (40% - formaldehyde): Nước cất: |
02ml 07ml 91ml |
2.4.2. Phương pháp xử lý và làm tiêu bản tuyến trùng
2.4.2.1. Phương pháp xử lý tuyến trùng
- Dung dịch xử lý:
|
Dung dịch 1: |
Cồn (96%) Glycerol Nước cất |
20ml 01ml 79ml |
|
Dung dịch 2: |
Cồn (96%) Glycerol |
95ml 05ml |
- Cách tiến hành:
Gắp tuyến trùng từ dung dịch bảo quản vào chén thủy tinh có chứa 0,5ml dung dịch xử lý (dung dịch 1). Đặt chén này trong bình hút ẩm đậy kín có chứa 1/10 thể tích cồn 96o. Bình hút ẩm được đặt trong tủ ấm ở điều kiện nhiệt độ cố định 40oC với thời gian tối thiểu là 12 giờ.
Lấy chén thủy tinh ra khỏi bình hút ẩm, thêm dung dịch 2. Đậy nắp một phần miệng chén để cồn bay hơi từ từ. Chén thủy tinh có chứa tuyến trùng tiếp tục giữ trong tủ ấm ở điều kiện nhiệt độ cố định 40oC. Sau 2-3 giờ bổ sung thêm dung dịch 2 vào chén thủy tinh cho gần đầy, làm lại 2-3 lần. Tới khi tuyến trùng chỉ còn lại trong Glycerol có thể sử dụng làm tiêu bản được.
Hoặc đặt chén thủy tinh chứa tuyến trùng trong glycerol nguyên chất trên trong bình hút ẩm có chứa vôi. Bảo quản lâu dài để làm tiêu bản cố định.
2.4.2.2. Phương pháp làm tiêu bản
Lấy lam kính sạch và làm vòng parapin hoặc sáp ong (đường kính khoảng 1cm) trên lam kính. Cho 1 giọt glycerol nguyên chất vào giữa vòng parapin hoặc sáp ong. Dùng kim gắp, gắp 5 con tuyến trùng (đã xử lý trong dung dịch cố định) đặt vào giữa giọt glycerol, chỉnh cho các cá thể tuyến trùng nằm cùng một hướng. Đậy lamen và đặt lam kính trên bàn nhiệt cho parapin hoặc sáp ong tan chảy. Nhấc nhanh lam kính và đặt ra chỗ mát. Gắn keo bảo vệ.
2.5. Trình tự giám định
2.5.1. Quan sát tiêu bản dưới kính hiển vi có độ phóng đại từ 40 - 1.000 lần các chỉ tiêu sau
- Hình dạng kim hút, môi, đuôi, tuyến thực quản, đường bên của tuyến trùng, gai giao cấu của con đực, cơ quan sinh sản, tử cung sau của con cái.
- Hình dạng và đo kích thước của tuyến trùng cái và đực.
- Hình dạng trứng.
2.5.2. Đối chiếu kết quả quan sát và kết quả đo đếm được với đặc điểm hình thái và giải phẫu của tuyến trùng thối thân, rễ cọ dầu, dừa Rhadinaphelenchus cocophilus (Cobb) Goodey (phụ lục 1).
Thông thường số lượng cá thể nghiên cứu phải đảm bảo là 30 (n=30). Trong trường hợp số lượng cá thể ít hơn hoặc chỉ phát hiện duy nhất một cá thể có các đặc điểm phân loại như trên có thể cho phép kết luận là tuyến trùng Rhadinaphelenchus cocophilus (Cobb) Goodey (chỉ áp dụng đối với các đơn vị đã từng giám định được tuyến trùng Rhadinaphelenchus cocophilus (Cobb) Goodey.
III. THẨM ĐỊNH KẾT QUẢ GIÁM ĐỊNH VÀ BÁO CÁO
Sau khi khẳng định kết quả giám định là Rhadinaphelenchus cocophilus (Cobb) Goodey thuộc danh mục dịch hại KDTV nhóm I của Việt Nam, đơn vị giám định phải gửi báo cáo về Cục Bảo vệ thực vật kèm theo phiếu kết quả giám định (phụ lục 2).
Tất cả các đơn vị thuộc hệ thống Bảo vệ và KDTV phải lưu giữ, quản lý và khai thác dữ liệu về kết quả điều tra, báo cáo và giám định Rhadinaphelenchus cocophilus (Cobb) Goodey.
Đối với đơn vị lần đầu tiên giám định và phát hiện được Rhadinaphelenchus cocophilus (Cobb) Goodey phải gửi mẫu hoặc tiêu bản về Trung tâm Giám định kiểm dịch thực vật để thẩm định và báo cáo Cục Bảo vệ thực vật trước khi công bố và xử lý dịch theo quy định của pháp luật hiện hành.
Đơn vị giám định phải lưu mẫu theo Quy chuẩn kỹ thuật hiện hành về thời gian để giải quyết khiếu nại về kết quả giám định (nếu có).
IV. TỔ CHỨC THỰC HIỆN
Cục Bảo vệ thực vật có trách nhiệm phổ biến; tổ chức, hướng dẫn và kiểm tra việc thực hiện Quy chuẩn này trong hệ thống tổ chức chuyên ngành Bảo vệ và Kiểm dịch thực vật cũng như các tổ chức, cá nhân khác có liên quan;
Các tổ chức, cá nhân có hoạt động liên quan đến điều tra, thu thập mẫu, xử lý và bảo quản mẫu tuyến trùng thối thân, rễ cọ dầu, dừa tại Việt Nam phải tuân theo quy định của quy chuẩn này cũng như các quy định của pháp luật có liên quan hiện hành.
Phụ lục 1.
Thông tin về dịch hại
1. Tuyến trùng thối thân, rễ cọ dầu, dừa Rhadinaphelenchus cocophltus (Cobb) Goodey
1.1. Phân bố và ký chủ
- Phân bố: Bệnh phân bố hạn chế ở Tây bán cầu (Trinidad và Tobago) và Mỹ la tinh (Dominic Republic, Venezuela, Guyana, Surinam, Colombia, Ecuador, Peru, Mexico, Brazil, Panama, Nicaragua, Costarica, Belize, Honduras, El Salvador và Guatemala).
- Ký chủ: Phạm vi ký chủ hẹp chủ yếu trên các cây cọ, cọ dầu, dừa: Dừa, cọ dầu châu phi, cọ lùn.
1.2. Tên khoa học và vị trí phân loại:
- Tên khoa học: Rhadinaphelenchus cocophilus (Cobb) Goodey
- Tên tiếng Việt: Tuyến trùng thối thân, rễ cọ dầu, dừa
- Vị trí phân loại
Ngành: giun tròn
Lớp: Nematoda
Bộ: Aphelenchida
Bộ phụ: Aphelenchina
Họ: Aphelenchoididae
2. Đặc điểm nhận dạng
2.1. Đặc điểm chung
- Tuyến trùng hình giun dài, rất mảnh, vùng môi nhẵn, phẳng và cao. Nút chân kim hút rất mờ, có bốn đường bên. Diều hình bầu dục, hơi vuông, tuyến thực quản rất mảnh.
- Con cái có hai buồng trứng, lỗ sinh dục nằm ở nửa cuối thân. Nhìn từ mặt bụng, lỗ sinh dục có dạng khe, nhìn như hình chữ C. Túi sau dạ con thon dài. Đuôi thon dài, gần thành dạng hình trụ. Mút đuôi tròn.
- Con đực: đuôi cong nhọn, gần có dạng trụ ở phía trước, dạng nón ở phía sau, mút đuôi nhọn. Vây bao quanh đuôi
2.2. Đặc điểm nhận dạng tuyến trùng Rhadinaphelenchus cocophilus (Cobb) Goodey là dịch hại kiểm dịch thực vật nhóm I của Việt Nam
- Trứng: Hình bầu dục, dài.
- Ấu trùng: Hình giun, đầu cao, dạng vòm, không phân chia với phần thân. Đuôi ấu trùng tuổi 2 và 3 hình nón, mút đuôi dạng mấu nhọn sắc. Ấu trùng tuổi 4 có đuôi khác nhau giữa cá thể đực và cái (dạng lưỡng hình): ở ấu trùng cái, mút đuôi tròn, trong khi ở ấu trùng đực mút đuôi nhọn sắc.
- Con cái: L= 0,97 - 1,18 mm, a=78-96; b=8,7, c=9,5 - 13,2, V=64 - 68%, kim hút=10-13mm .
- Con đực: L=0,84-1,16 mm, a=100-179, b= 6,5, c=24-35, T=50-68%, kim hút= 15,3 (10,7-13,8) mm.
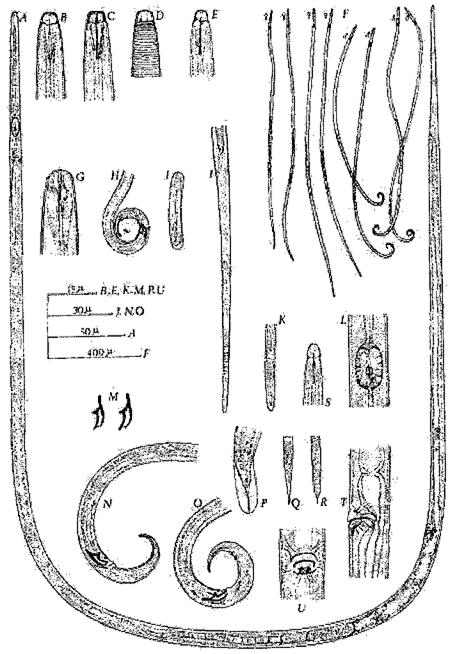
Hình 1. Tuyến trùng Rhadinaphelenchus cocophilus (Cobb) Goodey
A,F: Tuyến trùng trưởng thành; B-D,G: đầu con cái; E: đầu con đực;
H,N,O: đuôi con đực; I: trứng; J: đuôi con cái; K: mút đuôi con cái;
L: diều giữa con cái; M: gai giao vĩ; P: vây đuôi nhìn từ mặt lưng;
Q,R: mút đuôi ấu trùng; S: đầu ấu trùng; T: Lỗ sinh dục nhìn từ mặt bên;
U: Lỗ sinh dục nhìn từ mặt bụng
(Nguồn: Brathwaite C.W.D. và Siddiqi M.R., 1975)
Trong đó:
L: Tổng chiều dài cơ thể
a: Chiều dài cơ thể/chiều rộng lớn nhất (thường là vị trí vulva)
b: Chiều dài cơ thể/chiều dài từ đỉnh đầu cơ thể đến van ruột-thực quản
c: Chiều dài cơ thể/chiều dài đuôi
V: Chiều dài cơ thể từ đỉnh đến vulva x 100/chiều dài cơ thể
T: Chiều dài từ lỗ huyệt đến đỉnh của tinh hoàn x 100/chiều dài cơ thể
Phụ lục 2.
(quy định)
Mẫu phiếu kết quả giám định
|
Cơ quan Bảo vệ |
CỘNG HÒA XÃ
HỘI CHỦ NGHĨA VIỆT NAM |
|
|
……….. ngày …. tháng …. năm 20….. |
PHIẾU KẾT QUẢ GIÁM ĐỊNH
Tuyến trùng Rhadinaphelenchus cocophilus (Cobb) Goodey là dịch hại kiểm dịch thực vật của Việt Nam
|
1. Tên hàng hóa |
: |
|
|
2. Nước xuất khẩu |
: |
|
|
3. Xuất xứ |
: |
|
|
4. Phương tiện vận chuyển |
: |
Khối lượng: |
|
5. Địa điểm lấy mẫu |
: |
|
|
6. Ngày lấy mẫu |
: |
|
|
7. Người lấy mẫu |
: |
|
|
8. Tình trạng mẫu |
: |
|
|
9. Ký hiệu mẫu |
: |
|
|
10. Số mẫu lưu |
: |
|
|
11. Người giám định |
: |
|
Phương pháp giám định: Theo quy chuẩn kỹ thuật quốc gia QCVN 01 - 180 : 2014/BNNPTNT về "Quy trình giám định tuyến trùng thối thân, rễ cọ dầu, dừa Rhadinaphelenchus cocophilus (Cobb) Goodey là dịch hại kiểm dịch thực vật của Việt Nam"
12. Kết quả giám định
Tên khoa học:
Bộ: Aphelenchida
Bộ phụ: Aphelenchina
Họ: Aphelenchoididae
Giống: Rhadinaphelenchus
Loài: R. cocophilus
Là dịch hại kiểm dịch thực vật thuộc danh mục dịch hại kiểm dịch thực vật của Việt Nam.
|
TRƯỞNG PHÒNG KỸ
THUẬT |
THỦ TRƯỞNG ĐƠN VỊ |
National technical regulation on Procedure for identification of Potato wart disease (Synchytrium endobioticum (Schilb) Percival)-Plant quarantine pest of Vietnam
Lời nói đầu
QCVN 01 - 181 : 2014/BNNPTNT do Trung tâm Giám định Kiểm dịch thực vật biên soạn, Cục Bảo vệ thực vật trình duyệt, Bộ Nông nghiệp & PTNT ban hành tại Thông tư số 16/TT-BNNPTNT ngày 05 tháng 6 năm 2014.
QUY CHUẨN KỸ THUẬT QUỐC GIA VỀ QUY TRÌNH GIÁM ĐỊNH BỆNH UNG THƯ KHOAI TÂY SYNCHYTRIUM ENDOBIOTICUM (SCHILB) PERCIVAL LÀ DỊCH HẠI KIỂM DỊCH THỰC VẬT CỦA VIỆT NAM
National technical regulation on Procedure for identification of Potato wart disease (Synchytrium endobioticum (Schilb) Percival)-Plant quarantine pest of Vietnam
I. QUY ĐỊNH CHUNG
1.1. Phạm vi điều chỉnh
Quy chuẩn này quy định quy trình giám định bệnh ung thư khoai tây (Synchytrium endobioticum (Schilb) Percival) là dịch hại kiểm dịch thực vật nhóm I của Việt Nam
1.2. Đối tượng áp dụng
Quy chuẩn này áp dụng đối với các tổ chức, cá nhân Việt Nam hoặc nước ngoài có hoạt động liên quan đến lĩnh vực bảo vệ và kiểm dịch thực vật thực hiện giám định bệnh ung thư khoai tây (Synchytrium endobioticum (Schilb) Percival- là dịch hại kiểm dịch thực vật (KDTV) nhóm I thuộc Danh mục dịch hại KDTV của Việt Nam ban hành kèm theo Quyết định số 73/2005/QĐ-BNN ngày 14/11/2005 của Bộ trưởng Bộ Nông nghiệp và PTNT.
1.3. Giải thích từ ngữ
Trong quy chuẩn này, các từ ngữ dưới đây được hiểu như sau:
1.3.1. Dịch hại kiểm dịch thực vật (plant quarantine pest)
Là loài dịch hại có nguy cơ gây hại nghiêm trọng tài nguyên thực vật trong một vùng mà ở đó loài sinh vật này chưa xuất hiện hoặc xuất hiện có phân bố hẹp và phải được kiểm soát chính thức.
1.3.2. Thực vật (plant)
Là cây và những bộ phận của cây còn sống, kể cả hạt giống và sinh chất có khả năng làm giống.
1.3.3. Mẫu (sample)
Là khối lượng thực vật, sản phẩm thực vật hoặc tàn dư của sản phẩm thực vật được lấy ra theo một qui tắc nhất định.
1.3.8. Tiêu bản (specimen)
Là mẫu vật điển hình tiêu biểu của dịch hại được xử lý để dùng cho việc định loại, nghiên cứu, giảng dạy, phổ biến kỹ thuật và trưng bày thành các bộ sưu tập.
II. QUY ĐỊNH KỸ THUẬT
2.1. Phương pháp thu thập và bảo quản mẫu
2.1.1. Thu thập mẫu
Đối với hàng xuất, nhập khẩu, quá cảnh hoặc vận chuyển, bảo quản trong nước: Tiến hành lấy mẫu theo tiêu chuẩn Việt Nam TCVN 4731:891 "Kiểm dịch thực vật - phương pháp lấy mẫu", quy chuẩn kỹ thuật quốc gia QCVN 01-21:2010/BNNPTNT1 "Phương pháp kiểm tra củ, quả xuất nhập khẩu và quá cảnh".
Đối với cây trồng ngoài đồng ruộng: Lấy mẫu theo quy chuẩn kỹ thuật quốc gia QCVN 01-38/2010/BNNPTNT1 "Phương pháp điều tra phát hiện dịch hại cây trồng". Riêng đối với mẫu đất, phải lấy ở độ sâu tối thiểu 50cm.
2.1.2. Bảo quản mẫu
Các bộ phận tươi nghi có triệu chứng bệnh (lá, thân, rễ, củ...) được để trong các túi ni-lông có lỗ thông khí có đính nhãn và bảo quản trong tủ lạnh ở nhiệt độ 3 - 5oC,
Mẫu đất được cho vào túi ni-lông, có lỗ thông khí, có đính nhãn và để ở những nơi thoáng mát hoặc ở nhiệt độ phòng.
Các tiêu bản lam của nấm được dán nhãn, để trong hộp chuyên dụng đựng tiêu bản lam và bảo quản ở nhiệt độ phòng.
2.1.3. Thiết bị dụng cụ, hóa chất
Kính lúp soi nổi có độ phóng đại 10 - 40 lần (10-40x), kính hiển vi có độ phóng đại 40 - 1000 lần
Máy ly tâm, máy lắc, tủ sấy, tủ định ôn, cân điện.
Bộ dao, kim giải phẫu, panh, kéo, dao lam, bộ rây lọc đất
Đèn cồn, đĩa petri, ống hút, lam, lamen, bình tam giác, cốc đong, giấy lọc
Axit lactic 98%, chloroform, CaCI2, lactoglycerol.
2.3. Phương pháp phát hiện và giám định bệnh
2.3.1. Phát hiện và thu thập mẫu bệnh
Trên phần gốc thân: U có màu trắng hoặc xanh lá (nếu lộ sáng) tới màu nâu, khi thành thục các u này chuyển thành màu đen và sau đó bị thối, (hình 1, phụ lục 1)
Trên lá: cuống lá phình to tạo dạng "cánh", (hình 2, phụ lục 1)
Trên củ: Các u sưng lúc đầu có màu trắng tới nâu và sẽ chuyển sang màu đen khi bị thối và sẽ rời ra khỏi củ (hình 3, 4, phụ lục 1) Các u sưng có nhiều hình dạng khác nhau, có thể là hình cầu hay dạng hoa súp lơ, kích thước các u sưng có thể từ 1-8cm nhưng đôi khi có thể to bằng nắm tay. Bệnh gây hại trên mắt củ nhưng nếu bị nặng toàn bộ củ có thể trở thành các khối u sưng. Nếu bệnh nhiễm sớm trong giai đoạn củ mới phát triển củ sẽ bị biến dạng và trở nên xốp hơn. Vào cuối giai đoạn sinh trưởng của củ, các u sưng có thể bị khô hoặc thối hay rời ra khỏi củ vì vậy đôi khi triệu chứng trên củ mới thu hoạch rất khó nhận biết. Trong quá trình bảo quản trong kho các vết bệnh lại phát triển thành u sưng và u sưng có màu tương tự như vỏ củ khoai tây.
Trên rễ củ: Triệu chứng tương tự như trên củ.
Trên rễ tơ: Nấm không gây hại trên rễ tơ của khoai tây nhưng có gây hại trên rễ tơ của một số kí chủ phụ khác như cà chua.
2.3.2. Phương pháp giám định
2.3.2.1. Đối với củ, thân, lá và rễ
Dùng dao lam cắt lát các phần nghi ngờ, độ dày của lát cắt nên nhỏ hơn 1 mm và có độ dài 3mm. Đặt lát cắt thu được lên lam kính, nhỏ một giọt axit lactic lên lát cắt và đậy lamen. Quan sát và đo đếm đặc điểm hình thái của bào tử dưới kính hiển vi ở độ phóng đại 40 lần.
So sánh với đặc điểm hình thái của bào tử đông của nấm Synchytrium endobioticum (hình 5, 6 phụ lục 1)
Chú ý: Nếu lát cắt quá dày sẽ rất khó quan sát cấu trúc của bào tử. Có thể dàn mỏng lát cắt bằng kim khêu nấm trước khi đậy lamen hoặc hơ lam kính lên đèn cồn để loại bỏ bóng khí trong tiêu bản.
2.3.2.2. Đối với mẫu đất
Mẫu đất được để khô tự nhiên. Hòa tan 100 g đất đã khô vào 900ml nước, ngâm trong 24 giờ để đất rã ra hoàn toàn. Đổ hỗn hợp thu được qua bộ sàng 6 rây (kích thước lỗ rây lần lượt là 500, 250, 125, 71, 40 và 25mm). Các hỗn hợp thu được phía trên rây 40 và 25mm được rửa trên giấy lọc. Sau khi rửa sạch và để khô, phần thu được trên giấy lọc sẽ được cho vào ống ly tâm 50ml. Thêm vào ống ly tâm 15ml dịch Chloroform hoặc CaCl2 khuấy đều, ly tâm 3000 vòng/phút trong 15 phút. Thu phần dung dịch và lọc qua giấy lọc. Hòa phần thu được trên giấy lọc vào 1ml lactoglycerol.
Dùng ống hút lấy dung dịch thu được ở trên nhỏ lên lam và kiểm tra dưới kính hiển vi. Quan sát và đo đếm đặc điểm hình thái của bào tử dưới kính hiển vi so sánh với đặc điểm hình thái của bào tử đông của nấm Synchytrium endobioticum (phụ lục 1)
III. THẨM ĐỊNH KẾT QUẢ GIÁM ĐỊNH VÀ BÁO CÁO
Sau khi khẳng định kết quả giám định là bệnh ung thư khoai tây (Synchytrium endobioticum (Schilb) Percival) thuộc danh mục dịch hại KDTV của Việt Nam, đơn vị giám định phải gửi báo cáo về Cục Bảo vệ thực vật kèm theo phiếu kết quả giám định (phụ lục 2).
Tất cả các đơn vị thuộc hệ thống Bảo vệ và KDTV phải lưu giữ, quản lý và khai thác dữ liệu về kết quả điều tra, báo cáo và giám định bệnh ung thư khoai tây (Synchytrium endobioticum (Schilb) Percival).
Đối với đơn vị lần đầu tiên giám định và phát hiện được bệnh ung thư khoai tây (Synchytrium endobioticum (Schilb) Percival) phải gửi mẫu hoặc tiêu bản về Trung tâm Giám định kiểm dịch thực vật để thẩm định và báo cáo Cục Bảo vệ thực vật trước khi công bố và xử lý dịch theo quy định của pháp luật hiện hành.
Đơn vị giám định phải lưu mẫu theo Quy chuẩn kỹ thuật hiện hành về thời gian để giải quyết khiếu nại về kết quả giám định (nếu có).
IV. TỔ CHỨC THỰC HIỆN
Cục Bảo vệ thực vật có trách nhiệm phổ biến; tổ chức, hướng dẫn và kiểm tra việc thực hiện Quy chuẩn này trong hệ thống tổ chức chuyên ngành Bảo vệ và Kiểm dịch thực vật cũng như các tổ chức, cá nhân khác có liên quan;
Các tổ chức, cá nhân có hoạt động liên quan đến điều tra, thu thập mẫu, xử lý và bảo quản mẫu bệnh ung thư khoai tây (Synchytrium endobioticum (Schilb) Percival) tại Việt Nam phải tuân theo quy định của quy chuẩn này cũng như các quy định của pháp luật có liên quan hiện hành.
Phụ lục 1.
Thông tin về dịch hại
1. Phân bố và ký chủ
1.1. Phân bố
Trong nước: Bệnh chưa có ở Việt Nam.
Trên thế giới: Châu Á (Armenia, Bhutan; Trung Quốc, Nepal, Ấn Độ, Thổ Nhĩ Kì), Châu Phi (Tunisia, Algeria; Nam Phi), Châu Mỹ (Canada, Bolivia; Ecuador, Falkland Islands, Peru), Châu Âu (Liên bang Nga; Ba Lan; Thụy Sỹ; Cộng hòa Séc; Siberia, Áo; Belarus; Bulgaria; Phần Lan; Đức; Ireland; Italy; Latvia; Luxembourg; Montenegro; Hà Lan; NaUy; Romania; Slovakia; Slovenia; Thụy Điển; Ukraine; Vương Quốc Anh) và Châu Đại Dương (New Zealand).
1.2. Ký chủ
Khoai tây Solanum tuberosum, cây lu lu đực (nightshade), cà chua. Ngoài ra, trong lây nhiễm nhân tạo nấm còn kí sinh trên một số loại cây như Schizanthus sp., Capsicastrum nanum, Physalis franchetii, Datura sp. và Solanum dulcamara
2. Tên khoa học và vị trí phân loại
Tên tiếng Việt: Bệnh ung thư khoai tây
Tên khoa học: Synchytrium endobioticum (Schilb) Percival.
Tên khác:
Chrysophlyctis endobiotica Schilb.
Synchytrium solani Massee
Vị trí phân loại:
Lớp: Chytridiomycetes.
Bộ: Chytridiales
Họ: Synchytriaceae
3. Triệu chứng của bệnh ung thư khoai tây
|
Hình 1: Triệu chứng bệnh ung thư khoai tây S. endobioticum trên đồng ruộng (Nguồn: Hans Stachewicz) |
Hình 2: Triệu chứng bệnh ung thư khoai tây S. endobioticum trên lá (Nguồn: Hans Stachewicz) |
|
|
|
|
Hình 3: U sưng do nấm S. endobioticum dưới mặt đất giai đoạn chưa thành thục (Nguồn: Plant Health & Environment Lab) |
Hình 4: U sưng do nấm S. endobioticum trên củ đã thành thục (Nguồn: Defra) |
4. Đặc điểm hình thái bào tử nấm Synchytrium endobioticum
Bào tử đông có vách dày màu vàng nâu ở trong mô cây. Bào tử gần như chiếm hết tế bào kí chủ. Bào tử có 3 lớp vách, vách dày bên ngoài của bào tử có dạng nhăn (nếu nhìn trên bề mặt), có độ dày không đồng đều và có các đỉnh góc cạnh khá rõ ràng. Bào tử đông có đường kính từ 25-75mm (trung bình là 50mm). Các góc cạnh rõ ràng ở vách ngoài là đặc điểm chính để giám định nấm Synchytrium endobioticum phân biệt bào tử nấm với các cấu trúc hoặc vi sinh vật khác nằm trong u sưng hoặc trong đất.
Bào tử mùa hè có kích thước tương tự như bào tử đông nhưng trong suốt và có vách ngăn mỏng. Các bào tử này thường không xuất hiện ở các u trưởng thành. Chúng không có các đỉnh góc cạnh đặc trưng như bào tử đông và loại bào tử này không sử dụng để giám định bằng hình thái.

|
Hình 5: Bào tử đông S.endobioticum (Nguồn: EPPO, 2012) |
Hình 6: Bào tử đông S.endobioticum bất hoạt (Nguồn: EPPO, 2012) |
5. Phân biệt giữa nấm Synchytrium endobioticum và một số loại nấm giống Synchytrium hoặc nấm khác có biểu hiện triệu chứng bệnh tương tự
Một số loại Synchytrium kí sinh trên cỏ có thể có mặt trong đất trồng khoai tây nhưng ít khi xuất hiện trên các u sưng. Những loài này cấu tạo bào tử không có các đỉnh góc cạnh như bào tử đông của Synchytrium endobioticum.
Bệnh ghẻ bột khoai tây (Spongospora subterranea) gây triệu chứng các vết ghẻ không có hình dạng nhất định trên củ khoai tây (hình 7). Kiểm tra dưới kính hiển vi các khối bào tử (spore balls) của nấm S. subterranea có dạng trứng, bất định hoặc thuôn dài, có dạng xốp. Khối bào tử có chứa các bào tử riêng lẻ co cụm sát vào nhau (hình 8)

|
Hình 7: Vết bệnh ghẻ bột khoai tây (Nguồn: USDA, 2012) |
Hình 8: Bào tử S. subterranea (40X) (Nguồn: Lucid, 2010) |
Bệnh than đen khoai tây (Thecaphora solani): bệnh cũng gây các khối u sùi trên củ nhưng các u sưng này chứa những bào tử màu đen. (hình 9, 10)

|
Hình 9: Triệu chứng bện than đen khoai tây (T. solani) (Nguồn: USDA, 2012) |
Hình 10: Bào tử nấm bệnh than đen khoai tây (T. solani) (Nguồn: USDA, 2012) |
Phụ lục 2.
(quy định)
Mẫu phiếu kết quả giám định
|
Cơ quan Bảo vệ |
CỘNG HÒA XÃ
HỘI CHỦ NGHĨA VIỆT NAM |
|
|
……….. ngày …. tháng …. năm 20….. |
PHIẾU KẾT QUẢ GIÁM ĐỊNH
Bệnh ung thư khoai tây Synchytrium endobioticum (Schilb) Percival. là dịch hại kiểm dịch thực vật của Việt Nam
|
1. Tên hàng hóa |
: |
|
|
2. Nước xuất khẩu |
: |
|
|
3. Xuất xứ |
: |
|
|
4. Phương tiện vận chuyển |
: |
Khối lượng: |
|
5. Địa điểm lấy mẫu |
: |
|
|
6. Ngày lấy mẫu |
: |
|
|
7. Người lấy mẫu |
: |
|
|
8. Tình trạng mẫu |
: |
|
|
9. Ký hiệu mẫu |
: |
|
|
10. Số mẫu lưu |
: |
|
|
11. Người giám định |
: |
|
12. Phương pháp giám định: Theo quy chuẩn kỹ thuật quốc gia QCVN 01 - 181 : 2014/BNNPTNT về "Quy trình giám định bệnh ung thư khoai tây Synchytrium endobioticum (Schilb) Percival - là dịch hại kiểm dịch thực vật của Việt Nam".
13. Kết quả giám định
Tên khoa học: Synchytrium endobioticum (Schilb) Percival.
Lớp: Chytridiomycetes.
Bộ: Chytridiales
Họ: Synchytriaceae
Là dịch hại kiểm dịch thực vật thuộc danh mục dịch hại kiểm dịch thực vật của Việt Nam.
|
TRƯỞNG PHÒNG KỸ
THUẬT |
THỦ TRƯỞNG ĐƠN VỊ |
1 Trường hợp các văn bản viện dẫn trong quy chuẩn này sửa đổi, bổ sung hoặc thay thế thì thực hiện theo quy định của văn bản mới.
1 Trường hợp các văn bản viện dẫn trong quy chuẩn này sửa đổi, bổ sung hoặc thay thế thì thực hiện theo quy định của văn bản mới. A
1 Trường hợp các văn bản viện dẫn trong quy chuẩn này sửa đổi, bổ sung hoặc thay thế thì thực hiện theo quy định của văn bản mới.
1 Trường hợp các văn bản viện dẫn trong quy chuẩn này sửa đổi, bổ sung hoặc thay thế thì thực hiện theo quy định của văn bản mới.
1 Trường hợp các văn bản viện dẫn trong quy chuẩn này sửa đổi, bổ sung hoặc thay thế thì thực hiện theo quy định của văn bản mới.
1 Trường hợp các văn bản viện dẫn trong quy chuẩn này sửa đổi, bổ sung hoặc thay thế thì thực hiện theo quy định của văn bản mới.
1 Trường hợp các văn bản viện dẫn trong quy chuẩn này sửa đổi, bổ sung hoặc thay thế thì thực hiện theo quy định của văn bản mới
2 Trường hợp các văn bản viện dẫn trong quy chuẩn này sửa đổi, bổ sung hoặc thay thế thì thực hiện theo quy định của văn bản mới
1 Trường hợp các văn bản viện dẫn trong quy chuẩn này sửa đổi, bổ sung hoặc thay thế thì thực hiện theo quy định của văn bản mới.
1 Trường hợp các văn bản viện dẫn trong quy chuẩn này sửa đổi, bổ sung hoặc thay thế thì thực hiện theo quy định của văn bản mới.
1 Trường hợp các văn bản viện dẫn trong quy chuẩn này sửa đổi, bổ sung hoặc thay thế thì thực hiện theo quy định của văn bản mới.
1 Trường hợp các văn bản viện dẫn trong quy chuẩn này sửa đổi, bổ sung hoặc thay thế thì thực hiện theo quy định của văn bản mới.
(Không có nội dung)
Vì chưa Đăng Nhập nên Bạn chỉ xem được Thuộc tính của Văn bản. Bạn chưa xem được Hiệu lực của Văn bản, Văn bản Liên quan, Văn bản thay thế, Văn bản gốc, Văn bản tiếng Anh,...
Nếu chưa có Tài khoản, mời Bạn Đăng ký Tài khoản tại đây
(Không có nội dung)
Vì chưa Đăng Nhập nên Bạn chỉ xem được Thuộc tính của Văn bản. Bạn chưa xem được Hiệu lực của Văn bản, Văn bản Liên quan, Văn bản thay thế, Văn bản gốc, Văn bản tiếng Anh,...
Nếu chưa có Tài khoản, mời Bạn Đăng ký Tài khoản tại đây
Vì chưa Đăng Nhập nên Bạn chỉ xem được Thuộc tính của Văn bản. Bạn chưa xem được Hiệu lực của Văn bản, Văn bản Liên quan, Văn bản thay thế, Văn bản gốc, Văn bản tiếng Anh,...
Nếu chưa có Tài khoản, mời Bạn Đăng ký Tài khoản tại đây
-
Ban hành: {{m.News_Dates_Date}} Hiệu lực: {{m.News_EffectDate_Date}} Tình trạng: {{m.TinhTrang}} Cập nhật: {{m.Email_SendDate_Date}} Ban hành: {{m.News_Dates_Date}}Hiệu lực: {{m.News_EffectDate_Date}}Tình trạng: {{m.TinhTrang}}Cập nhật: {{m.Email_SendDate_Date}}
Vì chưa Đăng Nhập nên Bạn chỉ xem được Thuộc tính của Văn bản. Bạn chưa xem được Hiệu lực của Văn bản, Văn bản Liên quan, Văn bản thay thế, Văn bản gốc, Văn bản tiếng Anh,...
Nếu chưa có Tài khoản, mời Bạn Đăng ký Tài khoản tại đây
-
Ban hành: {{m.News_Dates_Date}} Hiệu lực: {{m.News_EffectDate_Date}} Tình trạng: {{m.TinhTrang}} Cập nhật: {{m.Email_SendDate_Date}} Ban hành: {{m.News_Dates_Date}}Hiệu lực: {{m.News_EffectDate_Date}}Tình trạng: {{m.TinhTrang}}Cập nhật: {{m.Email_SendDate_Date}}
Vì chưa Đăng Nhập nên Bạn chỉ xem được Thuộc tính của Văn bản. Bạn chưa xem được Hiệu lực của Văn bản, Văn bản Liên quan, Văn bản thay thế, Văn bản gốc, Văn bản tiếng Anh,...
Nếu chưa có Tài khoản, mời Bạn Đăng ký Tài khoản tại đây
Vì chưa Đăng Nhập nên Bạn chỉ xem được Thuộc tính của Văn bản. Bạn chưa xem được Hiệu lực của Văn bản, Văn bản Liên quan, Văn bản thay thế, Văn bản gốc, Văn bản tiếng Anh,...
Nếu chưa có Tài khoản, mời Bạn Đăng ký Tài khoản tại đây