Công văn 2963/QLD-CL năm 2024 về Thuốc giả Cefixim 200 do Cục Quản lý Dược ban hành
Công văn 2963/QLD-CL năm 2024 về Thuốc giả Cefixim 200 do Cục Quản lý Dược ban hành
| Số hiệu: | 2963/QLD-CL | Loại văn bản: | Công văn |
| Nơi ban hành: | Cục Quản lý dược | Người ký: | Tạ Mạnh Hùng |
| Ngày ban hành: | 29/08/2024 | Ngày hiệu lực: | Đã biết |
| Ngày công báo: | Đang cập nhật | Số công báo: | Đang cập nhật |
| Tình trạng: | Đã biết |
| Số hiệu: | 2963/QLD-CL |
| Loại văn bản: | Công văn |
| Nơi ban hành: | Cục Quản lý dược |
| Người ký: | Tạ Mạnh Hùng |
| Ngày ban hành: | 29/08/2024 |
| Ngày hiệu lực: | Đã biết |
| Ngày công báo: | Đang cập nhật |
| Số công báo: | Đang cập nhật |
| Tình trạng: | Đã biết |
|
BỘ Y TẾ |
CỘNG HÒA
XÃ HỘI CHỦ NGHĨA VIỆT NAM |
|
Số:
2963/QLD-CL |
Hà Nội, ngày 29 tháng 08 năm 2024 |
Kính gửi: Sở Y tế các tỉnh, thành phố trực thuộc Trung ương
Căn cứ công văn số 110/CV-TTKN đề ngày 28/8/2024 của Trung tâm kiểm nghiệm tỉnh Bình Dương, báo cáo về việc mẫu sản phẩm có thông tin ghi trên nhãn: Viên nén bao phim CEFIXIM 200; số GĐKLH: VD-28887-18; số lô: 30201123, NSX: 201123, HD: 201125, nơi sản xuất: Công ty cổ phần Dược phẩm Cửu Long, mẫu thuốc do Trung tâm kiểm nghiệm tỉnh Bình Dương lấy tại Nhà thuốc tây Bích Ngọc 1 (địa chỉ: 395/14 Hai Bà Trưng, phường Đông Hòa, Tp. Dĩ An, tỉnh Bình Dương). Mẫu thuốc trên không đạt yêu cầu chất lượng về chỉ tiêu Định tính cefixim theo TCCS;
Căn cứ công văn số 284/DCL đề ngày 23/7/2024 của Công ty cổ phần dược Cửu Long, báo cáo việc sản xuất các lô thuốc Cefixim 200 và dấu hiệu khác biệt giữa mẫu thuốc lưu tại Công ty và mẫu thuốc do Trung tâm Kiểm nghiệm tỉnh Thanh Hóa thu được trên thị trường.
Sau khi đối chiếu, xem xét, để đảm bảo an toàn cho người sử dụng, tiếp theo các công văn số 2611/QLD-CL ngày 26/7/2024 và công văn số 2621/QLD- CL ngày 30/7/2024 của Cục Quản lý Dược về việc thuốc CEFIXIM 200 giả, Cục Quản lý Dược đề nghị Sở Y tế các tỉnh, thành phố trực thuộc Trung ương, Y tế các ngành:
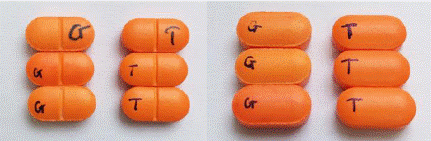
1. Thông báo cho các cơ sở kinh doanh, sử dụng thuốc thông tin về thuốc giả trên nhãn ghi: Viên nén bao phim CEFIXIM 200, số GĐKLH: VD-28887-18; số lô: 30201123, NSX: 201123, HD: 201125; Cơ sở sản xuất: Công ty cổ phần Dược phẩm Cửu Long có các đặc điểm, dấu hiệu phân biệt với thuốc thật như sau:
|
STT |
DẤU HIỆU NHẬN DẠNG |
THUỐC THẬT |
THUỐC GIẢ |
|
1 |
Chi tiết in trên hộp |
Hộp THẬT sau chữ “q.s.f” CÓ khoảng trắng
|
Hộp GIẢ sau chữ “q.s.f” KHÔNG có khoảng trắng
|
|
2 |
Hình thúc viên |
Thuốc THẬT các viên đều màu, cạnh và mặt viên không sức mẻ |
Thuốc GIẢ cạnh viên sức mẻ nhiều, lớp bao mỏng, màu sắc các viên trong cùng 1 vỉ không đồng nhất, có lốm đốm màu. |
|
Ghi chú: G: thuốc giả T: thuốc thật |
|||
2. Tiếp tục triển khai thực hiện nghiêm Chỉ thị 17/CT-TTg ngày 19/6/2018 của Thủ tướng Chính phủ về tăng cường đấu tranh chống buôn lậu, gian lận thương mại, sản xuất, kinh doanh hàng giả, hàng kém chất lượng thuộc nhóm hàng dược phẩm, mỹ phẩm, thực phẩm chức năng, dược liệu và vị thuốc y học cổ truyền; Thực hiện nghiêm các chỉ đạo tại Công văn số 7173/BYT-QLD ngày 12/12/2022 của Bộ Y tế về việc tăng cường quản lý, kiểm tra chất lượng thuốc, đấu tranh chống thuốc giả, thuốc không rõ nguồn gốc xuất xứ.
3. Phối hợp với các cơ quan truyền thông, thông tin tới các cơ sở buôn bán, sử dụng thuốc và người dân biết để không buôn bán, sử dụng sản phẩm CEFIXIM 200 giả có các dấu hiệu nhận biết nêu trên; Chỉ mua bán thuốc tại các cơ sở kinh doanh dược hợp pháp; không mua bán thuốc không rõ nguồn gốc; kịp thời thông báo các dấu hiệu nghi ngờ về sản xuất, kinh doanh thuốc giả, thuốc không rõ nguồn gốc tới cơ quan y tế và cơ quan có chức năng liên quan.
4. Phối hợp với cơ quan công an, quản lý thị trường, Ban chỉ đạo 389 và các cơ quan chức năng liên quan tiến hành kiểm tra các cơ sở kinh doanh thuốc trên địa bàn; điều tra, xác minh thông tin và truy tìm nguồn gốc về sản phẩm CEFIXIME 200 giả nêu trên, xử lý các tổ chức, cá nhân vi phạm theo quy định hiện hành; kịp thời phát hiện và ngăn chặn việc sản xuất, buôn bán và sử dụng thuốc CEFIXIM 200 giả.
5. Chỉ đạo Trung tâm kiểm nghiệm tăng cường lấy mẫu, kiểm tra chất lượng thuốc lưu hành trên địa bàn đối với các thuốc có nguy cơ bị làm giả hoặc kém chất lượng; báo cáo kịp thời các vụ việc phát hiện tới Sở Y tế và cơ quan chức năng liên quan.
6. Thiết lập đường dây nóng, tiếp nhận các thông tin về thuốc giả, thuốc nhập lậu, thuốc không rõ nguồn gốc xuất xứ trên địa bàn để kịp thời phối hợp với các cơ quan chức năng xác minh, xử lý.
Báo cáo kết quả kiểm tra, xử lý vi phạm và nguồn gốc lô thuốc giả về Cục Quản lý Dược.
Cục Quản lý Dược thông báo để các Sở Y tế biết và thực hiện ./.
|
|
KT. CỤC
TRƯỞNG |
(Không có nội dung)
Vì chưa Đăng Nhập nên Bạn chỉ xem được Thuộc tính của Văn bản. Bạn chưa xem được Hiệu lực của Văn bản, Văn bản Liên quan, Văn bản thay thế, Văn bản gốc, Văn bản tiếng Anh,...
Nếu chưa có Tài khoản, mời Bạn Đăng ký Tài khoản tại đây
(Không có nội dung)
Vì chưa Đăng Nhập nên Bạn chỉ xem được Thuộc tính của Văn bản. Bạn chưa xem được Hiệu lực của Văn bản, Văn bản Liên quan, Văn bản thay thế, Văn bản gốc, Văn bản tiếng Anh,...
Nếu chưa có Tài khoản, mời Bạn Đăng ký Tài khoản tại đây
Vì chưa Đăng Nhập nên Bạn chỉ xem được Thuộc tính của Văn bản. Bạn chưa xem được Hiệu lực của Văn bản, Văn bản Liên quan, Văn bản thay thế, Văn bản gốc, Văn bản tiếng Anh,...
Nếu chưa có Tài khoản, mời Bạn Đăng ký Tài khoản tại đây
-
Ban hành: {{m.News_Dates_Date}} Hiệu lực: {{m.News_EffectDate_Date}} Tình trạng: {{m.TinhTrang}} Cập nhật: {{m.Email_SendDate_Date}} Ban hành: {{m.News_Dates_Date}}Hiệu lực: {{m.News_EffectDate_Date}}Tình trạng: {{m.TinhTrang}}Cập nhật: {{m.Email_SendDate_Date}}
Vì chưa Đăng Nhập nên Bạn chỉ xem được Thuộc tính của Văn bản. Bạn chưa xem được Hiệu lực của Văn bản, Văn bản Liên quan, Văn bản thay thế, Văn bản gốc, Văn bản tiếng Anh,...
Nếu chưa có Tài khoản, mời Bạn Đăng ký Tài khoản tại đây
-
Ban hành: {{m.News_Dates_Date}} Hiệu lực: {{m.News_EffectDate_Date}} Tình trạng: {{m.TinhTrang}} Cập nhật: {{m.Email_SendDate_Date}} Ban hành: {{m.News_Dates_Date}}Hiệu lực: {{m.News_EffectDate_Date}}Tình trạng: {{m.TinhTrang}}Cập nhật: {{m.Email_SendDate_Date}}
Vì chưa Đăng Nhập nên Bạn chỉ xem được Thuộc tính của Văn bản. Bạn chưa xem được Hiệu lực của Văn bản, Văn bản Liên quan, Văn bản thay thế, Văn bản gốc, Văn bản tiếng Anh,...
Nếu chưa có Tài khoản, mời Bạn Đăng ký Tài khoản tại đây
Vì chưa Đăng Nhập nên Bạn chỉ xem được Thuộc tính của Văn bản. Bạn chưa xem được Hiệu lực của Văn bản, Văn bản Liên quan, Văn bản thay thế, Văn bản gốc, Văn bản tiếng Anh,...
Nếu chưa có Tài khoản, mời Bạn Đăng ký Tài khoản tại đây