Công văn 9958/QLD-CL năm 2023 về kiểm tra việc lưu hành thuốc giả Tobramycin do Cục Quản lý Dược ban hành
Công văn 9958/QLD-CL năm 2023 về kiểm tra việc lưu hành thuốc giả Tobramycin do Cục Quản lý Dược ban hành
| Số hiệu: | 9958/QLD-CL | Loại văn bản: | Công văn |
| Nơi ban hành: | Cục Quản lý dược | Người ký: | Tạ Mạnh Hùng |
| Ngày ban hành: | 31/10/2023 | Ngày hiệu lực: | Đã biết |
| Ngày công báo: | Đang cập nhật | Số công báo: | Đang cập nhật |
| Tình trạng: | Đã biết |
| Số hiệu: | 9958/QLD-CL |
| Loại văn bản: | Công văn |
| Nơi ban hành: | Cục Quản lý dược |
| Người ký: | Tạ Mạnh Hùng |
| Ngày ban hành: | 31/10/2023 |
| Ngày hiệu lực: | Đã biết |
| Ngày công báo: | Đang cập nhật |
| Số công báo: | Đang cập nhật |
| Tình trạng: | Đã biết |

|
BỘ Y TẾ |
CỘNG HÒA XÃ HỘI CHỦ
NGHĨA VIỆT NAM |
|
Số:
9958/QLD-CL |
Hà Nội, ngày 31 tháng 10 năm 2023 |
|
Kính gửi: |
- Sở Y tế các tỉnh,
thành phố trực thuộc Trung ương |
Cục Quản lý Dược nhận được các văn bản:
- Số 1022/CV-DHT đề ngày 18/10/2023 của Công ty cổ phần Dược phẩm Hà Tây về việc báo cáo thuốc giả Tobramycin.
- Số 1046/CV-DHT đề ngày 27/10/2023 của Công ty cổ phần Dược phẩm Hà Tây về việc bổ sung, điều chỉnh thông tin của CV số 1022/CV-DHT.
Theo đó, Công ty đã tiến hành lấy mẫu tại chợ thuốc sỉ khu vực Quận 10 thành phố Hồ Chí Minh và kiểm tra chất lượng 01 lô thuốc nhỏ mắt Tobramycin trên nhãn ghi số lô 051023, NSX: 051023, HD: 051025. Công ty đã kiểm tra mẫu thuốc nêu trên không đạt tiêu chuẩn chất lượng về các chỉ tiêu Định tính, Định lượng (không chứa hoạt chất Tobramycin). Công ty cũng đối chiếu mẫu nhãn giữa thuốc thật Tobramycin do Công ty sản xuất và sản phẩm có bao bì tương tự đang lưu hành trên thị trường và báo cáo một số đặc điểm, dấu hiệu phân biệt (phụ lục đính kèm).
Xét thấy đây là trường hợp phản ánh thuốc giả thuốc nhỏ mắt Tobramycin do Công ty Cổ phần Dược phẩm Hà Tây sản xuất có nguy cơ gây tổn hại nghiêm trọng đối với sức khỏe người sử dụng, để đảm bảo an toàn cho người sử dụng, Cục Quản lý Dược có ý kiến như sau:
1. Sở Y tế các tỉnh, thành phố trực thuộc Trung ương:
- Thông báo cho các cơ sở kinh doanh, sử dụng thuốc không được buôn bán sử dụng lô thuốc nhỏ mắt Tobramycin trên nhãn ghi số lô 051023, NSX: 051023, HD: 051025 có dấu hiệu vi phạm nêu trên. Trường hợp đang kinh doanh lô thuốc nói trên, đề nghị ngừng kinh doanh và thông báo cho cơ quan chức năng biết, phối hợp xử lý lô thuốc trên theo quy định;
- Chỉ đạo Trung tâm Kiểm nghiệm trực thuộc tăng cường rà soát, kiểm tra lấy mẫu thuốc nhỏ mắt chứa Tobramycin. Trường hợp phát hiện lô thuốc nhỏ mắt Tobramycin trên nhãn ghi số lô 051023, NSX: 051023, HD: 051025 nêu trên, khẩn trương kiểm tra chất lượng và báo cáo kịp thời để xử lý theo quy định.
- Kiểm tra và giám sát các đơn vị thực hiện thông báo này; xử lý những đơn vị vi phạm theo quy định hiện hành;
- Phối hợp với các cơ quan chức năng liên quan tăng cường kiểm tra, giám sát xác minh nguồn gốc hóa đơn chứng từ mua bán lô thuốc trên, kịp thời phát hiện việc sản xuất, buôn bán và sử dụng lô thuốc nhỏ mắt Tobramycin trên nhãn ghi số lô 051023, NSX: 051023, HD: 051025 có dấu hiệu vi phạm nêu trên;
- Báo cáo kết quả kiểm tra, thanh tra về Cục Quản lý Dược và các cơ quan chức năng có liên quan.
Cục Quản lý Dược thông báo để các đơn vị biết và thực hiện./.
|
|
KT. CỤC TRƯỞNG |
ĐẶC ĐIỂM, DẤU HIỆU PHÂN BIỆT GIỮA THUỐC GIẢ
VÀ THUỐC THẬT DO CÔNG TY CỔ PHẦN DƯỢC PHẨM HÀ TÂY CUNG CẤP
(Kèm Công văn số 9958/QLD-CL ngày 31 tháng 10 năm 2023 của Cục Quản
lý Dược)
|
STT |
Tiêu chí |
Sản phẩm thật của DHT |
Sản phẩm giả |
|
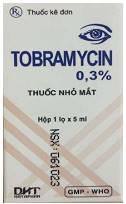
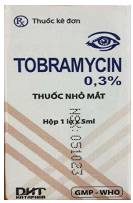
1 |
Hộp đựng thuốc |
NSX: 061023
|
NSX: 051023
|
|
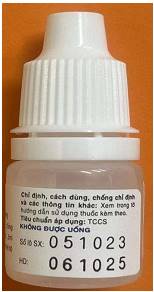
2 |
Nhãn dán lọ |
LSX: 051023 HD: 061025
|
LSX: 051023 HD: 051025
|
|
- Sau dòng “Xem tờ hướng dẫn sử dụng thuốc kèm theo” có dấu chấm “.” - Tên cơ sở sản xuất không in đậm. - Sau “P. La khê” có dấu phẩy “,” - Có các dấu cách giữa SĐK. - Đường gạch ngang dưới tên cơ sở sản xuất bắt đầu ở cuối chữ “C” và kết thúc ở đầu chữ “Y”. |
- Sau dòng “Xem tờ hướng dẫn sử dụng thuốc kèm theo” không có dấu chấm “.” - Tên cơ sở sản xuất in đậm. - Sau “P. La khê” không có dấu phẩy “,” - Không có dấu cách giữa SĐK. - Đường gạch ngang dưới tên cơ sở sản xuất bắt đầu ở đầu chữ “C” và kết thúc ở cuối chữ “Y”. |
||
|
|
|
||
|
- Sau dòng “Nơi khô, nhiệt độ dưới 30°C” có dấu chấm “.” - Mã vạch: Khoảng cách giữa các chữ số đều nhau. -
|
- Sau dòng “Nơi khô, nhiệt độ dưới 30°C” không có dấu chấm “.” - Mã vạch: Khoảng cách giữa các chữ số không đều nhau. -
|
||
|
Kích thước: 16x60mm |
Kích thước: 15x60mm |
||
|
- Số lô SX:051023 HD: 061025 “Số lô SX:, HD:” không in đậm. - Chữ “TCCS” không in đậm. - Chữ “Xem trong tờ hướng dẫn sử dụng thuốc kèm theo” không in đậm.
|
- Số lô SX: 051023 HD: 051025 Chữ “Số lô SX:, HD:” in đậm. - Chữ “TCCS” in đậm. - Chữ “Xem trong tờ hướng dẫn sử dụng thuốc kèm theo” in đậm.
|
||
|
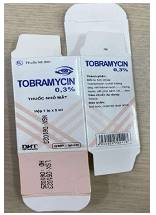
3 |
Lọ đựng thuốc |
Chiều cao lọ: 52mm |
Chiều cao lọ: 55mm |
|
Đáy lọ có chữ
HATAPHAR cùng biểu tượng |
Đáy lọ có chữ VT |
||
|
|
|
(Không có nội dung)
Vì chưa Đăng Nhập nên Bạn chỉ xem được Thuộc tính của Văn bản. Bạn chưa xem được Hiệu lực của Văn bản, Văn bản Liên quan, Văn bản thay thế, Văn bản gốc, Văn bản tiếng Anh,...
Nếu chưa có Tài khoản, mời Bạn Đăng ký Tài khoản tại đây
(Không có nội dung)
Vì chưa Đăng Nhập nên Bạn chỉ xem được Thuộc tính của Văn bản. Bạn chưa xem được Hiệu lực của Văn bản, Văn bản Liên quan, Văn bản thay thế, Văn bản gốc, Văn bản tiếng Anh,...
Nếu chưa có Tài khoản, mời Bạn Đăng ký Tài khoản tại đây
Vì chưa Đăng Nhập nên Bạn chỉ xem được Thuộc tính của Văn bản. Bạn chưa xem được Hiệu lực của Văn bản, Văn bản Liên quan, Văn bản thay thế, Văn bản gốc, Văn bản tiếng Anh,...
Nếu chưa có Tài khoản, mời Bạn Đăng ký Tài khoản tại đây
Vì chưa Đăng Nhập nên Bạn chỉ xem được Thuộc tính của Văn bản. Bạn chưa xem được Hiệu lực của Văn bản, Văn bản Liên quan, Văn bản thay thế, Văn bản gốc, Văn bản tiếng Anh,...
Nếu chưa có Tài khoản, mời Bạn Đăng ký Tài khoản tại đây
Vì chưa Đăng Nhập nên Bạn chỉ xem được Thuộc tính của Văn bản. Bạn chưa xem được Hiệu lực của Văn bản, Văn bản Liên quan, Văn bản thay thế, Văn bản gốc, Văn bản tiếng Anh,...
Nếu chưa có Tài khoản, mời Bạn Đăng ký Tài khoản tại đây
Vì chưa Đăng Nhập nên Bạn chỉ xem được Thuộc tính của Văn bản. Bạn chưa xem được Hiệu lực của Văn bản, Văn bản Liên quan, Văn bản thay thế, Văn bản gốc, Văn bản tiếng Anh,...
Nếu chưa có Tài khoản, mời Bạn Đăng ký Tài khoản tại đây