Quy chuẩn kỹ thuật quốc gia QCVN 4-31:2020/BYT về Phụ gia thực phẩm muối aspartam-acesulfam
Quy chuẩn kỹ thuật quốc gia QCVN 4-31:2020/BYT về Phụ gia thực phẩm muối aspartam-acesulfam
| Số hiệu: | QCVN4-31:2020/BYT | Loại văn bản: | Quy chuẩn |
| Nơi ban hành: | Bộ Y tế | Người ký: | *** |
| Ngày ban hành: | 31/12/2020 | Ngày hiệu lực: | Đã biết |
| Ngày công báo: | Đang cập nhật | Số công báo: | Đang cập nhật |
| Tình trạng: | Đã biết |
| Số hiệu: | QCVN4-31:2020/BYT |
| Loại văn bản: | Quy chuẩn |
| Nơi ban hành: | Bộ Y tế |
| Người ký: | *** |
| Ngày ban hành: | 31/12/2020 |
| Ngày hiệu lực: | Đã biết |
| Ngày công báo: | Đang cập nhật |
| Số công báo: | Đang cập nhật |
| Tình trạng: | Đã biết |
|
1. Tên khác, chỉ số |
Aspartame-Acesulfame INS 962 ADI: 0 - 40 mg/kg thể trọng đối với aspartam và 0 - 15 mg/kg thể trọng đối với acesulfam kali |
|
2. Định nghĩa |
Muối được sản xuất bằng cách gia nhiệt aspartam và acesulfam K theo tỷ lệ khoảng 2 : 1 (khối lượng/khối lượng) trong dung dịch có độ pH acid và tạo kết tinh. Kali và độ ẩm được loại bỏ. Sản phẩm bền hơn aspartam. |
|
Tên hóa học |
Muối 6-methyl-1,2,3-oxathiazin-4(3H)-one-2,2-dioxid của acid L-phenylalanyl-2-metyl-L-α-aspartic; [2-carboxy-β-(N-(b- methoxycarbonyl-2-phenyl)etylcarbamoyl)]ethanaminium-6-methyl-4-oxo-1,2,3-oxathiazin-3-ide-2,2-dioxid |
|
Mã số C.A.S. |
106372-55-8 |
|
Công thức hóa học |
C18H23O9N3S |
|
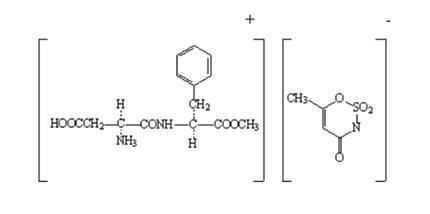
Công thức cấu tạo |
|
|
Khối lượng phân tử |
457,46 |
|
3. Cảm quan |
Bột tinh thể màu trắng, không mùi |
|
4. Mã HS |
2924.29.10 |
|
5. Yêu cầu kỹ thuật |
|
|
5.1. Định tính |
|
|
Độ tan |
Ít tan trong nước và rất ít tan trong ethanol |
|
5.2. Độ tinh khiết |
|
|
Hao hụt khối lượng sau khi sấy |
Không vượt quá 0,5 % khối lượng (105 °C trong 4 h) |
|
Độ truyền quang |
Tỷ lệ độ truyền quang của hỗn hợp dung dịch mẫu thử 1 % trong nước, được xác định bằng cuvet 1 cm ở 430 nm với máy đo quang phổ thích hợp, so với độ truyền quang của nước, là không nhỏ hơn 0,95, tương đương với độ hấp thụ không vượt quá 0,022. |
|
Góc quay cực riêng |
[α] 20, D: từ +14,5º đến +16,5º |
|
Hàm lượng acid 5-benzyl-3,6-dioxo-2-piperazin acetic |
Không vượt quá 0,5 % |
|
Chì |
Không vượt quá 1 mg/kg |
|
5.3. Hàm lượng aspartam và acesulfam |
Hàm lượng aspartam từ 63,0 đến 66,0 % tính theo chế phẩm đã sấy khô và hàm lượng acesulfam dạng acid từ 34,0 đến 37,0 % tính theo chế phẩm đã sấy khô. |
|
6. Phương pháp thử |
|
|
6.1. Định tính |
|
|
Độ tan |
Xác định theo TCVN 6469:2010, Phụ gia thực phẩm - Phương pháp đánh giá ngoại quan và xác định các chỉ tiêu vật lý (mục 3.7). |
|
6.2. Độ tinh khiết |
|
|
Hao hụt khối lượng sau khi sấy |
Xác định theo TCVN 8900-2:2012, Phụ gia thực phẩm - Xác định các thành phần vô cơ - Phần 2: Hao hụt khối lượng khi sấy, hàm lượng tro, chất không tan trong nước và chất không tan trong axit (mục 5.1), thực hiện ở 105 ºC trong 4 h. |
|
Góc quay cực riêng |
Xác định theo TCVN 6469:2010, Phụ gia thực phẩm - Phương pháp đánh giá ngoại quan và xác định các chỉ tiêu vật lí (mục 3.6). Chuẩn bị dung dịch từ 6,2 g mẫu thử trong 100 ml acid formic 15 N; đo góc quay cực trong vòng 30 phút sau khi chuẩn bị dung dịch; chia góc quay cực riêng tính được cho 0,646 để hiệu chính hàm lượng aspartam của muối aspartam-acesulfam. |
|
Chì |
Xác định theo TCVN 8900-6:2012, Phụ gia thực phẩm - Xác định các thành phần vô cơ - Phần 6: Định lượng antimon, bari, cadimi, crom, đồng, chì và kẽm bằng đo phổ hấp thụ nguyên tử ngọn lửa; hoặc TCVN 8900-8:2012, Phụ gia thực phẩm - Xác định các thành phần vô cơ - Phần 8: Định lượng chì và cadimi bằng đo phổ hấp thụ nguyên tử dùng lò graphit. |
|
Hàm lượng axit 5-benzyl-3,6-dioxo-2-piperazin axetic |
Nguyên tắc Mẫu thử được hòa tan trong hỗn hợp methanol : nước, xác định acid 5-benzyl-3,6-dioxo-2-piperazin acetic bằng cách so sánh với chất chuẩn sau khi tách bằng sắc kí lỏng hiệu năng cao (HPLC). Pha động Hòa tan 5,6 g kali dihydro phosphat vào 820 ml nước đựng trong bình định mức 1 lít và chỉnh pH đến 4,3 bằng acid phosphoric. Thêm 180 ml methanol và trộn. Lọc qua bộ lọc 0,45 μm và khử khí. Dung dịch chuẩn acid 5-benzyl-3,6-dioxo-2-piperazin acetic Cân chính xác khoảng 25 mg chất chuẩn acid 5-benzyl-3,6-dioxo-2-piperazin acetic, chuyển vào bình định mức 100 ml, thêm 10 ml methanol để hòa tan và thêm nước đến vạch rồi trộn. Dùng pipet lấy 15 ml dung dịch vừa chuẩn bị vào bình định mức 50 ml, thêm hỗn hợp methanol: nước (tỷ lệ 1:9 phần thể tích, chuẩn bị mới hàng ngày) đến vạch và trộn. Thiết bị Thiết bị HPLC, được trang bị detector UV để đo độ hấp thu ở 210 nm và cột dài 250 mm, đường kính trong 4,6 mm được nhồi octyldecyl silica đã silan hóa (ví dụ: Partisil ODS-3 10 μm), vận hành trong các điều kiện đẳng dòng ở 40 ºC. Chuẩn bị mẫu thử Cân chính xác khoảng 50 mg mẫu thử, cho vào bình định mức 10 ml và thêm hỗn hợp methanol: nước (tỷ lệ 1:9 phần thể tích, chuẩn bị mới hàng ngày) đến vạch. Cách tiến hành Bơm riêng rẽ các thể tích 20 μl dung dịch chuẩn và dung dịch mẫu thử vào hệ thống sắc kí với tốc độ pha động khoảng 2 ml/phút. Ghi lại diện tích pic trên sắc kí đồ của chất chuẩn và mẫu thử. Trong các điều kiện được quy định, thời gian lưu của acid 5-benzyl-3,6-dioxo-2-piperazin acetic và aspartam tương ứng khoảng 4 phút và 11 phút. Đo diện tích pic của acid 5-benzyl-3,6-dioxo-2-piperazin acetic trên mỗi sắc kí đồ. Tính kết quả Hàm lượng acid 5-benzyl-3,6-dioxo-2-piperazin acetic trong mẫu thử biểu thị bằng phần trăm khối lượng, tính theo Công thức: % = 1000(AU x CS)/(AS x WU) Trong đó: AU và AS là diện tích pic acid 5-benzyl-3,6-dioxo-2-piperazin acetic tương ứng trên sắc kí đồ của mẫu thử và chất chuẩn; CS là nồng độ acid 5-benzyl-3,6-dioxo-2-piperazin acetic trong dung dịch chuẩn, tính bằng miligam trên mililit (mg/ml); WU là khối lượng mẫu thử, tính bằng miligam (mg) |
|
6.3. Định lượng |
Nguyên tắc Mẫu thử được hòa tan trong methanol và chuẩn độ điện thế bằng tetrabutylamoni hydroxyd. Chuẩn hóa dung dịch chuẩn tetrabutylamoni hydroxyd - Dung dịch chuẩn tetrabutylamoni hydroxyd, 0,1M trong hỗn hợp 2-propanol : methanol (tỉ lệ thể tích 1:1) Cân lần lượt 24 mg và 98 mg acid benzoic, chính xác đến 0,01 mg, cho vào hai bình định mức 50 ml, thêm 2-propanol đến vạch. Chuẩn độ cả hai dung dịch bằng dung dịch tetrabutylamoni hydroxyd 0,1 M và ghi lại thể tích cần để đạt đến điểm tương đương, với độ chính xác 0,001 ml. Thực hiện phép chuẩn độ trắng với 50 ml 2-propanol. Xác định hệ số chuẩn (F) đối với mỗi phép chuẩn độ và tính trung bình hai hệ số như sau: F = [(WS x 1000)/(122 x (VS - V0))] Trong đó: WS là khối lượng của acid benzoic đã cân, tính bằng gam (g); VS là thể tích dung dịch tetrabutylamoni hydroxyd 0,1M đã sử dụng để chuẩn độ acid benzoic, tính bằng mililit (ml); V0 là thể tích dung dịch tetrabutylamoni hydroxyd 0,1M đã sử dụng để chuẩn độ mẫu trắng, tính bằng mililit (ml); 122 là khối lượng phân tử acid benzoic. Thiết bị Thiết bị chuẩn độ tự động (ví dụ: Metrohm 670), được trang bị điện cực pH thủy tinh (ví dụ: Yokogawa SM 21-AL41)) và điện cực so sánh bạc-bạc clorua (ví dụ: SR 20-AS521)). Cách tiến hành Cân chính xác khoảng 100 mg đến 150 mg mẫu thử, hòa tan trong 50 ml methanol. Chuẩn độ với dung dịch chuẩn tetrabutylamoni hydroxyd 0,1 M đã chuẩn hóa nồng độ. Xác định thể tích dung dịch chuẩn cần để đạt đến điểm tương đương thứ nhất và điểm tương đương thứ hai. Thực hiện phép chuẩn độ mẫu trắng đối với methanol. Tính kết quả Hàm lượng acesulfam trong mẫu thử tính theo công thức: % = [(V1 - VB) x N x 163/(10 x W)] Hàm lượng aspartam trong mẫu thử tính theo công thức: % = [(V2 - V1) x N x 294/(10 x W)] Trong đó: V1 là thể tích dung dịch tetrabutylamoni hydroxyd 0,1M đã dùng để chuẩn độ tại điểm tương đương thứ nhất, tính bằng mililit (ml); V2 là thể tích dung dịch tetrabutylamoni hydroxyd 0,1M đã dùng để chuẩn độ tại điểm tương đương thứ hai, tính bằng mililit (ml); VB là thể tích dung dịch tetrabutylamoni hydroxyd 0,1M đã dùng để chuẩn độ tại điểm tương đương của phép thử trắng, tính bằng mililit (ml); N là nồng độ đương lượng của dung dịch chuẩn tetrabutylamoni hydroxyd 0,1 M đã được chuẩn hóa; 163 và 294 là khối lượng phân tử tương ứng của acesulfam và aspartam; 10 là hệ số chuyển từ gam (g) sang phần trăm (%) khối lượng; W là khối lượng mẫu thử tính theo chế phẩm đã sấy khô, tính bằng gam (g). |
(Không có nội dung)
Vì chưa Đăng Nhập nên Bạn chỉ xem được Thuộc tính của Văn bản. Bạn chưa xem được Hiệu lực của Văn bản, Văn bản Liên quan, Văn bản thay thế, Văn bản gốc, Văn bản tiếng Anh,...
Nếu chưa có Tài khoản, mời Bạn Đăng ký Tài khoản tại đây
(Không có nội dung)
Vì chưa Đăng Nhập nên Bạn chỉ xem được Thuộc tính của Văn bản. Bạn chưa xem được Hiệu lực của Văn bản, Văn bản Liên quan, Văn bản thay thế, Văn bản gốc, Văn bản tiếng Anh,...
Nếu chưa có Tài khoản, mời Bạn Đăng ký Tài khoản tại đây
Vì chưa Đăng Nhập nên Bạn chỉ xem được Thuộc tính của Văn bản. Bạn chưa xem được Hiệu lực của Văn bản, Văn bản Liên quan, Văn bản thay thế, Văn bản gốc, Văn bản tiếng Anh,...
Nếu chưa có Tài khoản, mời Bạn Đăng ký Tài khoản tại đây
-
Ban hành: {{m.News_Dates_Date}} Hiệu lực: {{m.News_EffectDate_Date}} Tình trạng: {{m.TinhTrang}} Cập nhật: {{m.Email_SendDate_Date}} Ban hành: {{m.News_Dates_Date}}Hiệu lực: {{m.News_EffectDate_Date}}Tình trạng: {{m.TinhTrang}}Cập nhật: {{m.Email_SendDate_Date}}
Vì chưa Đăng Nhập nên Bạn chỉ xem được Thuộc tính của Văn bản. Bạn chưa xem được Hiệu lực của Văn bản, Văn bản Liên quan, Văn bản thay thế, Văn bản gốc, Văn bản tiếng Anh,...
Nếu chưa có Tài khoản, mời Bạn Đăng ký Tài khoản tại đây
-
Ban hành: {{m.News_Dates_Date}} Hiệu lực: {{m.News_EffectDate_Date}} Tình trạng: {{m.TinhTrang}} Cập nhật: {{m.Email_SendDate_Date}} Ban hành: {{m.News_Dates_Date}}Hiệu lực: {{m.News_EffectDate_Date}}Tình trạng: {{m.TinhTrang}}Cập nhật: {{m.Email_SendDate_Date}}
Vì chưa Đăng Nhập nên Bạn chỉ xem được Thuộc tính của Văn bản. Bạn chưa xem được Hiệu lực của Văn bản, Văn bản Liên quan, Văn bản thay thế, Văn bản gốc, Văn bản tiếng Anh,...
Nếu chưa có Tài khoản, mời Bạn Đăng ký Tài khoản tại đây
Vì chưa Đăng Nhập nên Bạn chỉ xem được Thuộc tính của Văn bản. Bạn chưa xem được Hiệu lực của Văn bản, Văn bản Liên quan, Văn bản thay thế, Văn bản gốc, Văn bản tiếng Anh,...
Nếu chưa có Tài khoản, mời Bạn Đăng ký Tài khoản tại đây