Công văn 3886/BYT-DP năm 2021 hướng dẫn giám sát sự cố bất lợi sau tiêm vắc xin phòng COVID-19 do Bộ Y tế ban hành
Công văn 3886/BYT-DP năm 2021 hướng dẫn giám sát sự cố bất lợi sau tiêm vắc xin phòng COVID-19 do Bộ Y tế ban hành
| Số hiệu: | 3886/BYT-DP | Loại văn bản: | Công văn |
| Nơi ban hành: | Bộ Y tế | Người ký: | Đỗ Xuân Tuyên |
| Ngày ban hành: | 11/05/2021 | Ngày hiệu lực: | Đã biết |
| Ngày công báo: | Đang cập nhật | Số công báo: | Đang cập nhật |
| Tình trạng: | Đã biết |
| Số hiệu: | 3886/BYT-DP |
| Loại văn bản: | Công văn |
| Nơi ban hành: | Bộ Y tế |
| Người ký: | Đỗ Xuân Tuyên |
| Ngày ban hành: | 11/05/2021 |
| Ngày hiệu lực: | Đã biết |
| Ngày công báo: | Đang cập nhật |
| Số công báo: | Đang cập nhật |
| Tình trạng: | Đã biết |
|
BỘ Y TẾ |
CỘNG HÒA XÃ HỘI CHỦ
NGHĨA VIỆT NAM |
|
Số: 3886/BYT-DP |
Hà Nội, ngày 11 tháng 05 năm 2021 |
Kính gửi: Sở Y tế các tỉnh, thành phố trực thuộc Trung ương
Ngày 05/3/2021, Bộ Y tế ban hành Quyết định số 1467/QĐ-BYT phê duyệt Kế hoạch tiêm vắc xin phòng COVID-19 giai đoạn 2021-2022 và Quyết định số 1464/QĐ-BYT ban hành Hướng dẫn tiếp nhận, bảo quản, phân phối và sử dụng vắc xin phòng COVID-19. Để việc triển khai tiêm chủng vắc xin phòng COVID-19 an toàn và xử lý kịp thời các trường hợp sự cố bất lợi sau tiêm chủng, Bộ Y tế xây dựng Hướng dẫn giám sát sự cố bất lợi sau tiêm vắc xin phòng COVID-19 như sau:
1. Sở Y tế các tỉnh, thành phố căn cứ Hướng dẫn này chỉ đạo, hướng dẫn, kiểm tra, giám sát các cơ sở tiêm chủng thực hiện nghiêm túc việc giám sát thường quy và giám sát chủ động sự cố bất lợi sau tiêm vắc xin phòng COVID-19 theo quy định của Bộ Y tế và thông qua Ứng dụng Hồ sơ sức khỏe.
2. Chỉ đạo Trung tâm Kiểm soát bệnh tật, Trung tâm Y tế cấp huyện, các cơ sở tiêm chủng cài đặt Ứng dụng Hồ sơ sức khỏe, hướng dẫn người được tiêm cài đặt và sử dụng Ứng dụng này.
Trong quá trình thực hiện nếu có khó khăn, vướng mắc đề nghị liên hệ Cục Y tế dự phòng - Bộ Y tế (số điện thoại: 0243.8462364, email: [email protected])./.
|
|
KT. BỘ TRƯỞNG |
GIÁM SÁT SỰ CỐ BẤT LỢI SAU TIÊM VẮC XIN PHÒNG
COVID-19
(Ban
hành kèm theo Công văn số 3886/BYT-DP ngày 11/05/2021 của Bộ Y tế)
Hệ thống giám sát sự cố bất lợi sau tiêm chủng tại Việt Nam đã được thiết lập ngay trong những giai đoạn đầu của công tác tiêm chủng nhằm giảm thiểu các rủi ro liên quan đến sử dụng vắc xin, phát hiện sớm và phòng tránh những sai sót có thể xảy ra, đáp ứng nhanh đối với các trường hợp sự cố bất lợi sau tiêm chủng cũng như hướng dẫn và tuyên truyền có hiệu quả các thông tin cần thiết cho cộng đồng.
Việc theo dõi sự cố bất lợi sau tiêm chủng được thực hiện theo Nghị định 104/2016/NĐ-CP ngày 01/7/2016 quy định về hoạt động tiêm chủng, Nghị định 155/2018/NĐ-CP ngày 12/11/2018 sửa đổi, bổ sung một số quy định liên quan đến điều kiện đầu tư kinh doanh thuộc phạm vi quản lý nhà nước của Bộ Y tế trong đó có lĩnh vực tiêm chủng, Thông tư 34/2018/TT-BYT ngày 12/11/2018 quy định chi tiết một số điều của Nghị định số 104/2016/NĐ-CP ngày 01/7/2016 của Chính phủ quy định về hoạt động tiêm chủng.
Từ năm 2020, cùng với sự xuất hiện và lây truyền mạnh của đại dịch COVID-19 trên toàn cầu, các nhà sản xuất trên thế giới và tại Việt Nam đã khẩn trương tiến hành nghiên cứu, phát triển, sản xuất vắc xin phòng COVID-19. Tới nay trên thế giới đã có hơn 10 loại vắc xin phòng COVID-19 được đưa vào danh mục sử dụng khẩn cấp. Hơn 900 triệu liều vắc xin đã được sử dụng trên toàn cầu. Tuy nhiên, đây đều là những vắc xin mới nên hiệu quả phòng bệnh cũng như tính an toàn của các loại vắc xin này vẫn đang được tiếp tục theo dõi, tổng hợp trong quá trình sử dụng. Việc giám sát chặt chẽ, chủ động tính an toàn của vắc xin là hết sức cần thiết.
Để triển khai sử dụng vắc xin, ngày 05/03/2021 Bộ Y tế ban hành Quyết định số 1467/QĐ-BYT phê duyệt Kế hoạch tiêm vắc xin phòng COVID-19 giai đoạn 2021-2022 và Quyết định số 1464/QĐ-BYT ban hành Hướng dẫn tiếp nhận, bảo quản, phân phối và sử dụng vắc xin phòng COVID-19. Để chủ động phát hiện và xử trí kịp thời các sự cố bất lợi sau tiêm vắc xin phòng COVID-19, đặc biệt là tai biến nặng sau tiêm, Bộ Y tế hướng dẫn giám sát sự cố sau tiêm vắc xin phòng COVID-19 bao gồm giám sát thường qui và giám sát chủ động nhằm kịp thời xử trí các vấn đề phát sinh đảm bảo việc triển khai vắc xin phòng COVID-19 an toàn, hiệu quả.
1. Giám sát thường qui sự cố bất lợi sau tiêm chủng
1.1. Theo dõi sau tiêm:
- Theo dõi người được tiêm ít nhất 30 phút sau tiêm tại điểm tiêm chủng.
- Hướng dẫn gia đình hoặc người được tiêm theo dõi chặt chẽ, thường xuyên tại nhà trong vòng 24 giờ sau tiêm chủng và tiếp tục trong vòng 7 ngày sau tiêm chủng về các dấu hiệu: toàn trạng, tinh thần, ăn, ngủ, thở, phát ban, triệu chứng tại chỗ tiêm, thông báo cho nhân viên y tế nếu có dấu hiệu bất thường.
- Liên hệ với bệnh viện hoặc các cơ sở y tế gần nhất nếu sau tiêm chủng có một trong các dấu hiệu như sốt cao (≥39°C), tím tái, khó thở... hoặc khi phản ứng thông thường kéo dài trên 24 giờ sau tiêm.
1.2. Giám sát phát hiện phản ứng thông thường:
- Khi triển khai tiêm chủng, cơ sở tiêm chủng thực hiện theo dõi, ghi nhận các trường hợp phản ứng thông thường sau tiêm thông qua thông tin phản hồi từ người được tiêm hoặc gia đình người được tiêm, hoặc qua khai thác thông tin khi đối tượng tiêm đến cơ sở tiêm chủng. Thực hiện ghi chép thông tin về trường hợp phản ứng thông thường sau tiêm chủng (theo mẫu tại Phụ lục 1 ban hành kèm theo Hướng dẫn này).
- Hướng dẫn người được tiêm hoặc người nhà khai báo thông tin thông qua Ứng dụng Hồ sơ sức khỏe tại địa chỉ http://hssk.kcb.vn/#/survey (triển khai khi được cung cấp).
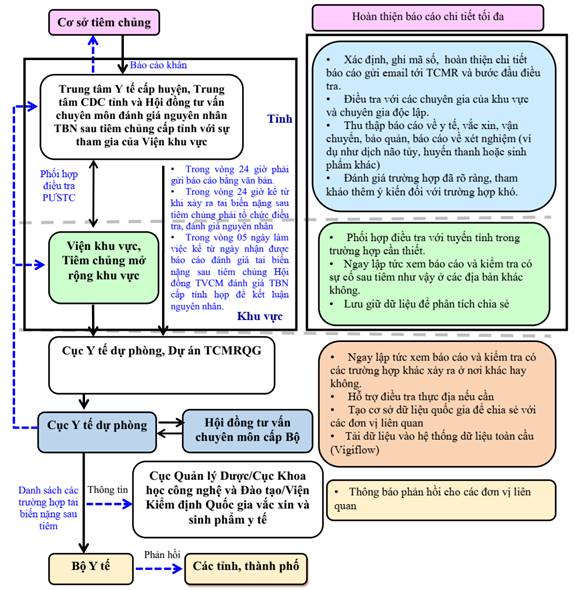
1.3. Giám sát trường hợp tai biến nặng sau tiêm:
- Theo dõi, phát hiện, xử trí và báo cáo tai biến nặng sau tiêm chủng vắc xin phòng COVID-19 theo quy định tại Điều 5 Nghị định số 104/2016/NĐ-CP ngày 01/7/2016 của Chính phủ và Điều 14, Điều 17, Điều 18 và Điều 20 Thông tư 34/2018/TT-BYT ngày 12/11/2018 của Bộ Y tế.
- Điều tra tai biến nặng sau tiêm vắc xin phòng COVID-19 theo quy định tại khoản 1 Điều 6 Nghị định số 104/2016/NĐ-CP ngày 01/7/2016 của Chính phủ và Điều 15 Thông tư 34/2018/TT-BYT ngày 12/11/2018 của Bộ Y tế. Riêng biểu mẫu điều tra thực hiện như tại Phụ lục 2 ban hành kèm theo Hướng dẫn này.
Trong hồ sơ điều tra trường hợp tai biến nặng sau tiêm cần lưu ý ghi nhận đầy đủ thông tin về tiền sử tiêm chủng, tiền sử dị ứng, tiền sử mắc COVID-19, tiền sử điều trị COVID-19 bằng huyết tương, tiền sử bệnh tật và dùng thuốc.
- Đánh giá nguyên nhân và thông báo kết luận theo quy định tại Điều 6 Nghị định số 104/2016/NĐ-CP ngày 01/7/2016 của Chính phủ và Điều 16 Thông tư 34/2018/TT-BYT ngày 12/11/2018 của Bộ Y tế.
1.4. Báo cáo sự cố bất lợi sau tiêm:
a) Hình thức báo cáo:
+ Thực hiện báo cáo hàng ngày và báo cáo định kỳ, báo cáo bằng văn bản hoặc thư điện tử đối với các trường hợp phản ứng thông thường và tai biến nặng sau tiêm theo quy định tại Thông tư số 34/2018/TT-BYT ngày 12/11/2018 của Bộ Y tế .
+ Báo cáo bằng Ứng dụng Hồ sơ sức khỏe tại địa chỉ http://hssk.kcb.vn/#/survey (triển khai khi được cung cấp).
b) Nội dung báo cáo:
- Báo cáo định kỳ:
+ Báo cáo các trường hợp phản ứng thông thường sau tiêm theo mẫu quy định (tại Phụ lục X ban hành kèm theo Thông tư 34/2018/TT-BYT ngày 12/11/2018 của Bộ Y tế);
+ Báo cáo các trường hợp tai biến nặng sau tiêm theo mẫu quy định (tại Phụ lục XI ban hành kèm theo Thông tư 34/2018/TT-BYT ngày 12/11/2018 của Bộ Y tế);
- Báo cáo hàng ngày: Theo hướng dẫn của Bộ Y tế tại Công văn số 1734/BYT-DP ngày 16/3/2021 về hướng dẫn tổ chức buổi tiêm chủng vắc xin phòng COVID-19
c) Quy trình và thời gian báo cáo: Thực hiện theo quy định tại Thông tư 34/2018/TT-BYT ngày 12/11/2018 của Bộ Y tế.
Sơ đồ báo cáo, điều tra, đánh giá tai biến nặng sau tiêm chủng
2. Giám sát chủ động các sự cố bất lợi sau tiêm vắc xin phòng COVID-19
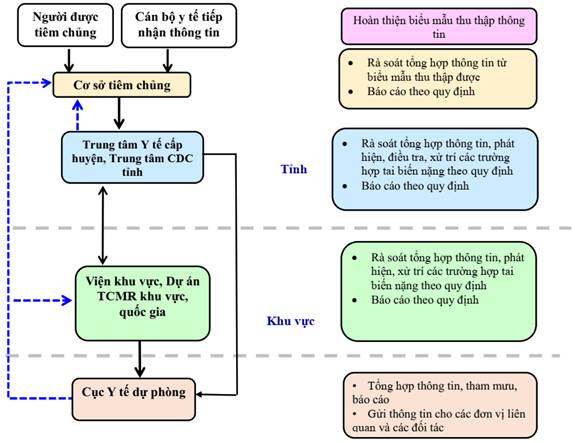
Việc triển khai giám sát chủ động nhằm phát hiện sớm các sự cố bất lợi sau tiêm, đặc biệt là phản ứng thông thường và xử trí kịp thời các trường hợp tai biến nặng. Cán bộ y tế chủ động tiếp cận để ghi nhận, tổng hợp thông tin từ người được tiêm, cơ sở tiêm chủng.
2.1. Cử cán bộ đầu mối thực hiện hoạt động giám sát chủ động:
a) Các Viện Vệ sinh dịch tễ, Viện Pasteur, Trung tâm CDC tỉnh/thành phố, cơ sở tiêm chủng cử 01 cán bộ đầu mối để thực hiện các hoạt động thu thập, tổng hợp thông tin giám sát chủ động tại đơn vị.
b) Mỗi cơ sở tiêm chủng phải thiết lập và thông báo công khai số điện thoại đường dây nóng để người dân liên hệ trong trường hợp cần thiết.
2.2. Nội dung giám sát chủ động
a) Thu thập thông tin theo biểu mẫu (tại Phụ lục 1 ban hành kèm theo Hướng dẫn này).
b) Các hình thức thu thập thông tin:
Cán bộ y tế hoặc người được tiêm chủng điền thông tin trên bản giấy (theo Phụ lục 1 ban hành kèm theo Hướng dẫn này) hoặc tích hợp vào Ứng dụng Hồ sơ sức khỏe (http://hssk.kcb.vn/#/survey) các thông tin về sự cố bất lợi sau tiêm vắc xin phòng COVID-19.
Cơ sở tiêm chủng phải cài đặt ứng dụng Hồ sơ sức khỏe và hướng dẫn người được tiêm chủng cài đặt và khai báo thông tin trong Ứng dụng. c) Tần suất thu thập thông tin
- Trường hợp người được tiêm chủng có sử dụng Ứng dụng Hồ sơ sức khỏe trên điện thoại di động thì từ ngày thứ nhất đến ngày thứ 3 sau khi tiêm vắc xin, mỗi ngày nhà cung cấp dịch vụ sẽ gửi 1 tin nhắn và đến ngày thứ 7 gửi 1 tin nhắn đến người được tiêm (Nội dung nhắn tin theo Phụ lục 3 của Hướng dẫn này).
- Đối với những người chưa cài Ứng dụng Hồ sơ sức khỏe trên điện thoại di động thì cơ sở tiêm chủng hoặc nhà cung cấp dịch vụ có thể gửi tin nhắn hoặc gọi điện thoại để nhắc nhở việc chủ động khai báo những bất thường sau tiêm nhằm bổ sung thêm thông tin (Nội dung tin nhắn hoặc gọi điện thoại theo Phụ lục 3 của Hướng dẫn này).
d) Tổng hợp, báo cáo thông tin
Cán bộ đầu mối giám sát chủ động sự cố sau tiêm vắc xin phòng COVID-19 tại cơ sở tiêm chủng tuyến huyện, tuyến tỉnh tiến hành rà soát thông tin, tổng hợp và báo cáo.
Sơ đồ báo cáo giám sát chủ động
BIỂU MẪU THU THẬP THÔNG TIN GIÁM SÁT CHỦ ĐỘNG SỰ CỐ BẤT LỢI SAU TIÊM CHỦNG VẮC XIN PHÒNG COVID-19
(Dành cho người dân và cán bộ y tế để cung cấp và ghi nhận thông tin)
(ĐÂY LÀ TÀI LIỆU QUAN TRỌNG, THÔNG TIN CỦA ANH/CHỊ SẼ GIÚP CƠ QUAN Y TẾ LIÊN LẠC KHI CẦN THIẾT ĐỂ PHÒNG CHỐNG DỊCH BỆNH TRUYỀN NHIỄM)
1. Thông tin tiêm chủng
Tên cơ sở tiêm chủng ……………………………………………………………………….
Quận, huyện…………….. Tỉnh, TP:………………..........................................................
Ngày tiêm vắc xin: ……./……/20……..
Tên thương mại:................Nhà sản xuất:................................................................................
Số lô: ........................................................................Hạn dùng.....................................................
Mũi tiêm:…………………………………………………………………………………….
2. Thông tin chung về đối tượng được giám sát
|
Họ tên:.................. Ngày sinh: ............ Giới tính: Nam □ Nữ □ Điện thoại……………………………………..................................................................... Địa chỉ:……………………………………………………………………………………..
|
3. Bạn gặp phải bất kì triệu chứng nào sau tiêm vắc xin COVID-19 không?
|
|
□ Không → Kết thúc □ Có → Tích vào 1 hoặc nhiều triệu chứng |
|
|
|
Các triệu chứng: |
Ngày xảy ra triệu chứng |
|
□ |
Đau/sưng tại chỗ tiêm |
|
|
□ |
Nôn/buồn nôn |
|
|
□ |
Tiêu chảy/đau bụng |
|
|
□ |
Sốt ≥37,5⁰ C |
|
|
□ |
Đau họng |
|
|
□ |
Chảy nước mũi, ho |
|
|
□ |
Ớn lạnh |
|
|
□ |
Chóng mặt |
|
|
□ |
Nổi hạch |
|
|
□ |
Phát ban nổi mẩn/ngứa ngoài da |
|
|
□ |
Khó thở/thở khò khè |
|
|
□ |
Đau đầu |
|
|
□ |
Đau cơ |
|
|
□ |
Đau khớp |
|
|
□ |
Bồn chồn/khó chịu |
|
|
□ |
Các triệu chứng khác |
|
4. Bạn có điều trị các triệu chứng đó không?
□ Không → Kết thúc
□ Có → Chuyển đến câu 5
5. Bạn đã điều trị ở đâu?
|
Nơi điều trị |
Ngày bắt đầu điều trị |
|
□ Tại nhà |
|
|
□ Bệnh viện huyện |
|
|
□ Bệnh viện tỉnh |
|
|
□ Trạm Y tế |
|
|
□ Phòng khám tư |
|
|
□ Khác, ghi rõ …………… |
|
6. Tình trạng hiện nay
□ Hồi phục
□ Có biến chứng
□ Khác (Ghi rõ):..............................................................................................................
7. Bạn có thông báo với cơ sở tiêm chủng về phản ứng của bạn gặp phải không?
□ Có, ghi rõ tên cơ sở: ………………………………
□ Không
Cảm ơn bạn đã dành thời gian trả lời.
PHIẾU ĐIỀU TRA TAI BIẾN NẶNG SAU TIÊM CHỦNG
Mã số trường hợp tai biến nặng sau tiêm chủng (*)…...
Ngày tháng năm nhận được báo cáo: -----/----/-----Ngày điều tra: -----/----/---------
Nơi báo cáo trường hợp phản ứng:………………………………………………….
Thành phần đoàn điều tra (họ và tên, đơn vị công tác)
|
1. |
........................................................................................................ |
|
2. |
........................................................................................................ |
|
3. |
........................................................................................................ |
|
4. |
........................................................................................................ |
|
5. |
........................................................................................................ |
1. Thông tin chung
|
Họ và tên: ....................................................... Giới:............ Dân tộc......................... Ngày tháng năm sinh : ....../….../........ Tuổi: Địa chỉ : Thôn/ấp: ................................................. Xã: ...................................... Huyện:................................................... Tỉnh: ...................................... Cơ sở tiêm chủng:......................................................................................
|
2. Thông tin về tiêm chủng trong lần này
|
Vắc xin |
Liều thứ mấy |
Đường tiêm |
Vị trí tiêm |
Người tiêm |
Giờ, ngày tiêm chủng |
Giờ, ngày bắt đầu xảy ra phản ứng |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3. Thông tin về loại vắc xin, dung môi tiêm chủng trong lần này
|
Loại vắc xin, dung môi |
Tên vắc xin, dung môi |
Nhà sản xuất |
Đơn vị cung cấp |
Số lô |
Hạn sử dụng |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4. Diễn biến tai biến nặng sau tiêm chủng
4.1 Triệu chứng và dấu hiệu lâm sàng
a. Thông tin từ đối tượng tiêm chủng hoặc người trực tiếp chăm sóc và hồ sơ người nhà giữ (Mô tả thời gian xuất hiện, triệu chứng đầu tiên của tai biến, diễn biến triệu chứng từ sau khi tiêm chủng)
………………………………………………………………………………………
………………………………………………………………………………………
………………………………………………………………………………………
b. Thông tin từ nhân viên y tế và từ hồ sơ bệnh án tại cơ sở y tế (Mô tả thời gian đến cơ sở y tế, tình trạng ban đầu, diễn biến triệu chứng theo trình tự thời gian)
………………………………………………………………………………………
………………………………………………………………………………………
4.2 Kết quả xét nghiệm cận lâm sàng (máu/nước tiểu/dịch não tuỷ…tại các cơ sở y tế nơi bệnh nhân được điều trị)
………………………………………………………………………………………
4.3 Quá trình chẩn đoán, điều trị và chẩn đoán cuối cùng của cơ sở y tế điều trị
………………………………………………………………………………………
………………………………………………………………………………………
4.4 Trường hợp tử vong
a. Mô tả tình trạng khi phát hiện tử vong (tư thế, vị trí, chất tiết...)
………………………………………………………………………………………
………………………………………………………………………………………
b. Kết quả giám định pháp y (thu thập kết quả giám định bằng văn bản nếu có)
Cơ quan giám định:…………………………………………………………………
Kết quả giám định:………………………………………………………………….
5) Tình trạng tại thời điểm điều tra
|
□ Đang điều trị |
|
|
□ Khỏi |
Sau tiêm chủng bao lâu: …………. |
|
□ Tử vong |
Sau tiêm chủng bao lâu …………… |
|
□ Di chứng (ghi rõ) ...................... |
Sau tiêm chủng bao lâu ................... |
6) Tiền sử
a. Tiền sử bệnh tật
Bệnh kèm theo hiện tại: …………………………………………………………….
Tiền sử dị ứng (ghi rõ) …………………………………………………………….
Tiền sử mắc COVID-19: Có □ Không □
Tiền sử điều trị COVID-19 bằng huyết tương: Có □ Không □
Tiền sử suy giảm miễn dịch, ung thư, đang dùng thuốc corticoid, ức chế miễn dịch:
Có □ Không □
Tiền sử rối loạn đông máu/cầm máu hoặc đang dùng thuốc chống đông:
Có □ Không □
b. Tiền sử tiêm chủng và phản ứng sau các lần tiêm chủng trước (loại vắc xin, thời gian tiêm, nêu rõ phản ứng sau tiêm chủng nếu có).
………………………………………………………………………………………
c. Tiền sử dùng thuốc ngay trước khi tiêm chủng lần này (trong vòng 1 tuần trước khi tiêm chủng)
………………………………………………………………………………………
d. Trước, trong và sau tiêm chủng lần này có gì bất thường không? có té (ngã) không?
………………………………………………………………………………………
đ. Tiền sử gia đình (dị ứng hoặc phản ứng với vắc xin, …nếu có)
………………………………………………………………………………………
7) Điều tra thực hiện quy trình tiêm chủng tại cơ sở tiêm chủng
|
a. Điều kiện bảo quản vắc xin, dung môi (Nhận vắc xin từ đâu, thời gian nào, phương tiện nhận vắc xin, bảo quản vắc xin tại xã, có thiết bị theo dõi nhiệt độ bảo quản vắc xin? Kiểm tra nhiệt độ bảo quản vắc xin hiện tại, biểu đồ theo dõi nhiệt độ (nếu bảo quản vắc xin bằng tủ lạnh) ……………………………………………………………………………………… ……………………………………………………………………………………… b. Cách tổ chức buổi tiêm chủng (Số đối tượng trong 1 buổi tiêm ? Số nhân viên tham gia tiêm chủng ? Có khám phân loại, tư vấn trước và theo dõi sau tiêm chủng?) ……………………………………………………………………………………… ……………………………………………………………………………………… c. Thực hành tiêm chủng (Nhân viên trực tiếp tiêm chủng được tập huấn không? Kiểm tra kiến thức về thực hành khám chỉ định và chống chỉ định, bảo quản vắc xin, chuẩn bị vắc xin, pha hồi chỉnh (kỹ thuật pha, thời gian sử dụng), sử dụng BKT, kỹ thuật tiêm chủng, hủy vắc xin, BKT sau buổi tiêm chủng) ……………………………………………………………………………………… ……………………………………………………………………………………… d. Ghi chép và quản lý sổ sách (Kiểm tra sổ quản lý vắc xin, sổ quản lý tiêm chủng, sổ theo dõi phản ứng bất thường sau tiêm chủng) ……………………………………………………………………………………… ……………………………………………………………………………………… đ. Tình hình tiêm chủng - Số đối tượng cùng tiêm trong buổi tiêm chủng của từng loại vắc xin ……………………………………………………………………………………… ……………………………………………………………………………………… - Số đối tượng tiêm chủng cùng loại vắc xin:……. cùng lô vắc xin:…… cùng lọ vắc xin (nếu lọ nhiều liều): ……. với trường hợp tai biến sau tiêm chủng. - Số trường hợp tai biến nặng sau tiêm chủng tại cơ sở tiêm chủng trong thời gian gần đây………… - Tình hình bệnh tật, tử vong tại địa bàn trong thời gian gần đây có gì đặc biệt ……………………………………………………………………………………… ……………………………………………………………………………………… |
8. Điều tra tại cộng đồng (kết hợp hỏi nhân viên y tế và thăm hộ gia đình)
- Tổng số đối tượng được điều tra: ……….
- Số đối tượng có phản ứng với cùng loại vắc xin: ………
- Các vấn đề khác: …………....................................................................................
9. Tình hình tiếp nhận, bảo quản, phân phối và sử dụng lô vắc xin có trường hợp tai biến nặng sau tiêm chủng tại tuyến tỉnh, huyện
9.1. Tình hình tiếp nhận, bảo quản, phân phối lô vắc xin tại tuyến tỉnh, huyện
|
Thông tin điều tra |
Tuyến tỉnh |
Tuyến huyện |
|
Nguồn gốc lô vắc xin |
|
|
|
Thời gian tiếp nhận |
|
|
|
Số lượng nhận |
|
|
|
Phương tiện vận chuyển |
|
|
|
Số lượng đã cấp cho tuyến dưới |
|
|
|
Số lượng còn tồn tại kho đơn vị |
|
|
|
Phương tiện bảo quản lô vắc xin này |
|
|
|
Nhiệt độ bảo quản lúc kiểm tra |
|
|
|
Chỉ thị đông băng điện tử lúc kiểm tra |
|
|
|
Chỉ thị nhiệt độ lọ vắc xin lúc kiểm tra (nếu có) |
|
|
|
Có bảng theo dõi nhiệt độ hằng ngày |
Có □ Không □ |
Có □ Không □ |
|
Nhiệt độ có trong giới hạn cho phép không? |
Có □ Không □ |
Có □ Không □ |
|
Có sự cố dây chuyền lạnh trong thời gian bảo quản lô vắc xin này không? |
Có □ Không □ |
Có □ Không □ |
|
Có sổ quản lý vắc xin, BKT, HAT |
Có □ Không □ |
Có □ Không □ |
|
Sổ ghi chép đúng quy định không? |
Có □ Không □ |
Có □ Không □ |
|
Lô vắc xin này có được quản lý đúng quy định trong sổ không? |
Có □ Không □ |
Có □ Không □ |
|
Có phiếu xuất, nhập kho không? |
Có □ Không □ |
Có □ Không □ |
|
Phiếu có ghi chép đúng quy định không? |
Có □ Không □ |
Có □ Không □ |
|
Nhân viên quản lý kho vắc xin tại tuyến tỉnh đã được tập huấn về bảo quản vắc xin không ? |
Có □ Không □ |
Có □ Không □ |
|
Kiểm tra kiến thức về bảo quản vắc xin của nhân viên quản lý kho có đạt yêu cầu không? |
Có □ Không □ |
Có □ Không □ |
9.2. Tình hình sử dụng lô vắc xin và tai biến nặng sau tiêm chủng tuyến tỉnh, huyện
|
Thông tin điều tra |
Tuyến tỉnh |
Tuyến huyện |
|
Số đối tượng tiêm chủng cùng loại vắc xin |
|
|
|
Số đối tượng tiêm chủng cùng lô vắc xin |
|
|
|
Số trường hợp phản ứng sau tiêm chủng lô vắc xin này |
|
|
|
Số trường hợp phản ứng sau tiêm chủng khác |
|
|
10. Các hoạt động đã triển khai
a/ Tuyến xã, cơ sở tiêm chủng…………………………………………………………
b/ Tuyến tỉnh, huyện……………………………………………………………………
Có lấy mẫu vắc xin gửi kiểm định không? Có □ Không □
Số lượng mẫu:……….Tuyến được lấy mẫu:………………………………………
Ngày gửi mẫu……/……/…… Kết quả kiểm định (nếu có)…………………….
11. Nhận định và đánh giá sơ bộ
- Quá trình vận chuyển, bảo quản vắc xin đúng qui định không? Có □ Không □
- Qui trình thực hành tiêm chủng có bảo đảm an toàn không? Có □ Không □
- Nhận định ban đầu về nguyên nhân của trường hợp tai biến sau tiêm chủng:
………………………………………………………………………………………
12. Đề xuất, khuyến nghị
………………………………………………………………………………………
Ghi chú
(*): Điền mã số trường hợp tai biến nặng sau tiêm bao gồm chữ viết tắt của Việt Nam tỉnh, huyện và điểm tiêm chủng cuối cùng là số trường hợp tai biến tại điểm tiêm chủng đó được viết dưới dạng số ví dụ trường hợp thứ nhất tai biến nặng sau tiêm chủng tại xã A huyện B, tỉnh C: mã số được viết như sau: VNCBA01;
|
|
Ngày ….. tháng …..
năm 20...... |
NỘI DUNG TIN NHẮN HOẶC GỌI ĐIỆN THOẠI THU THẬP THÔNG TIN GIÁM SÁT CHỦ ĐỘNG SỰ CỐ BẤT LỢI SAU TIÊM
1. Nội dung tin nhắn hoặc gọi điện thoại đối với người đã cài Ứng dụng
“Cảm ơn anh/chị đã tham gia tiêm vắc xin phòng COVID-19 vào ngày …/.../2021. Để thông báo tình hình sức khỏe sau tiêm, đề nghị anh/chị điền vào biểu mẫu thu thập thông tin giám sát chủ động sự cố bất lợi sau tiêm trên ứng dụng SỔ SỨC KHỎE ĐIỆN TỬ bất kỳ lúc nào có biểu hiện bất thường. Xin cảm ơn”.
2. Nội dung tin nhắn hoặc gọi điện thoại đối với người không cài Ứng dụng
“Để thông báo tình hình sức khỏe sau tiêm vắc xin phòng COVID-19, đề nghị anh/chị điền vào biểu mẫu thu thập thông tin giám sát chủ động sự cố bất lợi sau tiêm chủng tại địa chỉ: http://hssk.kcb.vn/#/survey hoặc tải Ứng dụng SỔ SỨC KHỎE ĐIỆN TỬ tại đường link nêu trên. Xin cảm ơn”.
(Không có nội dung)
Vì chưa Đăng Nhập nên Bạn chỉ xem được Thuộc tính của Văn bản. Bạn chưa xem được Hiệu lực của Văn bản, Văn bản Liên quan, Văn bản thay thế, Văn bản gốc, Văn bản tiếng Anh,...
Nếu chưa có Tài khoản, mời Bạn Đăng ký Tài khoản tại đây
(Không có nội dung)
Vì chưa Đăng Nhập nên Bạn chỉ xem được Thuộc tính của Văn bản. Bạn chưa xem được Hiệu lực của Văn bản, Văn bản Liên quan, Văn bản thay thế, Văn bản gốc, Văn bản tiếng Anh,...
Nếu chưa có Tài khoản, mời Bạn Đăng ký Tài khoản tại đây
Vì chưa Đăng Nhập nên Bạn chỉ xem được Thuộc tính của Văn bản. Bạn chưa xem được Hiệu lực của Văn bản, Văn bản Liên quan, Văn bản thay thế, Văn bản gốc, Văn bản tiếng Anh,...
Nếu chưa có Tài khoản, mời Bạn Đăng ký Tài khoản tại đây
-
Ban hành: {{m.News_Dates_Date}} Hiệu lực: {{m.News_EffectDate_Date}} Tình trạng: {{m.TinhTrang}} Cập nhật: {{m.Email_SendDate_Date}} Ban hành: {{m.News_Dates_Date}}Hiệu lực: {{m.News_EffectDate_Date}}Tình trạng: {{m.TinhTrang}}Cập nhật: {{m.Email_SendDate_Date}}
Vì chưa Đăng Nhập nên Bạn chỉ xem được Thuộc tính của Văn bản. Bạn chưa xem được Hiệu lực của Văn bản, Văn bản Liên quan, Văn bản thay thế, Văn bản gốc, Văn bản tiếng Anh,...
Nếu chưa có Tài khoản, mời Bạn Đăng ký Tài khoản tại đây
-
Ban hành: {{m.News_Dates_Date}} Hiệu lực: {{m.News_EffectDate_Date}} Tình trạng: {{m.TinhTrang}} Cập nhật: {{m.Email_SendDate_Date}} Ban hành: {{m.News_Dates_Date}}Hiệu lực: {{m.News_EffectDate_Date}}Tình trạng: {{m.TinhTrang}}Cập nhật: {{m.Email_SendDate_Date}}
Vì chưa Đăng Nhập nên Bạn chỉ xem được Thuộc tính của Văn bản. Bạn chưa xem được Hiệu lực của Văn bản, Văn bản Liên quan, Văn bản thay thế, Văn bản gốc, Văn bản tiếng Anh,...
Nếu chưa có Tài khoản, mời Bạn Đăng ký Tài khoản tại đây
Vì chưa Đăng Nhập nên Bạn chỉ xem được Thuộc tính của Văn bản. Bạn chưa xem được Hiệu lực của Văn bản, Văn bản Liên quan, Văn bản thay thế, Văn bản gốc, Văn bản tiếng Anh,...
Nếu chưa có Tài khoản, mời Bạn Đăng ký Tài khoản tại đây