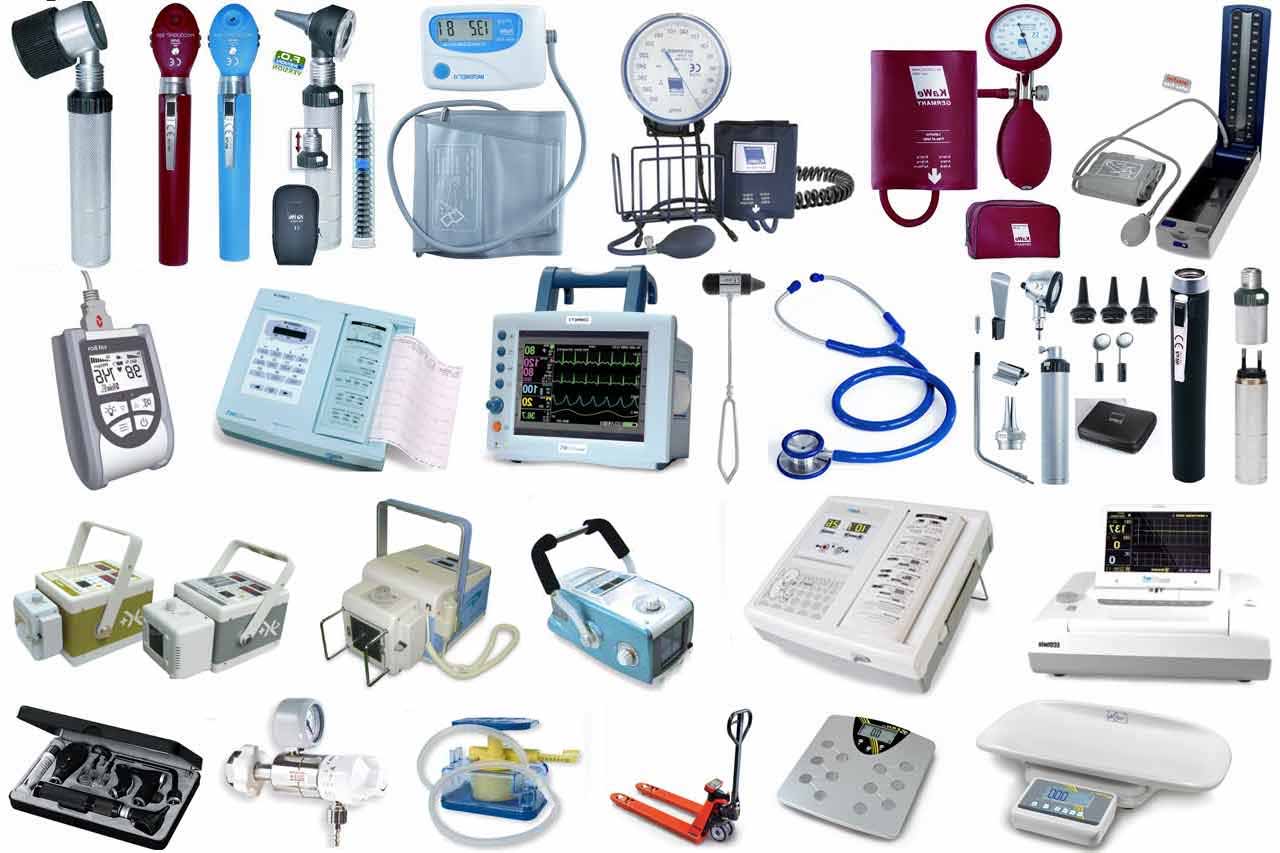
Mới đây, Bộ trưởng Bộ Y tế ban hành Thông tư 13/2021/TT-BYT quy định về cấp số lưu hành, nhập khẩu trang thiết bị y tế phục vụ phòng, chống dịch COVID-19 trong trường hợp cấp bách, trong đó, quy định danh mục gồm 17 trang thiết bị y tế phục vụ phòng, chống dịch COVID-19 được cấp nhanh số lưu hành.
- Thủ tục hải quan với hàng hóa NK viện trợ phòng, chống dịch COVID-19
- Điều kiện mua bán trang thiết bị y tế loại B, C, D
- Đã có Thông tư quy định cấp số lưu hành trang thiết bị y tế

17 trang thiết bị y tế chống dịch COVID-19 được cấp nhanh số lưu hành (Ảnh minh họa)
Cụ thể gồm:
- Máy tách chiết;
- Máy PCR;
- Hóa chất (sinh phẩm) chạy máy PCR xét nghiệm SARS-CoV-2;
- Test kít xét nghiệm nhanh kháng nguyên/ kháng thể kháng SARS-CoV-2;
- Máy thở chức năng cao, máy thở xâm nhập và không xâm nhập, máy thở không xâm nhập, máy oxy dòng cao, máy thở xách tay;
- Máy lọc máu liên tục;
- Máy X-Quang di động;
- Máy siêu âm Doppler màu ≥ 3 đầu dò;
- Máy đo khí máu (đo được điện giải, lactat, hematocrite);
- Máy theo dõi bệnh nhân ≥ 5 thông số;
- Bơm tiêm điện;
- Máy truyền dịch;
- Máy phá rung tim có tạo nhịp;
- Máy điện tim ≥ 6 kênh;
- Máy siêu âm xách tay;
- Máy đo thời gian đông máu;
- Máy đo huyết động.
Theo đó, Bộ Y tế quy định trang thiết bị y tế được áp dụng hình thức cấp nhanh số lưu hành nếu đáp ứng đồng thời các điều kiện sau:
(1) Thuộc Danh mục quy định tại Phụ lục 1 ban hành kèm theo Thông tư 13/2021/TT-BYT;
(2) Thuộc một trong các trường hợp sau đây:
- Đã được một trong các tổ chức sau cho phép lưu hành hoặc sử dụng khẩn cấp: Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) - Mỹ; Cục Quản lý hàng hóa trị liệu (TGA) - Úc; Cơ quan quản lý y tế Canada (Health Canada); Bộ Y tế, Lao động và Phúc lợi Nhật Bản (MHLW) hoặc Cơ quan Dược phẩm và Thiết bị y tế (PMDA) - Nhật Bản;
- Đã được cơ quan có thẩm quyền của các nước thuộc khu vực Châu Âu quy định tại Phụ lục 2 kèm theo Thông tư 13/2021 cho phép lưu hành, sử dụng khẩn cấp;
- Thuộc danh mục sản phẩm xét nghiệm SARS-CoV-2 được sử dụng khẩn cấp do WHO công bố trên trang web tại địa chỉ https://extranet.who.int (Coronavirus disease (COVID-19) Pandemic —Emergency Use Listing Procedure (EUL) open for IVDs | WHO - Prequalification of Medical Products (IVDs, Medicines, Vaccines and Immunization Devices, Vector Control);
- Thuộc danh mục các sản phẩm phổ biến để xét nghiệm SARS-CoV-2 do Ủy ban an ninh y tế của Châu Âu ban hành (Health Security Committee - EUHSC) công bố trên trang web tại địa chỉ https://ec.europa.eu (Technical working group on COVID-19 diagnostic tests | Public Health (europa.eu);
- Đã được cấp giấy phép nhập khẩu theo hình thức thương mại tại Việt Nam trước ngày 16/9/2021;
- Được sản xuất trong nước theo hình thức chuyển giao công nghệ đối với trang thiết bị y tế thuộc một trong các trường hợp trên;
- Được sản xuất trong nước theo hình thức gia công đối với trang thiết bị y tế thuộc một trong các trường hợp nêu trên.
Lưu ý:
- Số lưu hành của trang thiết bị y tế được cấp bao gồm:
+ Số xác nhận của Vụ Trang thiết bị và Công trình y tế trên văn bản công bố tiêu chuẩn áp dụng theo mẫu số 1 quy định tại Phụ lục 3 ban hành kèm theo Thông tư 13/2021 đối với trang thiết bị y tế thuộc loại B;
+ Số giấy chứng nhận đăng ký lưu hành đối với trang thiết bị y tế được Vụ Trang thiết bị và Công trình y tế cấp theo mẫu quy định tại Phụ lục 4 ban hành kèm theo Thông tư 13/2021 đối với trang thiết bị y tế thuộc loại C, D.
- Giá trị của số lưu hành: Số lưu hành được cấp có hiệu lực kể từ ngày 16/9/2021 đến ngày 31/12/2022.
Bảo Ngọc
 Mục lục bài viết
Mục lục bài viết