Mỗi Orbital nguyên tử chứa tối đa bao nhiêu Electron? Đánh giá kết quả giáo dục môn Hóa học như thế nào?
Mỗi Orbital nguyên tử chứa tối đa bao nhiêu Electron?
Orbital nguyên tử và Electron là những thuật ngữ trong môn Hóa học hiện nay.
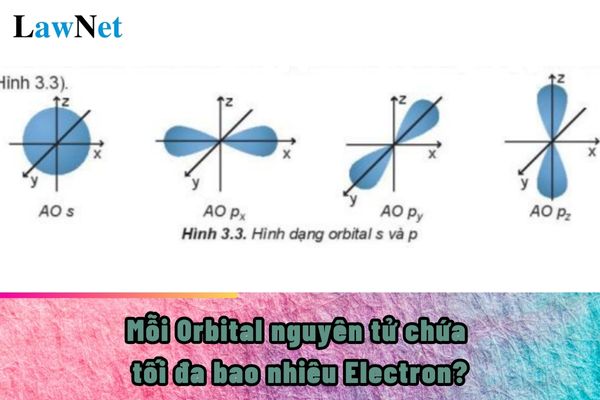
Mỗi Orbital nguyên tử chứa tối đa bao nhiêu Electron Là một quy tắc quan trọng trong cấu hình electron của nguyên tử, được gọi là nguyên lý Pauli. Nguyên lý này khẳng định rằng trong một nguyên tử, không có hai electron nào có cùng một bộ bốn số lượng tử. *Giải thích chi tiết: Orbital nguyên tử: Là vùng không gian xung quanh hạt nhân nơi xác suất tìm thấy electron là lớn nhất. Số lượng tử: Mỗi electron trong nguyên tử được đặc trưng bởi một bộ bốn số lượng tử: số lượng tử chính (n), số lượng tử phụ (l), số lượng tử từ (m) và số lượng tử spin (s). Nguyên lý Pauli: Để hai electron cùng tồn tại trong một orbital, chúng phải khác nhau ở ít nhất một số lượng tử. Số lượng tử spin là số lượng tử cuối cùng có thể khác nhau, với hai giá trị là +1/2 và -1/2. Vì vậy, mỗi orbital chỉ có thể chứa tối đa 2 electron, với mỗi electron có một chiều tự quay ngược nhau. *Ví dụ: Orbital 1s có thể chứa tối đa 2 electron. Orbital 2p có thể chứa tối đa 6 electron (vì có 3 orbital 2p, mỗi orbital chứa 2 electron). Orbital 3d có thể chứa tối đa 10 electron (vì có 5 orbital 3d, mỗi orbital chứa 2 electron). |
Lưu ý: Thông tin chỉ mang tính chất tham khảo./.
Mỗi Orbital nguyên tử chứa tối đa bao nhiêu Electron? Đánh giá kết quả giáo dục môn Hóa học như thế nào? (Hình từ Internet)
Orbital nguyên tử được học ở chương trình môn Hóa học lớp mấy?
Căn cứ theo Mục V Phụ lục Chương trình giáo dục phổ thông môn Hóa học ban hành kèm theo Thông tư 32/2018/TT-BGDĐT thì nội dung cụ thể và yêu cầu cần đạt ở lớp 10 như sau:
Cấu trúc lớp vỏ electron nguyên tử
- Trình bày và so sánh được mô hình của Rutherford - Bohr với mô hình hiện đại mô tả sự chuyển động của electron trong nguyên tử.
- Nêu được khái niệm về orbital nguyên tử (AO), mô tả được hình dạng của AO (s, p), số lượng electron trong 1 AO.
- Trình bày được khái niệm lớp, phân lớp electron và mối quan hệ về số lượng phân lớp trong một lớp. Liên hệ được về số lượng AO trong một phân lớp, trong một lớp.
- Viết được cấu hình electron nguyên tử theo lớp, phân lớp electron và theo ô orbital khi biết số hiệu nguyên tử Z của 20 nguyên tố đầu tiên trong bảng tuần hoàn.
- Dựa vào đặc điểm cấu hình electron lớp ngoài cùng của nguyên tử dự đoán được tính chất hoá học cơ bản (kim loại hay phi kim) của nguyên tố tương ứng.
Như vậy, có thể thấy rằng Orbital nguyên tử được học ở chương trình môn Hóa học lớp 10.
Đánh giá kết quả giáo dục môn Hóa học như thế nào?
Căn cứ theo Mục VII Phụ lục Chương trình giáo dục phổ thông môn Hóa học ban hành kèm theo Thông tư 32/2018/TT-BGDĐT thì việc đánh giá kết quả giáo dục như sau:
- Mục tiêu đánh giá kết quả giáo dục là cung cấp thông tin chính xác, kịp thời, có giá trị về mức độ đáp ứng yêu cầu cần đạt của chương trình và sự tiến bộ của học sinh để hướng dẫn hoạt động học tập, điều chỉnh các hoạt động dạy, quản lí và phát triển chương trình, bảo đảm sự tiến bộ của từng học sinh và nâng cao chất lượng giáo dục.
- Căn cứ đánh giá là các yêu cầu cần đạt về phẩm chất và năng lực được quy định trong Chương trình tổng thể và chương trình môn Hóa học. Phạm vi đánh giá là toàn bộ nội dung và yêu cầu cần đạt của chương trình môn Hoá học.
- Hình thức, phương pháp và công cụ đánh giá:
+ Hình thức đánh giá: Kết hợp các hình thức đánh giá quá trình (đánh giá thường xuyên), đánh giá tổng kết (đánh giá định kì) đánh giá trên diện rộng ở cấp quốc gia, cấp địa phương và các kì đánh giá quốc tế bảo đảm đánh giá toàn diện, thường xuyên và tích hợp vào trong các hoạt động dạy và học của giáo viên và học sinh.
+ Phương pháp đánh giá và công cụ đánh giá:
- Kết hợp đánh giá của giáo viên với tự đánh giá và đánh giá đồng đẳng của học sinh. Phối hợp đánh giá tình huống; đánh giá qua trắc nghiệm; đánh giá qua dự án và hồ sơ; đánh giá thông qua phản hồi và phản ánh; đánh giá thông qua quan sát.
- Kết hợp đánh giá sản phẩm học tập (bài kiểm tra tự luận, bài kiểm tra trắc nghiệm khách quan, trả lời miệng, thuyết trình, bài thực hành thí nghiệm, dự án nghiên cứu,…) với đánh giá qua quan sát (thái độ và hành vi trong thảo luận, làm việc nhóm, làm thí nghiệm, tham quan thực địa,…).
- Lựa chọn các phương pháp, công cụ phù hợp để đánh giá một năng lực cụ thể.
+ Để đánh giá thành phần năng lực nhận thức hoá học, có thể sử dụng các câu hỏi (nói, viết), bài tập,... đòi hỏi học sinh phải trình bày, so sánh, hệ thống hoá kiến thức hay phải vận dụng kiến thức để giải thích, chứng minh, giải quyết vấn đề.
+ Để đánh giá thành phần năng lực tìm hiểu thế giới tự nhiên dưới góc độ hoá học, có thể sử dụng các phương pháp, công cụ sau:
- Bảng kiểm hoặc ghi chép kết quả quan sát của giáo viên theo các tiêu chí đã xác định về tiến trình thực hiện thí nghiệm và các nhiệm vụ tìm tòi, khám phá của học sinh,...
- Các câu hỏi, bài kiểm tra nhằm đánh giá hiểu biết của học sinh về kĩ năng thí nghiệm; khả năng suy luận để rút ra hệ quả, phương án kiểm nghiệm, xử lí các dữ liệu đã cho để rút ra kết luận; khả năng thiết kế thí nghiệm hoặc nghiên cứu để thực hiện một nhiệm vụ học tập được giao và đề xuất các thiết bị, kĩ thuật thích hợp,...
- Báo cáo kết quả thí nghiệm, thực hành, làm dự án nghiên cứu,…
- Để đánh giá thành phần năng lực vận dụng kiến thức, kĩ năng đã học, có thể yêu cầu học sinh trình bày vấn đề thực tiễn cần giải quyết, trong đó phải sử dụng được ngôn ngữ hoá học, các bảng biểu, mô hình, kĩ năng thực nghiệm,... để mô tả, giải thích hiện tượng hoá học trong vấn đề đang xem xét; sử dụng các câu hỏi (có thể yêu cầu trả lời nói hoặc viết) đòi hỏi học sinh vận dụng kiến thức, kĩ năng vào giải quyết vấn đề học tập, đặc biệt là các vấn đề thực tiễn.

